Status for aktuelle projektor på Forskningslaboratorium for Stereologi og
Neurovidenskab, Bispebjerg Hospital
af Jonas Folke og Bente Pakkenberg
Forskningslaboratorium for Stereologi og Neurovidenskab (NLAB) er en mindre forskningsafdeling,
der beskæftiger sig fuld tid med videnskabeligt arbejde primært inden for hjerneforskning. NLAB
består af en stereologisk enhed som dagligt ledes af professor Bente Pakkenberg og en
molekylærbiologisk enhed ledet af seniorforsker Susana Aznar. I kombination dækker laboratoriet
over en bred ekspertise inden for forskning i hjernens struktur og funktion, herunder ekspertise om
patologiske forandringer i hjernen, biomarkører, neurogenetik og epidemiologi. I mange år har
laboratoriet fokuseret på hjernesygdomme som Parkinsons sygdom (PD) og Alzheimers sygdom
(AS). Siden 2010 har laboratoriet fokuseret meget på atypiske parkinsonistiske bevægesygdomme
såsom multipel system atrofi (MSA), progressiv supranukleær parese (PSP) og Lewy body demens
(LBD). NLAB arbejder primært sammen med læger og sygeplejersker på daghospitalet på
neurologisk afdeling på Bispebjerg Hospital. Laboratoriets forskning er primært finansieret af
private fonde og private donorer.
Tematisk forskning i MSA på NLAB
Strukturelle forandringer i hjernen
NLAB er verdens førende forskningslaboratorie i neurostereologi og har publiceret over 150
videnskabelige artikler inden for denne disciplin. Stereologi er en metode hvormed man, ved hjælp
af matematisk-statistiske metoder, kan bestemme tredimensionelle strukturer ved at tæller på
tynde hjernesnit igennem strukturen. Med denne metode kan man uhyre præcist estimere antallet
af celler, samt volumen af små og store områder i hjernen. Over de seneste 10 år har NLAB
undersøgt adskillige områder i hjernen hos patienter med MSA. Ved studier af hjerner, venligst
doneret af patienter før deres død, har vi blandt andet undersøgt antallet af forskellige hjerneceller
i forskellige områder af hjernen. MSA-patienter har en stærk nedsat funktion af motorikken. Disse
nedsatte funktioner har som i PD sit ophav i forandringer i den midterste del af hjernen, kaldet
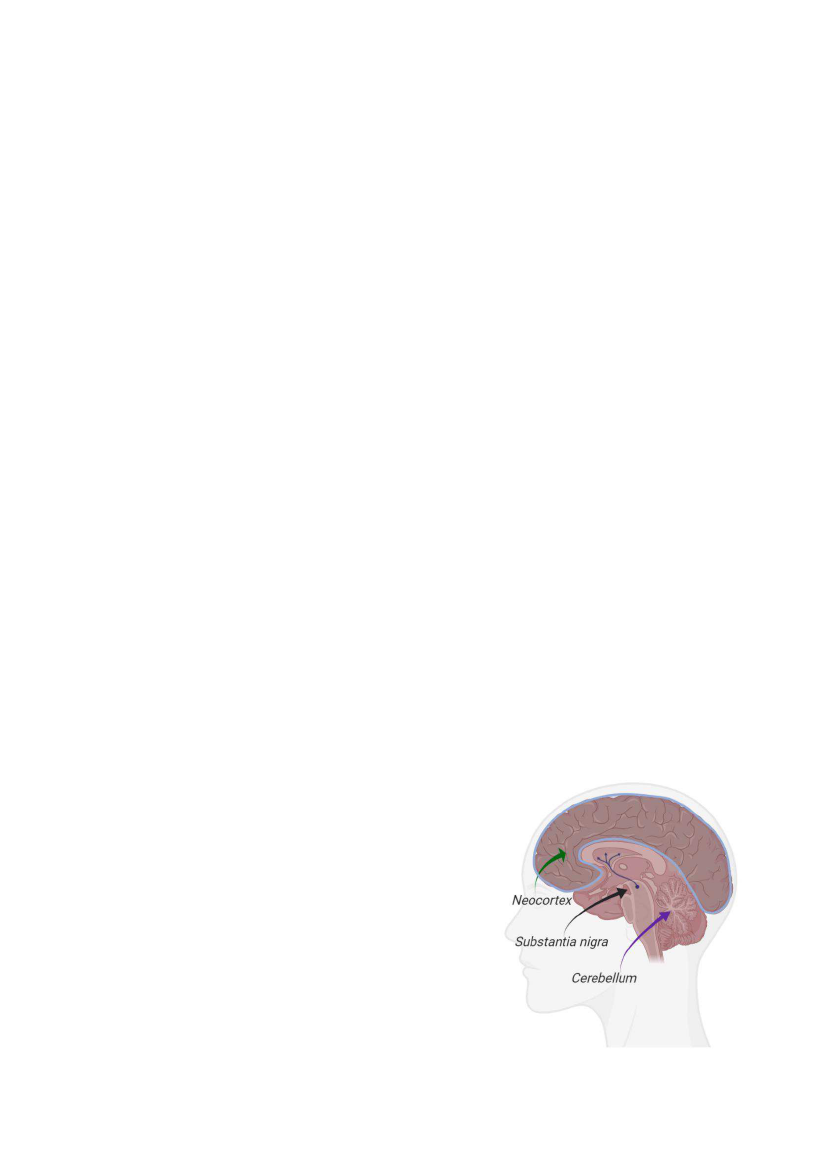
basalganglierne. Vigtigst i denne er den sorte substans kaldet
substantia nigra (se billede), hvor alle dopaminceller udløber
fra. Ved at sammenligne MSA hjerner med kontrolhjerner
fandt vi et markant fald af nerveceller på 55 % i substantia
nigra og i de lidt øvre dele af basalganglierne. Omvendt
observerede vi en kraftig forøgelse i antallet af mikroglia
celler (104-222 %). Mikroglia er hjernens immunceller og
repræsentere immunforsvaret i hjernen. Denne forøgelse
bevidner en kraftig aktivering af immunsystemet i hjernen.
Hvorvidt denne immunaktivering er beskyttende eller
ødelæggende, vides ikke. Disse studier ledte os ind på at
1