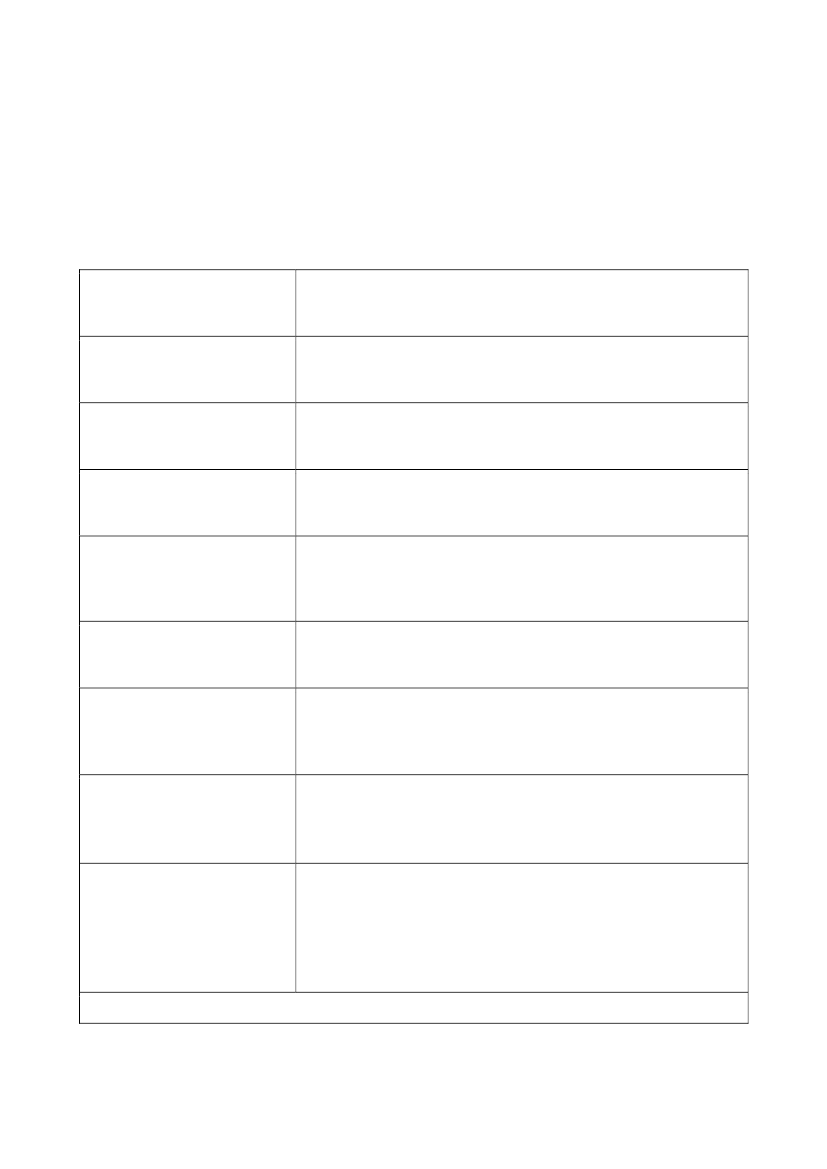
Baggrund for Medicinrådets anbefaling
vedrørende nusinersen til patienter med 5q
spinal muskelatrofi
Handelsnavn
Spinraza
Generisk navn
Nusinersen
Firma
Biogen
ATC-kode
M09AX07
Virkningsmekanisme
Survival motor-neuron-2 (SMN2)-dirigeret antisense
oligonukleotid
Administration/dosis
Intratekal injektion 12 mg/5 ml
EMA-indikation
5q spinal muskelatrofi
Vurderet population ved
Medicinrådet
Patienter med
5q spinal muskelatrofi (SMA)
Godkendelsesdato
Offentliggørelsesdato
Dokumentnummer
Versionsnummer
30. januar 2018
30. januar 2018
14326
2.0
For fagudvalgets sammensætning og sekretariatets arbejdsgruppe se afsnit 8.
Side
1
af
8