Sundheds- og Forebyggelsesudvalget 2012-13
SUU Alm.del Bilag 324
Offentligt
De Videnskabsetiske Komiteersfælles årsberetning2012
Redaktionel tilrettelæggelse:Sekretariatschef Pernille SeatonDen NationaleVidenskabsetiske Komitémaj 2012Grafisk tilrettelæggelse:Grafisk Service, Region SyddanmarkISSN:1901-3973
De Videnskabsetiske Komiteersfælles årsberetning2012
Den Videnskabsetiske Komité for Region Nordjylland (RVK N)De Videnskabsetiske Komiteer for Region Midtjylland (RVK M)Den Videnskabsetiske Komité for Region Syddanmark (RVK S)Den Videnskabsetiske Komité for Region Sjælland (RVK Sj)De Videnskabsetiske Komiteer for Region Hovedstaden (RVK H)Den Nationale Videnskabsetiske Komité (DNVK)
IndholdsfortegnelseIntroduktion . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Redegørelse for komiteernes virksomhed– aktivitet, service og praksis . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .6
8
Den Videnskabsetiske Komité for Region Nordjylland . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13De Videnskabsetiske Komiteer for Region Midtjylland . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13Den Videnskabsetiske Komité for Region Syddanmark . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 13Den Videnskabsetiske Komité for Region Sjælland . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 14De Videnskabsetiske Komiteer for Region Hovedstaden . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15Den Nationale Videnskabsetiske Komité . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 16
Væsentlige sager, begrundelser og videnskabsetiske drøftelser . . . . . . . . . . . . . . . . . . . . . . . . . 18Den Videnskabsetiske Komité for Region Nordjylland . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 18De Videnskabsetiske Komiteer for Region Midtjylland . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19Den Videnskabsetiske Komité for Region Syddanmark . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23Den Videnskabsetiske Komité for Region Sjælland . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24De Videnskabsetiske Komiteer for Region Hovedstaden . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25Den Nationale Videnskabsetiske Komité . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 27
Udviklingstendenser, samarbejde og koordinering . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32Samordningsforum . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32Kontaktforum . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32Udviklingstendenser inden for den sundhedsvidenskabelige forskning . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32Udviklingstendenser på europæisk plan . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
Kontrol og kvalitetsudvikling . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 36Den Videnskabsetiske Komité for Region Nordjylland . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 36De Videnskabsetiske Komiteer for Region Midtjylland . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37Den Videnskabsetiske Komité for Region Syddanmark . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39Den Videnskabsetiske Komité for Region Sjælland . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40De Videnskabsetiske Komiteer for Region Hovedstaden . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42Den Nationale Videnskabsetiske Komité . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
Årsberetning 2012
4
IndholdsfortegnelseÅrsmøde . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46Den videnskabsetiske hæderspris . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48Internationalt samarbejde . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50Høringer . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52De regionale komiteers høringssvar . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52Den nationale komités høringssvar . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 53
English summary . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 56
5
IntroduktionDe videnskabsetiske komiteer er nedsat af regionerneog behandler alle typer af forskningsprojekter indenfor sundhedsvidenskaben, hvor der indgår menneskereller menneskers biologiske materiale . Komiteerneskal sikre, at de anmeldte projekter gennemføresvidenskabsetisk forsvarligt, således at forsøgsperso-nerne beskyttes, samtidig med at der skabes ny viden .Den Nationale Videnskabsetiske Komité (DNVK), somblev etableret 1 . januar 2012, skal koordinere arbejdeti de regionale komiteer og behandle klagesager samtprojekter, der omhandler særlige komplekse forsk-ningsområder .Komiteerne har hidtil udgivet deres årsberetningerhver for sig . Som følge af den nye komitélov skalder fra 2012 og fremover udarbejdes en fælles årligrapport for hele komitésystemet . Formålet er at skabestørre sammenhæng og gennemsigtighed på om-rådet .Den ændrede komitélov har virket i over et år ogberetningen indledes med de væsentligste ændringeri loven . Beretningen giver herudover et overblik overnøgletal på området, dvs . antallet af anmeldte projek-ter, tillægsprotokoller og sagsbehandlingstider m .v . ikomitésystemet .Beretningen giver også indsigt i de videnskabsetiskeproblemstillinger, som komiteerne beskæftiger sigmed i løbet af året . Et væsentligt tema er fx indhent-ning af det informerede samtykke fra forsøgspersoner,som også var et tema på komiteernes årsmøde . Pådagsordenen for møderne var også biobanker, dis-pensation fra at indhente samtykke hos forsøgsper-soner, omfattende kortlægning af den menneskeligearvemasse, børn i forsøg samt telemedicin .I beretningen redegør komiteerne for deres gennem-førelse af videnskabsetisk kontrol med godkendteprojekter . Helt overordnet set viser komiteernes efter-følgende kontrol af projekterne ikke alvorlige sikker-hedsmæssige afvigelser . Der er behov for fokus på, atforsøgsansvarlig skal indsende afsluttende rapport ogansøge om forlængelse, når projektperioden udløber,men også på mere regelret udfyldelse af samtykkeer-klæringerne og opdatering af deltagerinformationerne .Af udviklingstendenser kan nævnes, at der er tagetinitiativer regionalt til at øge antallet af kliniske forsøg .Årsberetning 2012
Dette sker ved at fremme samarbejdet med erhvervs-livet . Med afsæt i praksis er der også udarbejdetretningslinjer for behandling af projekter med omfat-tende kortlægning af det menneskelige genom . Påeuropæisk plan forhandles der om en ny forordningom anmeldelse af kliniske lægemiddelforsøg samten forordning om behandling af personoplysninger .Komitésystemet henter inspiration til at udvikle områ-det ved at deltage i møder i europæiske og nordiskefora og organisationer . Gennemgående viser dette, atde videnskabsetiske problemstillinger inden for sund-hedsvidenskabelig forskning generelt er de sammepå tværs af landegrænserne .
LovændringenDen 1 . januar 2012 trådte den nye komitélov i kraft(Lov nr . 593 af 14 . juni 2011 om videnskabsetiskbehandling af sundhedsvidenskabelige forsknings-projekter) .Siden den første komitélov fra 1992 er der løbendeforetaget revisioner af lovgivningen om det viden-skabsetiske komitésystem, senest i 2006 . Disse lov-revisioner har imidlertid primært været gennemførtsom følge af anden lovgivning og international regu-lering, hvorfor der opstod et behov for en meregennemgribende analyse af det videnskabsetiskekomitésystem med henblik på at vurdere, om dennuværende struktur og styring af komitésystemet erden mest hensigtsmæssige .Ministeren for Sundhed og Forebyggelse nedsattederfor i foråret 2009 et udvalg, som fik til opgave atudarbejde en betænkning om revision af det viden-skabsetiske komitésystem med henblik på en revisionaf lovgivningen herom .Revisionen af loven var baseret på udvalgets anbe-falinger i betænkning nr . 1515 om revision af detvidenskabsetiske komitésystem (marts 2010) .Anbefalingerne berørte navnlig:• En fremtidssikret struktur• Ny opgavefordeling og klar opgaveportefølje,herunder vedrørende opfølgning og kontrol medgodkendte forskningsprojekter• Forbedring af mulighederne for at forske i akuttesituationer• Smidig sagsbehandling
6
I NtRoDU KtIoN
Den reviderede lov gennemfører mange af udvalgetsanbefalinger, eksempelvis vedrørende komitésyste-mets opbygning og struktur, smidigere sagsbehandlingog bedre rammer til at understøtte komitésystemetsopfølgning og kontrol med godkendte sundhedsviden-skabelige forskningsprojekter . Herudover gennemførerloven forhold, der ikke er behandlet af udvalget, mensom komitésystemet eller andre aktører på områdethar bragt op, samt temaer, som hverken udvalget,komitésystemet eller andre aktører har bragt til debat .
Hovedpunkterne i den reviderede komitélov• Etablering af en styrket national komitémedudvidet opgaveportefølje og flere beføjelser, 13medlemmer og mindre regional repræsentation(Komitélovens § 38) . Det forudsættes, at DNVKskal styrke koordinering af komitesystemet, fx vedat udstede flere vejledende retningslinjer .Der er i loven hjemmel til, at DNVK ved behov forfastsættelse af bindende retningslinjer kan udarbej-de forslag herom med indstilling til Ministeriet forSundhed og Forebyggelse .• Formændene for de regionale komiteer vælgesblandt komiteernes forskningsaktive medlemmer(Komitélovens § 36, stk . 3) .• Ændring af begrebet »biomedicin« til »sundheds·videnskab«med henblik på en modernisering afloven . Der er ikke tiltænkt en indholdsmæssigændring af begrebet .• Undtagelse af anonymt, biologisk materiale fraanmeldelsespligtensåfremt materialet er ind-samlet i overensstemmelse med national ret(Komitélovens § 14, stk . 3) .• Den nationale komité skal behandle sager påsærligt komplekse områder(Komitélovens § 15,stk . 1, 2 . pkt .) . Kompetencen er præciseret ved§ 2 i bekendtgørelse om information og samtykkemv ., og omfatter følgende sagsområder:• Forskning i akutte situationer• Forskning i biologisk materiale udtaget i forbin-delse med retsmedicinske obduktioner• Forsknings vedrørende lægemidler til avanceretterapi• Forskning vedrørende omfattende kortlægning afindividets arvemasse (genomsekventering)• Forskning vedrørende psykokirurgi
• En målrettet og gradueret opfølgning og kontrolbaseret på en samlet vurdering af forsøgsprojek·terne .Allerede i forbindelse med forskningsprojek-tets godkendelse skal der foretages en samlet vur-dering af projektet og på den baggrund tages stillingtil kontrollens omfang . Kontrolopgaven forankres iden regionale komité, som har godkendt det på-gældende forsøg, eller som ville være kompetenttil at behandle anmeldelsen, hvis sagen ikke ved-rørte et særligt komplekst område eller i øvrigt varindbragt for den nationale komité . For at sikre, atopfølgningen og kontrollen standardiseres, får dennationale komité til opgave at udarbejde vejled-ninger på området (Komitélovens § 17, stk . 3 og§ 28) .• Præcisering af de lovgivningsmæssige kompe·tencer til at løfte kontrolopgaven .Lovrevisionengiver komitésystemet adgang til relevante dele afpatientjournalen i forbindelse med gennemførelseaf kontrol, og repræsentanter fra komitésystemet fårret til uden forudgående retskendelse at foretagekontrol på virksomheder, sygehuse m .v . Loven giverendvidere hjemmel til at stoppe et forsøgsprojekteller eventuelt udstede påbud . De nye regler kandesuden sanktioneres med straf (komitélovens§§ 28 og 29) .• Lempeligere adgang til at forske i akuttesituationertil gavn for patientgruppen (ikke-læge-middelforsøg komitélovens § 11, stk . 1, nr . 2) .Bestemmelsen er en gennemførelse af tillægs-protokol til Europarådets Bioetikkonvention .• Flertalsafgørelser i de regionale komiteer .Derskal være tale om et kvalificeret flertal, ligesom ogsået kvalificeret mindretal beskyttes med en adgangtil at indbringe sager for den nationale komité .Desuden er der indført hjemmel til, at formand-skabet i en regional komité kan træffe afgørelse iukomplicerede og rutineprægede sager (komité-lovens § 24) .• Mulighed for forskning i materiale fra retsmedi·cinske obduktioner(Komitélovens § 8, stk . 1) .
7
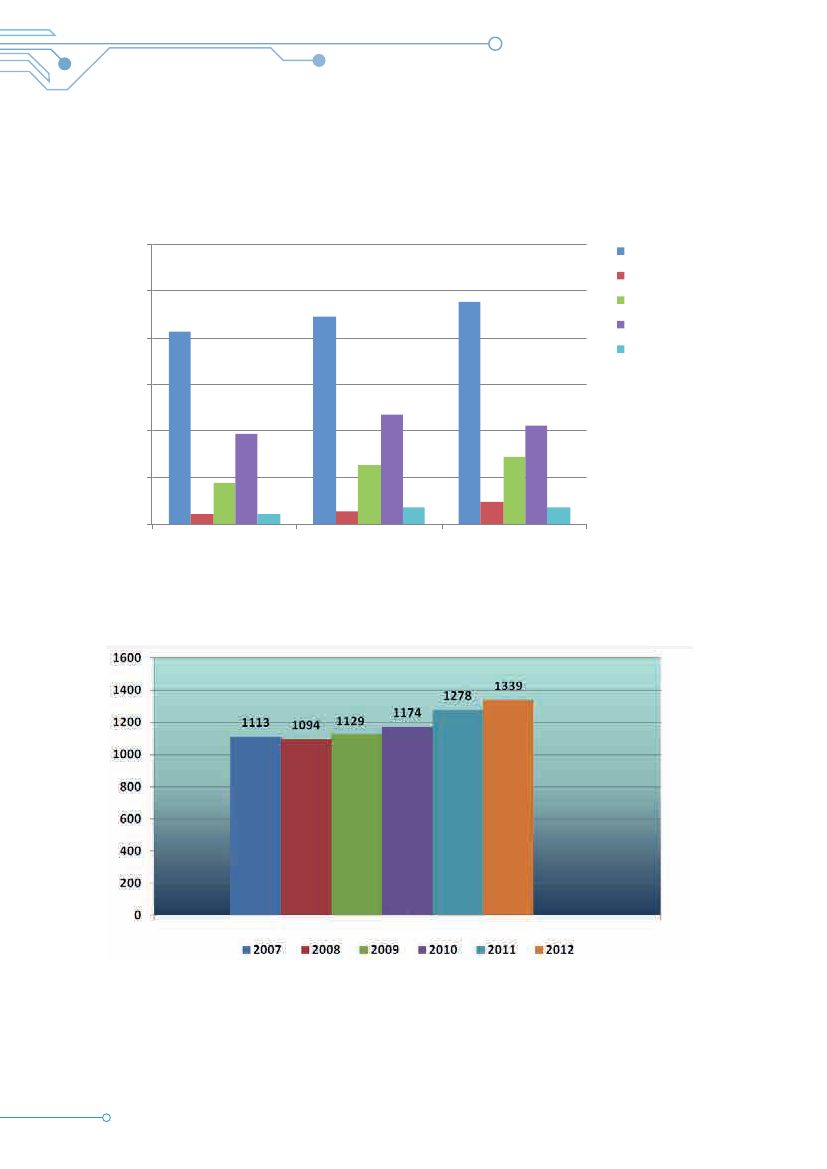
Redegørelse for komiteernes virksomhed– aktivitet, service og praksisNedenfor vises nøgletal for komiteernes virksomhed .Man kan se udviklingen i antallet af anmeldte forsk-ningsprojekter, herunder antallet af modtagne æn-dringer til forskningsprotokollerne (tillægsprotokoller),i tidsrummet 2010-2012 .Der er også ført statistik over fordelingen af projektermed lægemiddelforsøg og andre typer af forsøg, ogder er oversigter over sagsbehandlingstider m .v .Antallet af anmeldte forskningsprojekter er stigende .Dog stagnerer antallet af lægemiddelforsøg, der ud-gør ca . en femtedel af projekterne, samlet set .Sammenlignes disse tal med Sundhedsstyrelsensstatistik i årsrapporten for 2011 er det primært antal-let af forskerinitierede ansøgninger, der er steget .Antallet af industriinitierede ansøgninger ligger fortsatpå et lavere niveau end før 2010 .For tillægsprotokollerne er der tale om en stærktopadgående tendens inden for de senere år .De statistiske data efterfølges af en kort beskrivelseaf aktiviteterne i de enkelte regioner .
Antal komitémøder afholdt i komitésystemet i 2012 fordelt på regioner og DNVKRVK H(6 komiteer)60Tabel 1
RVK Sj
RVK S
RVK M(2 komiteer)22
RVK N
DNVK
7
11
10
9
Nøgletal 2012
775
1339
Antal nye projekterAntal tillægsprotokollerSkriftlige forespørgsler
1841Tabel 2
Det videnskabsetiske komitésystem afgjorde i 2012 i alt 1351 nye forskningsprojekterÅrsberetning 2012
8
R EDEGøR EL SE FoR KoM ItE ER N E S VI R K SoM H ED
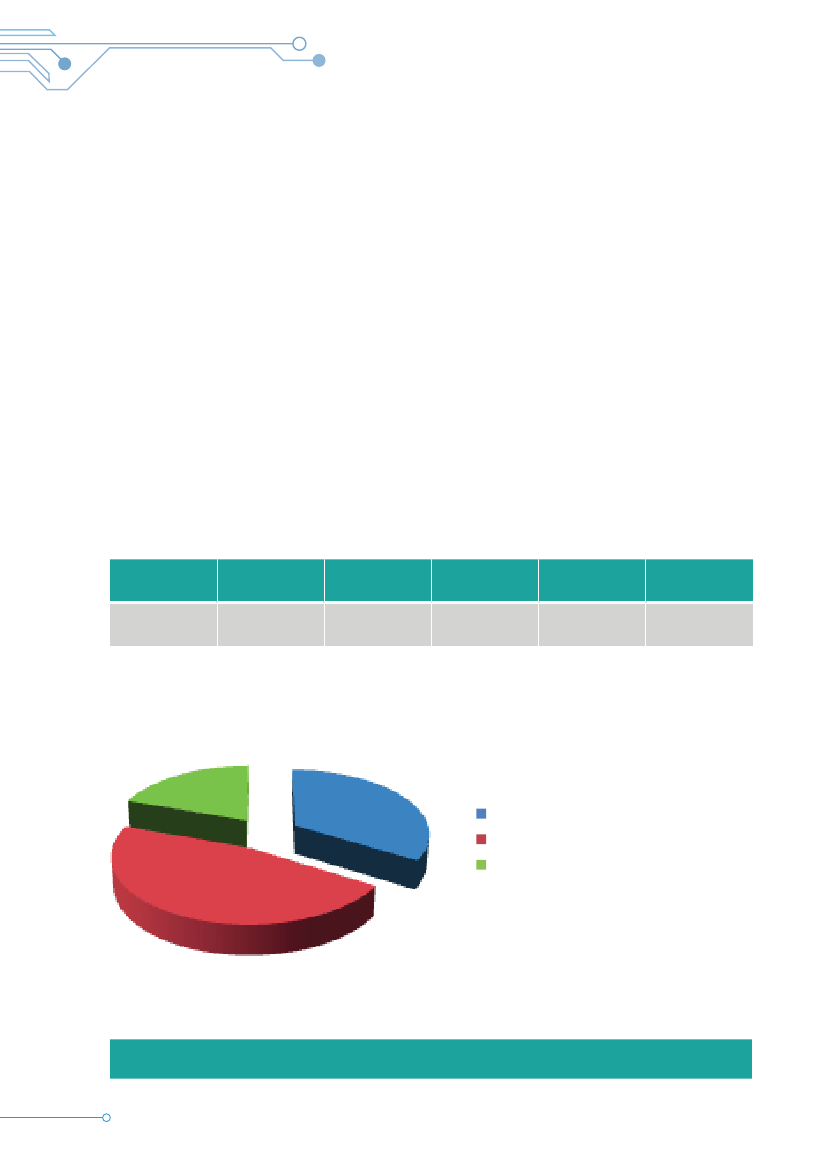
Anmeldte forskningsprojekter til komitésystemet i 2012fordelt på lægemiddelforsøg og øvrige forsøg
21%Lægemiddelforsøg: 281Øvrige forsøg: 1.058
79%Tabel 3
Anmeldte lægemiddelforsøg og øvrige forsøg til komitésystemet i 2012fordelt på regioner og DNVK60050040030020010006RVK H1524841RVK S14264RVK M7411RVK N7 14DNVKTabel 4
533
LMF247Øvrige
RVK Sj
Udviklingen i antal anmeldte nye forskningsprojekter til komitésystemetfra 2010·2012 fordelt på regioner og DNVK(DNVK kun 2012)
Tabel 5
9
R E D EGø R EL S E Fo R Ko M I tEER N ES VI R KSoM H ED
Udviklingen i antal anmeldte tillægsprotokoller til komitésystemet955$
1000$
892$
fra 2010 ·2012 fordelt på regioner824$
1200$
800$
1000$
600$
824$
800$
400$
600$
200$
45$
400$
0$
200$
0$
2010:$1483$
2011:$1747$
2012:$1841$
388$
257$
181$
388$
45$
55$
471$ 72$
100$
423$
288$
2012:$1841$
72$
100$
75$
Tabel 6
RVK$H$
955$
471$
423$
288$
RVK$Sj$
RVK$S$
RVK$M$
RVK$H$
RVK$N$
RVK$Sj$
75$
RVK$S$
RVK$M$
DNVK modtog ikketillægsprotokollerRVK$N$
til 1. instanssageri 2012
Udviklingen i antal anmeldte forskningsprojekter til komitésystemet 2007·2012
Tabel 7
Årsberetning 2012
10
R EDEGøR EL SE FoR KoM ItE ER N E S VI R K SoM H ED
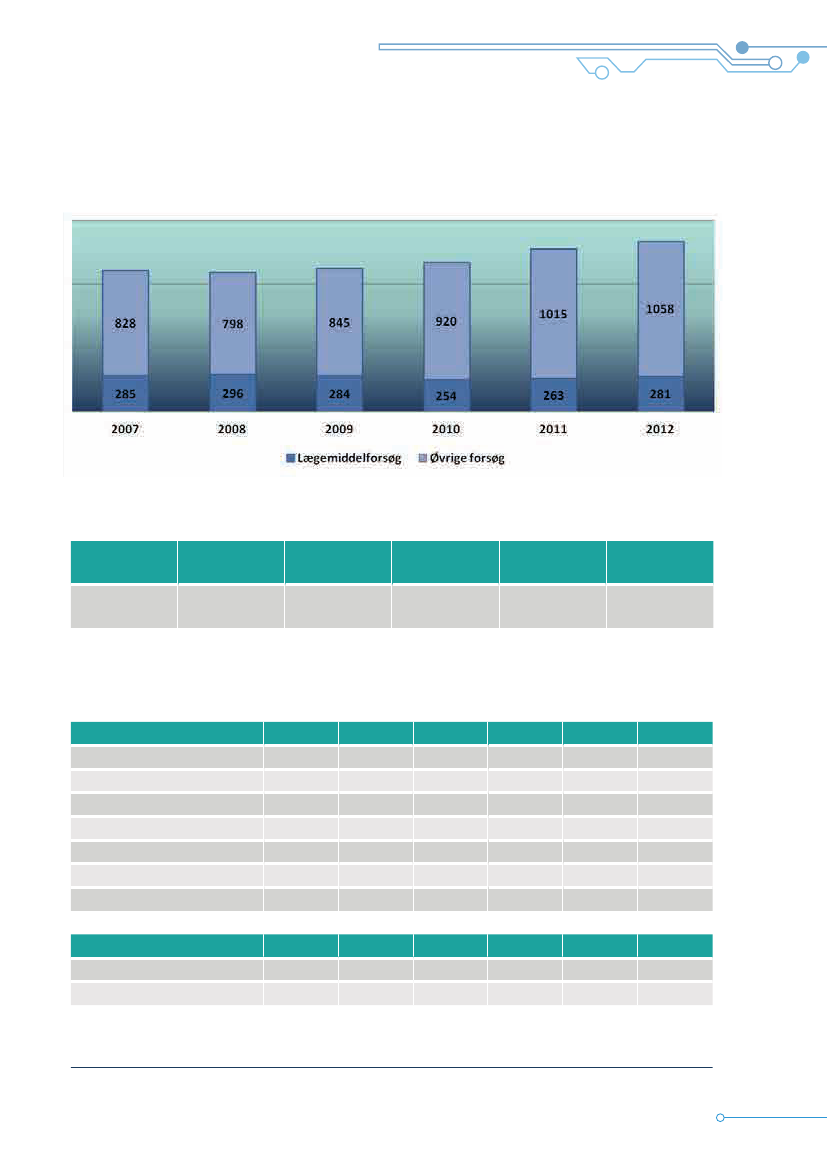
Udviklingen i antal anmeldte Lægemiddelforsøg og Øvrige forsøg til komitésystemet 2007·2012
Tabel 8
Skriftlige forespørgsler om anmeldelsespligt m .v .RVK H353Tabel 9
RVK SjEj optalt
RVK S164
RVK M213
RVK N45
DNVK149
Afgjorte forskningsprojekter i alt og fordelt på regioner/DNVK og afgørelserAfgørelseGodkendtGodkendt på vilkårEj godkendtEj anmeldelsespligtigHenlagtVersererAfgjort i alt: 1351AfgørelserAfgørelser truffet i enighedAfgørelser truffet ved flertalTabel 10
RVK H275282778394681RVK H5631
RVK Sj10400311154RVK Sj540
RVK S9182319201971RVK S1970
RVK M15212801940303RVK M3030
RVK N32443124495RVK N950
DNVK013305021DNVK133
1)Projekter anmeldt i 2011 og 2012 afgjort i 2012
11
R E D EGø R EL S E Fo R Ko M I tEER N ES VI R KSoM H ED
Sagsbehandlingstider fordelt på regioner/DNVKAfgjorte nye projekterAfgjort indenfor 60 dageAfgjort efter 60 dageI altAfgjorte tillægsprotokollerAfgjort indenfor 35 dageAfgjort efter 35 dageI altTabel 11
RVK H548165642RVK H9550955
RVK Sj51354RVK Sj964100
RVK S153211743RVK S2657272
RVK M28914303RVK MEj optaltEj optalt–
RVK N771784RVK N75075
DNVK10616DNVK000
2)Projekter afgjort på møde3)Kun 2012 projekter anmeldt efter ny lov er medtaget her4)Kun 2012 projekter anmeldt efter ny lov er medtaget herÅrsberetning 2012
12
R EDEGøR EL SE FoR KoM ItE ER N E S VI R K SoM H ED
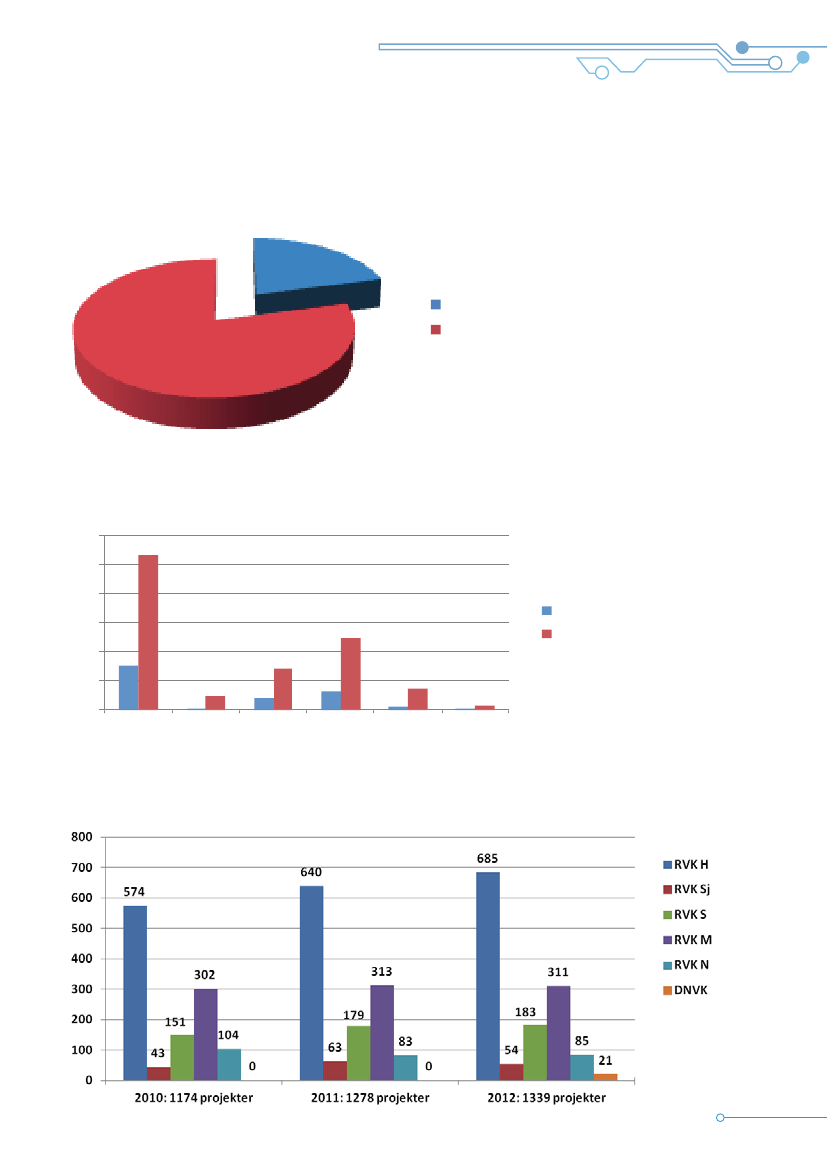
Den Videnskabsetiske Komitéfor Region NordjyllandRegionsrådet i Region Nordjylland har nedsat énvidenskabsetisk komité . Komiteen består af syv med-lemmer – fire lægmænd og tre forskningsaktive med-lemmer og derudover to suppleanter for de forsk-ningsaktive medlemmer .Komiteen sekretariatsbetjenes af to administrativemedarbejdere, der samtidig varetager andre opgaverfor regionen .Komiteen afholdte 10 møder i 2012 . Foruden hen-vendelser omkring anmeldelsespligt og i alt seks til-lægsprotokoller, der er behandlet på møderne i løbetaf året, så drejer det sig om 100 sager, der er be-handlet . Dette tal er inklusiv fire sager, der er blevetgenbehandlet . Det giver gennemsnitligt 10 sager pr .møde, men i praksis har der været tale om et spændpå fem projekter på enkelte møder og 15-17 påandre .Komiteen har i 2012 haft en gennemsnitlig sags-behandlingstid på 29,39 dage for nye projekter .98,7% af projekterne er afgjort inden for den lov-fastsatte frist på 60 dage .I indeværende komitéperiode er der set en markantstigning af projekter sammenlignet med tidligere år .Antallet af projekter i 2012 var dog en anelse mindreend i de to foregående år . Således oplevede komi-teen en stigning på ca . 60% fra 2009 til 2010 i antalafgørelser . I 2011 blev der truffet ca . 26% flere afgø-relser end året før, men i 2012 er antallet så faldetmed ca . 7% .
I 2012 modtog komiteerne i Region Midtjylland 311nye projekter til bedømmelse . I 2010 blev der an-meldt 302 nye projekter og i 2011 313 nye projekter .Der er således en svag stigning i antallet af nye pro-jekter .I samme periode var antallet af tillægsprotokoller i2010 på 388 tillæg, i 2011 på 471 tillæg og i 2012på 423 tillæg . Antallet af tillæg har siden 2007 væretstigende, dog med et mindre fald i 2012 .Gennemsnitlig sagsbehandlingstid for et nyanmeldtprojekt er 36 dage . 95% af projekterne er afgjortinden for den lovfastsatte frist på 60 dage .Sekretariatet og/eller de to formænd for komiteernehar i 2012 behandlet 213 skriftlige forespørgsler omanmeldelsespligt til komitésystemet og et tilsvarendeantal telefoniske forespørgsler er blevet behandletaf sekretariatet . Antallet af forespørgsler har væretnogenlunde stabilt i de seneste år .Der henvises til afsnittet om kontrol og kvalitetsudvik-ling for information om komiteerne i Region Midt-jyllands kontrol med godkendte forskningsprojekter .
Den Videnskabsetiske Komitéfor Region SyddanmarkDen videnskabsetiske Komité for Region Syddanmarkhar i 2012 afholdt 11 møder, hvor der blev behandlet197 nye projekter . Den faglige variation af projekternespænder vidt .Region Syddanmark havde i 2012 én videnskabsetiskkomité med 11 medlemmer (i foråret 2013 nedsæt-tes yderlige en komité med 11 medlemmer) . I 2012var sammensætningen af komitémedlemmer uæn-dret i forhold til tidligere .Der behandles i gennemsnit 15-20 nye projekterpå hvert komitémøde, hvortil kommer et varierendeantal genbehandlingssager og forespørgsler omanmeldepligt . 88% af de afgjorte sager er afgjortinden for 60-dagesfristen .Både graden, kompleksitet og antallet af anmeldteforskningsprojekter, tillægsprotokoller og forespørgslerom anmeldepligt synes at være stigende .
De Videnskabsetiske Komiteerfor Region MidtjyllandI Region Midtjylland er der nedsat to videnskabsetiskekomiteer, hver med 11 medlemmer (seks lægmed-lemmer og 5 sundhedsfaglige medlemmer) . Komite-erne holdt konstituerende møder i marts 2010 .Begge komiteer har haft udskiftninger af både forsk-ningsaktive og lægmedlemmer – i alt 2 medlemmerer blevet udskiftet i perioden . I 2012 holdt hverkomité 11 møder . I gennemsnit blev der behandlet14 sager pr . møde .
13
R E D EGø R EL S E Fo R Ko M I tEER N ES VI R KSoM H ED
Den Videnskabsetiske Komitéfor Region SjællandI Region Sjælland er der nedsat én videnskabsetiskkomité med 11 medlemmer (seks lægpersoner ogfem forskningsaktive medlemmer) . Komiteen holdtsit konstituerende møde i marts 2010, og der er kunudskiftet få (forskningsaktive) medlemmer i indevæ-rende komitéperiode . Udskiftningerne har skyldtesskift af arbejdsplads eller sygdom . Komiteen afholdtsyv møder i 2012, jf . tabel 1 .Jf . tabel 5 modtog RVK Sjælland i 2012 54 nye an-meldelser af forsøg til bedømmelse . Antallet af forsøgfluktuerer fra år til år med en stigende tendens – entendens der påregnes at fortsætte, da regionsrådethar bevilget 12 mio . kr ./år ekstra til forskningen i2012 og yderligere 18 mio .kr . i 2013 . tillige er sam-arbejdet med universiteter i og uden for regionensamt Region Syddanmark om forskning blevet udvi-det . Disse initiativer afspejles dog ikke momentant iantallet af anmeldte forsøg pga . behovet for at udar-bejde protokoller, opslå og besætte ph .d .-stipendieretc ., før der anmeldes forsøg til komitésystemet .I 2012 behandlede komiteen 100 tillægsprotokoller .Det er næsten en fordobling i forhold til året før, enudvikling der er kraftigere end den hidtidige tendenstil en stadig stigning i antallet af tillægsprotokoller .RVK Sjælland gennemførte i efteråret 2012 viden-skabsetisk kontrol af ca . 5% af de forsøg, der på dettidspunkt var i gang i Region Sjælland . For en nær-mere gennemgang af denne kontrol se afsnittet omKontrol og kvalitetsudvikling .Komitésekretariatet omfatter en sagsbehandler ogen sekretær . Mhp . optimal ressourceudnyttelse ogmaksimal fleksibilitet i opgavevaretagelsen varetagerbegge medarbejdere andre funktioner i regionen .
SagsbehandlingstidenSagsbehandlingstiderne i 2012 fremgår af tabel 11 .Efter modtagelsen af en anmeldelse gennemgåsden for manglende dokumenter mv . mhp . opfyldelseaf komitélovens formelle krav til anmeldelser . Somhovedregel mangler der enten dokumenter eller datai de modtagne anmeldelser . Så vidt muligt kontaktersekretariatet anmelderne mhp . fremsendelse af disseforud for udsendelsen af dagsordenen for at frem-skynde godkendelsesproceduren og give komiteenmulighed for at koncentrere sig om videnskabsetiskeproblemstillinger i stedet for formalia .RVK Sjælland har indført elektronisk sagsbehandlingpå linje med regionsrådet og regionens øvrige politi-ske udvalg . Anmeldelserne udsendes elektronisk tilkomiteens medlemmer således, at de har to week-ender at forberede sig på mødet i . Antallet af forsøgpr . møde fluktuerer kraftigt .om aftenen efter et komitémøde udsendes etudkast til afgørelsesbreve og et referatudkast til komi-teens medlemmer . Når komiteens medlemmer harkommenteret/tiltrådt udkastene, sendes afgørelserneelektronisk til anmelderne – dog senest en uge efterafholdelsen af mødet .Som hovedregel godkendes forsøg betinget af at spe-cifikke krav i lovgivningen opfyldes . Et mindretal af an-meldelser godkendes uden betingelser . Som hoved-regel er det komiteens formandskab der tager stillingtil, om betingelserne er opfyldt . Kun i meget få tilfæl-de har komiteens betingelser en sådan karakter, atmaterialet skal forelægges hele komiteen igen . I 2012var der ikke forsøg, der blev afslået af RVK Sjælland,men 11 forskere har foreløbig undladt at indsende etrevideret materiale efter at have modtaget komiteensbetingelser for endelig godkendelse . Det behøver ikkeat betyde, at forsøgene ikke bliver gennemført, menkan afspejle, at en stor del af den sundhedsvidenska-belige forskning i Danmark foregår i sundhedsforsker-nes fritid, hvorfor der kan gå et stykke tid, før forsker-ne får tid til at revidere anmeldelserne – det tagerkomiteen hensyn til, når der fastsættes frister forfremsendelse af revideret materiale .
Årsberetning 2012
14
R EDEGøR EL SE FoR KoM ItE ER N E S VI R K SoM H ED
I tre ud af 54 tilfælde oversteg sagsbehandlingstidenfristen på 60 dage . Alle tre overskridelser fandt sted ibegyndelsen af 2012 . to af forsøgene var godkendtbetinget i 2011 .Forsinkelserne kunne henføres til:• En omfangsrig protokol med omfattende revisionerefter en betinget godkendelse . Ændringerne gjordedet nødvendigt at foretage en detaljeret sammen-ligning af den oprindelige og den reviderede proto-kol for at sikre, at der var gennemført de ønskedeændringer og ikke tilføjet yderligere ændringer, somhele komiteen burde tage stilling til .• En protokol med behov for verifikation af en rækkeoplysninger og en nær relation til et allerede god-kendt forsøg, der gjorde det nødvendigt at sammen-ligne de to forsøg meget detaljeret .• En teknisk fejl ved udsendelsen af flere endeligegodkendelser, så en enkelt anmelder ikke modtogden samtidig med de øvrige forskere .tillægsprotokoller behandles løbende af komiteensformandskab og sekretariatet . Kun undtagelsesvis erder behov for at forelægge en tillægsprotokol for helekomiteen . I fire ud af 100 tilfælde oversteg sagsbe-handlingstiden fristen på 35 dage . Alle disse fire til-lægsprotokoller vedrørte ét forsøg, hvortil der nu eranmeldt 15 tillægsprotokoller . Én tillægsprotokolmedførte behov for at indhente og behandle en pæ-diatrisk specialistudtalelse om betydningen for mindrebørn af, at der blev udtaget yderligere blodprøver, somformandskabet fandt usædvanligt store . Forsøget varblevet sammenkædet med et andet forsøg, og detmedførte tillige behov for at få overblik over, hvad dervar givet tilladelse til i hvert af de to anmeldte forsøgsamt efterfølgende tillægsprotokoller . Samtidig var detnødvendigt nøje at overveje, om indholdet af tillægs-protokollerne krævede anmeldelse af nye forsøg istedet for tillægsprotokoller, og det krævede en dialogmed anmelder om tillægsprotokollernes specifikkeindhold .
Sekretariatet kommenterer i videst muligt omfangkonkrete udkast til anmeldelser mhp . at accelereregodkendelsesproceduren . Disse henvendelser harvidt forskellig karakter og registreres ikke løbende pga .ydelsernes heterogenitet og hensynet til at fokuserepå sekretariatets kerneydelser . ofte bliver anmeldel-serne først sendt lige op til anmeldelsesfristen, ogdet begrænser sekretariatets muligheder for at letteanmeldernes arbejde med anmeldelserne .
De Videnskabsetiske Komiteerfor Region HovedstadenI Region Hovedstaden er der nedsat 6 videnskabs-etiske komiteer, hver med 11 medlemmer (6 ikke-sundhedsfaglige medlemmer og 5 sundhedsfagligemedlemmer) . De nuværende komiteer holdt konsti-tuerende møder i marts 2010, og de har fortsat deresarbejde med ganske få udskiftninger af medlemmeri 2011 og 2012 . Der blev holdt 60 komitémøder iRegion Hovedstaden i 2012 .Komiteernes formandskaber og sekretariatet har i2012 holdt 2 fællesmøder, bl .a . med henblik på atkoordinere komiteernes virksomhed .Det fremgår af nøgletalsoversigten på side 9, atRegion Hovedstaden modtog 685 nye projekter tilbedømmelse i 2012 . Det er en stigning i forhold til2010, hvor der blev anmeldt 574 nye projekter og2011, hvor der blev anmeldt 640 nye projekter . I2012 var 152 af de nye anmeldte projekter læge-middelforsøg . Det er nogen flere i 2011 og 2010,hvor antallet af anmeldte lægemiddelforsøg var hhv .143 og 125 .Antallet af tillægsprotokoller til allerede godkendteprojekter var 955 . Det er en stigning i forhold til2011og 2010 hvor antallet af tillægsanmeldelser varhhv . 892 og 824 . Dermed fortsætter den opadgåen-de tendens til flere anmeldelser af tillægsprotokoller,som er blevet set siden 2008 .Sekretariatet modtog 353 skriftlige henvendelsermed spørgsmål om anmeldelsespligt . også her sesen stigning i forhold til tidligere år .I løbet af 2012 udtrak sekretariatet ved tilfældigmetode 20 ikke-lægemiddelforsøg til kontrol .
Skriftlige og mundtlige henvendelsersamt undervisningKomitésekretariatet har undervist i komitésystemetsfunktion på forskerkurser i 2012 og besvarer – medløbende kontakt til komiteens formandskab – mangemundtlige og skriftlige forespørgsler om anmeldelses-pligt, forlæg og konkrete formuleringer .
15
R E D EGø R EL S E Fo R Ko M I tEER N ES VI R KSoM H ED
Kontroltemaet var efter komiteernes beslutning sam-tykkeerklæringer . Kontrolbesøgene blev foretagethen over sommer og efterår, og på komitémøder idecember 2012 tilsluttede de 6 komiteer sig kontrol-rapporten .
SagsbehandlingstidenSagsbehandlingstiden for 2012 fremgår af tabel 11 .I gennemsnit har forskerne inden 11 dage modtageten tilbagemelding fra en jurist, der har gennemgåetdet indsendte projektmateriale . I stort set alle projek-ter er der forhold, der skal rettes, for at projektet fuldtud opfylder komitélovens formelle krav til projekterne .Forskerne har herefter i gennemsnit brugt 11 dagepå at rette materialet til efter juristens anvisninger ogindsende en mail med materiale, der fremstår, så deter klar til komitébehandling .Fra det tidspunkt, hvor sekretariatet har modtagetdet rettede materiale, og frem til at projektet er blevetkomitébehandlet, er der gået i gennemsnit 22 dage .Her skal det huskes, at komiteerne får udsendt detmateriale, de skal gennemgå på komitémødet, så dehar to weekender før mødets afholdelse til gennem-gang og forberedelse . Det er prioriteret, at komiteerneskal have tilstrækkelig tid til forberedelse af mødet .Selvom der kun behandles 10 projekter pr . møde,kan det dreje sig om flere tusind sider, der skal gen-nemlæses .Fra komitémødet er afholdt, til der sendes en afgø-relse til forsker, går der i gennemsnit 6 dage . Dissedage bruges til at skrive referat af komitémødet, fåkomiteens accept af referatet, skrive afgørelsen isagen og fremsende den til forsker .Den gennemsnitlige sagsbehandlingstid fra projekt-materialet var behørigt udformet, til forsker fik enafgørelse var i 2012 38,2 dage . Det er en stigning iforhold til første kvartal af 2010 og første kvartal i2011 hvor den gennemsnitlige sagsbehandlingstidvar 27 og 33,7 dage . Stigningen i sagsbehandlings-tiden skyldes dels, at sekretariatet har håndteret enlangt større sagsmængde i 2012, dels at der i 2 . halv-år 2012 har været færre ansatte i komitésekretariatet .97% af samtlige projekter er afgjort inden for denlovfastsatte frist på 60 dage .Årsberetning 2012
Region Hovedstadens komiteer behandlede 16 sageri 2012, som skulle genbehandles på nyt komitémøde .Det er sager, hvor komiteen efter første møde stillersupplerende spørgsmål til forsker . Når forsker har sva-ret, skal komiteen bedømme sagen på nyt møde . Dader er mindst en måned mellem møderne i denenkelte komité, giver genbehandling en meget langsagsbehandlingstid i den konkrete sag . Genbehand-lingssagerne er ikke medtaget i ovennævnte statistik .
Skriftlige og mundtlige henvendelserHver dag er der i åbningstiden et fast team beståendeaf en sekretær og en jurist, der rådgiver forskerne, nårde henvender sig enten skriftligt eller telefonisk . Såle-des anslås det, at sekretariatet årligt besvarer ca .2-3 .000 telefoniske henvendelser .Der rådgives om alt lige fra hjælp til, hvordan mananmelder, hvilke dokumenter der skal indsendessammen med anmeldelsen, informationer om loven,henvisninger til regionens hjemmeside og megetandet . Ud over det faste team er der også hver dagmange direkte henvendelser om hjælp til de øvrigesekretariatsmedarbejdere .Den nye komitélovs krav om elektronisk anmeldelsehar siden 1 . januar 2012 betydet en væsentligt øgete-mail-kommunikation . Ikke blot hvad angår fremsen-delse og svar i forbindelse med en anmeldelse, menden hurtige kommunikationsform betyder ekstra fore-spørgsler . I 2012 besvarede sekretariatet 353 skriftligeforespørgsler om anmeldelsespligt (i 2011 modtogsekretariatet 245 forespørgsler) .
Den Nationale Videnskabsetiske KomitéDen nye nationale komitéDen reviderede komitélov trådte i kraft den 1 . januar2012, og samtidig begyndte den nye NationaleVidenskabsetiske Komité sit arbejde .Efter lovrevisionen skal den nationale komité bestå af13 medlemmer, hvoraf de 5 er udpeget af Ministerietfor Sundhed og Forebyggelse efter indstilling fra regio-nerne, 2 efter indstilling fra bestyrelserne fra DetStrategiske Forskningsråd og Det Frie Forskningsråd, og5 efter samråd med ministeren for Videnskab, tekno-logi og Udvikling efter åbent opslag . Formanden erudpeget af ministeren for Sundhed og Forebyggelse .
16
R EDEGøR EL SE FoR KoM ItE ER N E S VI R K SoM H ED
I dag er DNVK sammensat sådan, at 8 af de 13 med-lemmer har en sundhedsfaglig grunduddannelse,mens 5 har baggrund inden for jura, pædagogik,antropologi og socialvidenskab . Der er således taleom en væsentlig anderledes sammensat komité endden tidligere Centrale Videnskabsetiske Komité, derbestod af 26 medlemmer, hvoraf 22 var regionaltudpegede medlemmer (formænd og næstformændfra de regionale videnskabsetiske komiteer) .Hensigten bag lovændringen var da også at skabe etmere hensigtsmæssigt forum for at løfte komiteensopgaver og for at skabe bedre muligheder for kvalifi-cerede debatter . Det blev også af retssikkerheds-mæssige betragtninger fra lovgivers side anset somuhensigtsmæssigt med for stort personsammenfaldmellem førsteinstans- og andeninstansmyndigheden .
Den gennemsnitlige sagsbehandlingstid for disse16 sager var 52 dage . 63% af sagerne er ekspederetinden for 60 dage .Herudover har DNVKs sekretariat behandlet en rækkeforespørgsler om bl .a . anmeldelsespligt inden for dekomplekse områder .DNVK har i 2012 afholdt i alt 9 møder, hvor hoved-vægten af dagsordenens punkter var behandling afkonkrete forskningsprojekter .Et udlandsudvalg under DNVK har afgivet vejledendeudtalelse vedrørende 6 forskningsprojekter .DNVKs sekretariat arrangerede komitésystemets års-møde, der i 2012 fandt sted på Comwell i Roskilde .(se afsnittet om Årsmøde), hvor bl .a . den videnskabs-etiske hæderspris blev uddelt (se afsnittet om Denvidenskabsetiske hæderspris) .Herudover har DNVKs sekretariat afholdt 2 mødermed Sundhedsstyrelsen i det fælles Koordinerings-udvalg, 2 fælles møder med sekretariaterne for deregionale komiteer i Samordningsforum samt deltageti Genterapiudvalgets møder .DNVK afgiver også vejledende udtalelser vedrørendeklagesager fra den færøske komité . I 2012 afgavDNVK således en vejledende udtalelse i 1 klagesagfra Færøerne, der vedrørte omfattende genomsekven-tering .Repræsentanter for DNVK har endvidere deltaget ien ministeriel nedsat arbejdsgruppe om udredning aflovgivningen for genomundersøgelser og gentest, derfortsat pågår (se afsnittet om Væsentlige sager, be-grundelser og videnskabsetiske drøftelser) . Desudenhar DNVK afholdt et dialogmøde med Lægemiddel-industriforeningen .DNVK afgav i 2012 27 høringssvar (se afsnittet omHøringer) .
Komiteens aktiviteterDen væsentligste nye opgave for DNVK har vist sigat være opgaven med at behandle komplekse sund-hedsvidenskabelige forskningsprojekter i 1 . instans .Kompetencen følger af § 2 i bekendtgørelse nr . 538om information og samtykke mv .Siden DNVK ved ikrafttrædelsen af bekendtgørelsen15 . juni 2012 fik kompetence til at behandle sund-hedsvidenskabelige forskningsprojekter på komplekseområder, har DNVK behandlet 16 første instanssagerpå ordinære komitémøder, samt 8 klagesager .Af de 8 indbragte klagesager ændrede DNVK afgø-relse i 7 tilfælde i forhold til afgørelsen truffet i denregionale komité og 1 afgørelse blev stadfæstet .Af de 16 førsteinstanssager drejede 6 projekter sigom forskning i akutte situationer, 2 projekter drejedesig om forskning vedrørende lægemidler til avanceretterapi, 7 projekter omhandlede forskning vedrørendeomfattende kortlægning af individets arvemasse og1 projekt vedrørte forskning i biologisk materiale ud-taget i forbindelse med retsmedicinsk obduktion .
17
Væsentlige sager, begrundelser ogvidenskabsetiske drøftelserI det følgende beskriver komiteerne i hver region enrække væsentlige videnskabsetiske emner, som opta-ger komiteerne . Komiteerne i Region Midtjylland harvalgt at bringe en artikel, som indeholder overvejelseri forhold til deltagerinformation .Derfor bragte komiteens formand efterfølgende pro-blemstillingen omkring exomscreening op i det kon-taktforum, der består af samtlige komiteers (regionaleog nationale) formandskaber samt repræsentanter fraalle sekretariaterne . Her var der enighed om, at detkunne være et forskningsområde, der fremadrettetskulle 1 . instans-behandles af Den Nationale Viden-skabsetiske Komité .Komiteen har i løbet af året flere gange haft anled-ning til at drøfte videnskabsetiske problemstillingerover de samme temaer . Det har bl .a . drejet sig om:
Den Videnskabsetiske Komitéfor Region NordjyllandVæsentlige sager og videnskabsetiske drøftelseri komiteenDen Videnskabsetiske Komité for Region Nordjyllandbehandlede i løbet af 2012 følgende projekt, der gavanledning til væsentlige etiske drøftelser:Projektet var et placebokontrolleret lægemiddelforsøgog metoden var således beskrevet, at det gav komi-teen anledning til at diskutere anvendelse af placeboi stedet for bedste eksisterende behandling, da det, idet konkrete tilfælde, var komiteens vurdering, at deri forvejen eksisterede et virksomt præparat, der vargodkendt til samme behandling .Desuden gav det anledning til drøftelse, at det i pro-tokollen var oplyst, at der ville blive foretaget exom-screening på de indsamlede biobankprøver, hvis manfik uventede resultater i forsøget .Da komiteen, ud over de refererede drøftelser, ogsåfandt, at der var modsatrettede oplysninger i formåls-beskrivelsen, besluttede komiteen at indkalde forsker-gruppen til et møde . På dette møde fik komiteenbesvaret sine spørgsmål og bl .a . blev forholdet om-kring exomscreening diskuteret . Komiteen betonede,at det er vigtigt, at forsøgsdeltagerne oplyses om ræk-kevidden af denne type screening . På baggrund af deproblemstillinger, der blev diskuteret på mødet beslut-tede forskergruppen imidlertid, at de ønskede atrevidere det anmeldte materiale .Projektet blev efterfølgende først godkendt på betin-gelser og derefter endeligt godkendt .Uanset at det fremgår i et projektmateriale, at scree-ningen kun vil udføres på de områder, der er rele-vante for medicinomsætningen, så forholder det sigstadig således, at forsker har hele forsøgsdeltagerensexom på dataform .Årsberetning 2012
InformationsprocedureDet er komiteens erfaring, at i hovedparten af projek-terne bliver den skriftlige deltagerinformation udleve-ret forud for afgivelse af mundtlig information samt atder efterfølgende gives minimum 24 timers betænk-ningstid, som anbefalet i komitésystemet . Men flereprojekter har dog givet anledning til drøftelse af hen-synet til forsøgsdeltageren ctr . hvad der er praktisknemmest for forsker . Det fremgår ikke direkte afbestemmelserne efter komitéloven, at den skriftligeinformation skal udleveres før den mundtlige infor-mation gives . Det fremgår dog af informationsbe-kendtgørelsens § 8, stk . 1, nr . 3, at det i den skriftligeinformation bl .a . skal oplyses, at man har ret til atmedbringe en bisidder ved modtagelsen af denmundtlige information .Det er komiteens opfattelse, at det generelt er en for-del at mulige deltagere får lejlighed til at sætte sig indi projektet på forhånd, og derfor anbefales det oftest,at den skriftlige information udleveres forud for denmundtlige – forsker bliver i hvert fald bedt om at for-holde sig til, hvorfor det ikke findes muligt at frem-sende den skriftlige information først . Det er dog altiden konkret afvejning af de forskellige forhold ved pro-jektet på samme måde som, det er en afvejning afprojektets art og karakter af intervention, om det kanaccepteres, at der kun gives mulighed for ganske fåtimers betænkningstid .
18
VÆSEN tLI G E SAGER, B EGR U N DELSER oG VI DEN S K AB S EtI SK E DR øF tELS ER
Klinisk ansvarligEnkelte projekter har givet anledning til drøftelse af,hvornår komiteen stiller krav om en klinisk ansvarlig .Problemstillingen har været aktuel i forsøg, hvor denforsøgsansvarlige ikke har haft en medicinsk bag-grund, og der heller ikke har været en læge tilknyttetprojektet .Kravet om en klinisk ansvarlig stilles af hensyn tildeltagernes sikkerhed, og det stilles ud fra en konkretvurdering af det enkelte projekt . Hvor der er muligrisiko for forsøgspersonen, skal en læge involveresmed henblik på at vurdere mulige risici . I de tilfælde,hvor komiteen har fremsat betingelse om en kliniskansvarlig, har projektet omfattet en fysisk interventionpå forsøgsdeltageren, der har krævet, at en personmed lægefaglig baggrund blev involveret ift . tilrette-læggelse af interventionen og andre (behandlings-mæssige) foranstaltninger i tilknytning hertil . Detafgørende er typen af intervention og ikke typen afdeltager – altså om det er en rask forsøgsdeltagereller en forsøgspatient .
De Videnskabsetiske Komiteerfor Region MidtjyllandKrænkes principperne for afgivelse af det informe·rede samtykke af kravene til deltagerinformation?
StatusartikelAf afdelingslæge, ph .d . Elisabeth Stenbøg (Komité-medlem, komité II) og overlæge, dr .med . JørgenAagaard (Formand for komité II)IndledningDet informerede samtykke er hovedhjørnestenen ividenskabsetikken, det videnskabsetiske komité-system og den bagvedliggende lovgivning .Men står kravene til deltagerinformation i virkelig-heden mest i vejen for forsøgspersonens afgivelseaf det informerede samtykke, og bliver helt centralespørgsmål som ”Hvad er det, jeg siger Ja til?”, og”Hvilke konsekvenser har deltagelsen for mig?” over-hovedet besvaret .Ved præsentation af en godt 800 sider lang protokolpå et nyligt afholdt komitémøde udtalte et i øvrigtkomitéerfarent medlem:”Det var da en tonstung protokol jeg skulle kæmpemig igennem, men hvad værre er, at deltagerinfor·mationen er på 35 sider. Den er skrevet i et for migsvært forståeligt sprog, og så er der et væld af detal·jer især om bivirkninger. Den deltagerinformationkan da umuligt danne grundlag for et informeretsamtykke”.Vi fik sagsbehandlet det fremsendte projekt, og isamarbejde med den forsøgsansvarlige forsker blevdeltagerinformationen rettet til, og projektet kunne,som stort set alle øvrige projekter, godkendes ogendnu et relevant forskningsprojekt påbegyndes .Men dette ekstreme eksempel gav også anledningtil refleksion over vilkårene for afgivelse af det infor-merede samtykke, herunder at principperne herforer helt centrale i al klinisk forskning . Ud af de ca .300 sager, der årligt behandles i De VidenskabsetiskeKomiteer i Region Midtjylland, møder vi tilsvarendeproblematik ca . 10 gange årligt .
DeltagerinformationDeltagerinformationerne er et dokument, der fårmeget opmærksomhed af komiteen, der går megetop i, at informationerne skal være læsevenlige og ikkemindst forståelige for lægmænd . Flere gange har komi-teen fundet, at der er brugt meget værdiladede ordog vendinger og forsker bliver da bedt om, at ændresit sprogbrug, så informationen er kommet til at frem-stå neutral . Der har også været eksempler på, at derer oplysninger i multinationale projekter, der bærerpræg af amerikanske forhold, og som er unødigeifølge de danske forhold og i værste fald højst kanmedvirke til at bekymre læseren unødigt . Flere gangehar en information været af så ringe karakter medtydelige tegn på sjusk eller dårlig oversættelse fraandet sprog og sammenblanding af flere sprog, atder er blevet stillet krav til forsker om at gennemgåinformationen nøje og kritisk . Særligt for lægemiddel-forsøgene gør det sig ofte gældende, at der er vedlagtmeget lange informationer . Her vil komiteen oftebede om, at der laves et kort resumé med de essen-tielle oplysninger eller eventuelt at informationenvedlægges den ”forside”, der er udarbejdet af komité-systemet og som kan give læseren et overblik overforsøget .
19
VÆ SE NtL IGE S AGE R , B EGR U N DELSER o G VI DEN SK AB SEt I SKE DRøF tE LSE R
En dyster fortidMed Nürenberg processen i 1947 blev det i regi afden fremtidige World Medical Association (WMA) de-fineret, at god forskning med mennesker forudsættergod etisk standard, herunder principper om frivilligdeltagelse på baggrund af et informeret samtykke(1) .Der gik dog en rum tid frem til 1964, før Helsinki Ideklarationen og endnu et par år før Helsinki II dekla-rationen i 1975 førte til etableringen af det uafhæn-gige videnskabsetiske komitésystem (2,3) . I Danmarkvar det først med komitéloven i 1992, at systemetblev juridisk bindende (4) .I den nyligt reviderede komitélov er der ingen princi-pielle ændringer til kravene om deltagerinformationeller afgivelse af informeret samtykke (5) .I lov nr . 593 af 14 . juni 2011 er det uændret gælden-de, at ”Forsøgspersonen skal informeres skriftligt ogmundtligt om et sundhedsvidenskabeligt forsknings-projekts indhold, forudsigelige risici og fordele forin-den afgivelse af samtykke .” Endvidere at ”Informationtil forsøgspersonen skal indeholde en forståelig frem-stilling af forskningsprojektet uden brug af tekniskeeller værdiladede vendinger . Informationen skal givespå en hensynsfuld måde og være tilpasset modtage-rens individuelle forudsætninger med hensyn til alder,modenhed, erfaring m .v . Informationen skal indehol-de oplysning om eventuelle forudsigelige risici, bivirk-ninger, komplikationer og ulemper, samt at der kanvære uforudsigelige risici og belastninger knyttet tildeltagelse i et sundhedsvidenskabeligt forskningspro-jekt” . og slutteligt, at ”Et informeret samtykke skalvære skriftligt, dateret og underskrevet eller afgivetved brug af elektronisk signatur .”
Kliniske lægemiddelforsøg, i særdeleshed de firma-initierede, landegrænse overskridende, multicenter-forsøg, har de sprogligt tungeste og længste deltager-informationer .De multicenterforsøg, hvor sponsor er et USA baseretfirma, har de allerlængste og sprogligt tungeste del-tagerinformationer .Når et sådant forsøg anmeldes til De Videnskabseti-ske Komiteer for Region Midtjylland, er det begrundeti, at den forsøgsansvarlige for den danske del af pro-jektet har sin arbejdsplads i Region Midtjylland .Myndighedskrav fra hovedsponsors komitésystemrespektive US Food & Drug Administration (FDA) skalfølges af primært juridiske grunde, herunder evt . er-statningskrav ved uforudsete eller svære bivirkninger(6) .Da kravene i den EU harmoniserede bekendtgørelseom god klinisk praksis i forbindelse med kliniske for-søg med lægemidler på mennesker ikke er samstem-mende med FDA kravene, kan informationsmæng-den hurtigt blive enorm (7) .Ved drøftelse med Lægemiddelindustriforeningen(LIF) er det oplyst, at de ikke her har udarbejdetgenerelle retningslinjer for deltagerinformation ogikke har et pågående arbejde om harmonisering afmyndighedskrav .Som noget nyt i den reviderede komitélov er dissemyndighedskrav nu en del af lovteksten ”Informatio-nen til forsøgspersonen skal indeholde en beskrivelseaf det informerede samtykkes omfang . . ., herunderkvalitetskontrol og monitorering, som sponsor ellereventuel monitor er forpligtede til at udføre .”(5) .Sammenfattende gør de omfattende myndighedskravdet udfordrende for den forsøgsansvarlige at skrive engod deltagerinformation, som samtidig lever op tilprincipperne i komitéloven .
Myndighedskrav spænder ben for engod deltagerinformationDeltagerinformationen i de forskningsprojekter, vifår fremsendt, spænder fra størstedelen, der er helteksemplariske og fuldstændigt lever op til det viden-skabsetiske komitésystems vejledninger og anbefa-linger, til nogle, der er meget lange, informationsrigeog sprogligt svært tilgængelige .
Årsberetning 2012
20
VÆSEN tLI G E SAGER, B EGR U N DELSER oG VI DEN S K AB S EtI SK E DR øF tELS ER
Etiske interessekonflikter ved indhentelseaf det informerede samtykkeAt personer med svær sygdom lettere accepterer fxrisiko for bivirkninger i håb om effekt af ny behandlingog således lettere accepterer at blive forsøgsperson .At forsker kan have sit håb om, at forsøget kan givenogle positive resultater, der ikke kun kan være godtfor patienter og samfundet, men også for hendes kar-riere, og således kan påvirke drivkraften for at moti-vere potentielle forsøgspersoner til at deltage .At forskere som faggruppe professionelt kan havesvært ved fuldt ud at respektere forsøgspersonensselvbestemmelsesret .At forsker er så specialiseret i sin viden, så han/hunikke kan se problemet med en deltagerinformation,der kan være svær at forstå for forsøgsdeltageren .
3 . Herudover har vi i De Videnskabsetiske Komiteerfor Region Midtjylland sammen med Handelshøj-skolen, Århus Universitet, deltaget i projekt:”VidNet” om god deltagerinformation . Det harresulteret i en ny vejledning til udarbejdelse af del-tagerinformation, herunder at finde en godbalance mellem tilstrækkelig og nødvendig infor-mation (9) . Der er udarbejdet ganske specifikkeanbefalinger til, hvordan deltagerinformationen kanstruktureres, og hvilke punkter, der nødvendigvisskal være med . Endvidere er der ud fra eksemplerudarbejdet mange gode råd vedrørende densproglige udformning således, at de informationer,der skriftligt videregives, med stor sandsynlighedkan blive forstået af forsøgspersonen .
Hvad har vi gjort ved de lange og kompleksedeltagerinformationer?1 . I relation til gældende bekendtgørelse er der i regiaf Den Nationale Videnskabsetiske Komité udarbej-det en vejledning i ”At skrive en god deltagerinfor-mation”, og den vejledning henviser vi til (8) .2 . Konkret ved sagsbehandling af lægemiddelforsøghar vi indgået nogle kompromiser, som består af todele:• Forslag til sproglig og opstillingsmæssig forenk-ling af lange deltagerinformationer uden tab afinformation .• Forslag til udarbejdelse af kort og klart resuméaf deltagerinformationen, der kan placeres somden første side i deltagerinformationen . En dis-position for dette resumé kan være:• Hvad går projektet ud på?• Hvad indebærer det for mig som forsøgs-person?• Hvilke rettigheder har jeg som forsøgsperson?
Hvad kan forbedres?Vi skal fastholde, at deltagerinformationen er et brug-bart dokument, der skal fremme den proces, at for-søgspersonen får et fuldt tilstrækkeligt grundlag - sominformeret - til at sige ja eller nej til at deltage i detsundhedsvidenskabelige forskningsprojekt .Ligeledes at det informerede samtykke er en hoved-hjørnesten i videnskabsetikken, komitésystemet ogden bagved liggende lovgivning .Af mulige forbedringer kunne peges på at samordnegenerelle principper for deltagerinformation ved lan-degrænseoverskridende multicenter lægemiddelfor-søg med respekt for, at det enkelte land ud over degenerelle principper godt kan have specifikke myndig-hedskrav .Endvidere en empirisk afklaring af, hvor lidt eller hvormeget reel information personen i virkeligheden fårfat i inden stillingstagen til at deltage som forsøgsper-son .Endelig iværksættelse af klinisk forskning om viden ogudbytte af forskellige deltagerinformationer? Et sådantprojekt kunne udføres som delprojekt ved store klini-ske lægemiddelforsøg .
21
VÆ SE NtL IGE S AGE R , B EGR U N DELSER o G VI DEN SK AB SEt I SKE DRøF tE LSE R
AfslutningDer er gennem årene lagt mange kræfter i at udar-bejde specifikke regelsæt og vejledninger for at opti-mere deltagerinformationen og indhentelse af detinformerede samtykke .Der er i den danske befolkning en imponerende storinteresse for og tilslutning til deltagelse i sundhedsvi-denskabelige forskningsprojekter . Dette fordrer natur-ligt ydmyg respekt for hvert eneste menneske, sygsom rask, der ønskes inkluderet i sundhedsvidenska-belige forskningsprojekter .trods de mange bestræbelser er det indtrykket, atmange forsøgspersoner, nok især svært syge patien-ter, egentlig har beskeden indsigt i, hvad det er for etforsøg eller forsøgstype, de deltager i, fx om projekteter randomiseret, eller om der indgår en placebogrup-pe . og hvis dette er tilfældet, så er det jo egentlig enkrænkelse af principperne for afgivelse af et infor-meret samtykke .Her og nu og fremover er holdningen ved De Viden-skabsetiske Komiteer for Region Midtjylland, at vi ger-ne vil hjælpe og servicere forskerne bag de anmeldteprojekter, så vilkårene for opnåelse af informeretsamtykke bliver bedst mulige .
Referencer1 . Nürenberg Code . trails of War Criminals before theNürenberg Military tribunals under Control CouncilLow No . 10,Vol . pp . 181-182 . Washington, DC: USGovernment Printing office, 1949 . http:/ohsr .od .nih .gov/guidelines/nuremberg .html2 . Human Experimentation . Code of Ethics of theWorld Medical Association . Declaration of Helsinki .Br Med J 1964; 2:177 .3 . Declaration of Helsinki . 29th World Medical Asso-ciation General Assembly . tokyo, Japan 1975 .4 . Bekendtgørelse om information og samtykke vedinddragelse af forsøgspersoner i biomedicinskeforskningsprojekter, lov nr . 503 af 24 . juni 1992 .Indenrigsministeriets5 . Bekendtgørelse om information og samtykke tildeltagelse i sundhedsvidenskabelige forskningspro-jekter samt om anmeldelse af og tilsyn med sund-hedsvidenskabelige forskningsprojekter, lov nr . 538af 11 . juni 2012 . Ministeriet for Sundhed og Fore-byggelse . www .retsinformation .dk6 . A guide to Informed Consent – Information sheet .Guidance for Institutional Review Boards and Clini-cal Investigators . US Food & Drug Administration .US Department of Health & Human Services .www .fda .gov7 . Bekendtgørelse om god klinisk praksis i forbindelsemed kliniske forsøg med lægemidler på menne-sker, lov nr . 744 af 29 . juni 2006 . Indenrigs- ogSundhedsministeriet . www .retsinformation .dk8 . ”At skrive en god deltagerinformation” . DenNationale Videnskabsetiske Komité . www .dnvk .dk9 . Vejledning til deltagerinformation . De Videnskabs-etiske Komiteer for Region Midtjylland .www .komite .rm .dk
Årsberetning 2012
22
VÆSEN tLI G E SAGER, B EGR U N DELSER oG VI DEN S K AB S EtI SK E DR øF tELS ER
Den Videnskabsetiske Komitéfor Region SyddanmarkPrincipielle spørgsmålKomiteen bemærkede sig, at særligt 5 temaerdannede baggrund for principielle diskussioner ikomiteen:Dispensation fra samtykkekravetSpørgsmålet om dispensation, jf . § 10 fra komité-lovens udgangspunkt om indhentelse af skriftligt, in-formeret samtykke fra en forsøgsdeltager, før dennesinklusion i et sundhedsvidenskabeligt forskningspro-jekt, har i højere grad end tidligere bevirket diskussio-ner om, hvorvidt kriterierne for meddelelse af dispen-sation er opfyldt, dels om dispensation herefterskønnes videnskabsetisk forsvarligt .Genetiske undersøgelserDen genetiske forskning synes i opblomstring iRegion Syddanmark – både i forhold til tillægsproto-koller til allerede godkendte projekter og i forhold tilanmeldelse af nye forskningsprojekter . Komiteen eropmærksom på Den Nationale VidenskabsetiskeKomités rolle som førsteinstansbehandler på projek-ter med omfattende kortlægning af den menneske-lige arvemasse, og komiteen finder, at særligt detteforskningsområde er i vækst .Oprettelse af biobanker uden direkte relationtil det aktuelle projektSærligt i projekter omhandlende lægemiddelafprøv-ning initieret af udenlandske sponsorer ses studie-designs med oprettelse af biobanker uden direkterelation til forsøget . Disse biobanker ligger uden forkomitésystemets kompetence at godkende – aleneDatatilsynet skal godkende en sådan biobank, oganmeldelse til komitésystemet skal først ske, når derønskes iværksat et konkret forskningsprojekt . Alligevelanmeldes biobankerne på lige fod med biobanker,som relaterer sig til det konkrete projekt, og komiteenog sekretariatet har i flere tilfælde anmodet om mereuddybende redegørelser for de ønskede biobankerfor at afklare, hvorvidt de ligger inden for komité-lovens område eller ej .
Adgang til data for forsøgsdeltagereKomiteen har bemærket sig en tendens til størreopmærksomhed end tidligere for adgang til forsøgs-deltagerens data (patientjournaler m .m .) – også isituationer, hvor forsøgsdeltageren enten aktivt træk-ker sig ud af studiet eller, hvor forsøgsdeltageren ikkelængere ønsker at møde op til fx forsøgsbehandlingen .Definitionen af, hvornår en person er ”aktiv eller pas-siv” forsøgsdeltager synes ikke at være skarpt trukket .Komiteen har desuden i projekter omhandlendelægemiddelafprøvning initieret af udenlandske spon-sorer bemærket sig, at sponsor ønsker at følge gravi-ditetsforløb for partnere til forsøgsdeltagere .Dette er et nyt tema, og komiteen har indtil viderevalgt at opfatte ønske om registrering af partnergravi-ditet som inkludering af en ny gruppe forsøgsdelta-gere .
Nye operationsmetoderDet er komiteens opfattelse, at ændringer i operations-metoder i stor udstrækning er blevet opfattet somsmåforbedringer, der ikke er anmeldepligtige . Indenfor de sidste 5-10 år er der imidlertid introduceret enrække metoder, der væsentligt adskiller sig fra tidli-gere anvendte operationer . Det gælder især laparo-skopiske operationer, robot operationer og canceroperationer . En del af disse operationer synes at væreindført som pilotprojekter og vurderet af de pågæl-dende afdelinger som ikke-anmeldepligtigt til detvidenskabsetiske komitésystem .Komiteen er i et par projekter og forespørgsler om an-meldepligt blevet forelagt spørgsmålet om anmelde-pligt for nye operationsmetoder . Ved vurdering afdisse projekter har komiteen særligt lagt vægt på, omden nye operationsmetode blev gennemført i et viden-skabeligt design, eksempelvis med randomisering .Det kunne være ønskeligt, at der blev fokuseret merepå ændringer/forbedringer af operative metoder irelation til eventuel anmeldepligt til komitésystemet .En revision af Sundhedsstyrelsens Vejledning af 2 . juli1999 om indførelse af nye behandlinger i sundheds-væsenet bør overvejes .
23
VÆ SE NtL IGE S AGE R , B EGR U N DELSER o G VI DEN SK AB SEt I SKE DRøF tE LSE R
Den Videnskabsetiske Komitéfor Region SjællandVæsentlige sager og videnskabsetiskedrøftelser i komiteenReferat af væsentlige sager, væsentlige videnskabs·etiske problemer drøftet, og fokusområder der hargivet anledning til videnskabsetiske drøftelser.Komiteens drøftelser har i 2012 – ligesom i de fore-gående år – afspejlet, at det er et meget bredt felt afforsøg, der skal godkendes af de videnskabsetiskekomiteer, før de må iværksættes, og det betyder, atkomiteernes opgaver er meget varierede . Som hoved-regel er de problemstillinger, som komiteen beskæf-tiger sig med, når den behandler en anmeldelse, ikkesort-hvide, men omfatter en række nuancer inden forflere forskellige dimensioner . Komiteen kan såledesikke blot gå en liste igennem for hver anmeldelse og”krydse af” om de enkelte kriterier er opfyldt – derskal foretages et konkret skøn . Disse skøn kan bl .a .eksemplificeres således:
der er stadig behov for at skønne over, hvor mangepenge et bestemt ubehag svarer til .Hvis en forsker/virksomhed gerne vil afslutte et forsøginden for en bestemt tidsfrist kan vedkommendevære fristet til at betale forsøgspersoner for meget forat deltage, så forsøget kan gennemføres hurtigt . Der-for må komiteen vurdere kritisk, om kompensationentil forsøgspersoner er for stor .
Hvor store risici må forsøgspersonerudsættes for?De risici, der kan være forbundet med at gennemføreforsøget, må ikke have et uforsvarligt omfang - hver-ken i sig selv eller i forhold til projektets forudseligefordele - men hvornår har risici et uforsvarligt omfang?Her skal komiteen både se på, hvor alvorlige forskel-lige udfald af forsøget er, og på sandsynligheden forhvert af de forskellige udfald . Det vil bl .a . sige, atkomiteen skal sammenligne små risici for død medsandsynligheder for helbredelse eller som minimumny viden .I den forbindelse inddrager komiteen også forsøgs-personernes helbredssituation: Hvis en forsøgspersoner en patient, der er ved at dø af lungekræft, kan manacceptere større risici ved et nyt muligt lægemiddel,end hvis der er tale om en rask borger – hvis forsøgs-personen får en præcis information om risici ved for-søget og kan forstå disse oplysninger fuldt ud .
Hvor neutral er en ”neutral”deltagerinformation?Deltagerinformationen til forsøgspersonerne skal inde-holde en forståelig fremstilling af forskningsprojektetuden brug af tekniske eller værdiladede vendinger, såi princippet skal deltagerinformationen være strengtneutral . Nogle forskere prøver dog at presse poten-tielle forsøgspersoner ved at skrive fx, at ”Det er vig-tigt for forsøget, at du deltager!”, eller prøver at moti-vere forsøgspersonerne til at deltage ved at kaldedeltagelse i forsøget for ”en gratis helbredsunder-søgelse” . Komiteen forlanger sådanne formuleringerændret, men der er også på dette område en grå-zone mellem neutral oplysning og reklame .Deltagerinformationer – balancen melleminformationens omfang og forståelighedPotentielle forsøgspersoner skal informeres om enlang række aspekter af forsøget, herunder dets formålog metode; tilrettelæggelsen; betydning, art og ræk-kevidde; anvendelse af godkendte og ikke godkendtelægemidler; navnene på disse samt dosering og an-vendelse af randomisering; blindpræparater; behand-lingsfri perioder herunder eventuelle kendte interak-tioner med andre lægemidler; den mulige nytte vedforsøget; eventuelle forudsigelige risici; bivirkninger,herunder kendte langtidsbivirkninger; komplikationerog ulemper ved deltagelse i forsøget, samt at der kanvære uforudsigelige risici og belastninger knyttet tildeltagelse i sundhedsvidenskabelige forsøg . Samtidiger det et krav, at denne omfattende mængde infor-mation gives på en forståelig måde .
Hvor store vederlag må forsøgspersoner få?Vederlag for at deltage i et forsøg må ikke kunnelokke potentielle forsøgspersoner til at deltage . Deforsøgsansvarlige må godt kompensere raske forsøgs-personer for transportomkostninger og ubehag, menÅrsberetning 2012
24
VÆSEN tLI G E SAGER, B EGR U N DELSER oG VI DEN S K AB S EtI SK E DR øF tELS ER
Det giver både forskerne og komiteerne en udfor-dring, når de skal finde en balance mellem to hensyn:• At give forsøgspersonerne så meget information,at lovkravene er opfyldt – men samtidig netop såmeget information at forsøgspersonerne stadig kanoverskue informationen .• At sørge for at informationerne i deltagerinforma-tionen er udvalgt og doseret så præcist, at forsøgs-personerne forstår, hvad forsøget går ud på ogindebærer for dem, så forsøgspersonerne entenafgiver et reelt informeret samtykke eller på et infor-meret grundlag vælger ikke at deltage i forsøget .Formålet med deltagerinformationerne er, at informe-re de potentielle forsøgspersoner præcist, men man-ge deltagerinformationer – især i lægemiddelforsøg– er tilsyneladende snarere udformet med henblik påat undgå, at virksomhederne bag forsøget pålæggeserstatningsansvar . Det betyder, at de svageste forsøgs-personer, der måske både har dårligt syn, mangesamtidige kroniske lidelser og høj alder, får forelagttætskrevne deltagerinformationer på ca . 15-18 sidermed meget høje lix-tal . Komiteen kunne kræve dissedeltagerinformationer skrevet helt om, men det villeblot medføre, at forsøgene ikke gennemføres iDanmark . For at tage højde for dette problem stillerRVK Sjælland ofte krav om, at deltagerinformationentilføjes et resumé på 1-1½ side med fokus på forsø-gets formål, hvad deltagelse indebærer for forsøgs-personerne og risici ved at deltage .
Der var givet dispensation fra samtykket, så forsøgs-personerne vidste ikke, at de havde indgået i forsøget .Forskerne ønskede nu at bryde anonymiteten på de1450 prøver, hvor der var fundet negativ cytologi-diagnose, men positiv HPV test .Forskerne ønskede at invitere de 1450 kvinder til enekstra screeningsprøve . Prøven skulle tages af kvin-dernes praktiserende læge eller gynækolog og derfrasendes til forsøgssitet til undersøgelse . opfølgning påundersøgelsens resultat for den enkelte kvinde skulleske hos den læge, der havde taget prøven . Hverkende inkluderede kvinder eller praktiserende læge ellergynækolog ville få oplysning om, at grunden til, atkvinderne blev spurgt om forsøgsdeltagelse var, at devar blevet konstateret smittede med HPV-virus .I deltagerinformationen ville man bl .a . give kvindernedenne oplysning:”Vi vil spørge, om du vil deltage i etvidenskabeligt forsøg. Du fik taget en celleprøve foret år siden i forbindelse med screening for livmoder·halskræft, og denne prøve var normal. Du ville førstblive indbudt igen, når der var gået 3 eller 5 årafhængig af din alder. Nu bliver du indbudt alleredeefter et år, som en del af et videnskabeligt forsøg.”Komiteen fandt det yderst betænkeligt, at kvinderneønskedes inkluderet i et nyt forsøg, fordi de havdefået konstateret HPV-virus, uden at de selv var klarover årsagen til, at de blev spurgt om deltagelse i detnye forsøg .Komiteen fandt endvidere, at kvinderne - før de blevspurgt om forsøgsdeltagelse - burde have mulighedfor til- eller fravalg af oplysninger om helbredsforholdfra tidligere studier .Komiteen var af den opfattelse, at konstatering afHPV-virus var en væsentlig viden for kvinderne, dadet var af vigtighed, at de fulgte screeningsprogram-met i Danmark .Komiteen fandt det yderst betænkeligt, at projektetikke tilbød kvinderne en samtale om betydningen afkonstateringen af HPV-virus, herunder vigtigheden afat følge screeningsprogrammet . Komiteen kritiserede,at projektet overlod til privatpraktiserende læge atforetage celleskrab og at informationssamtalen iprojektet primært blev tilbudt pr . telefon .25
De Videnskabsetiske Komiteerfor Region HovedstadenEtiske aspekter ved ikke at oplyseforsøgspersoner om, hvorfor de blev spurgtom at deltage i et forsøgProjektet omhandlede undersøgelser med henblik påat finde en testmetode, der kunne identificere netopde kvinder, smittet med HPV·virus, der er i risiko forat udvikle livmoderhalskræft, uden at sygeliggøreden overvejende majoritet, som trods HPV·infektionikke er i risiko for at udvikle sygdom.I sommeren 2011 var der gennemført et baselinestu-die, hvor der på anonymiseret restmateriale fra denordinære cytologiscreening for livmoderhalskræft blevundersøgt 6258 tilfældigt udvalgte prøver for HPV .
VÆ SE NtL IGE S AGE R , B EGR U N DELSER o G VI DEN SK AB SEt I SKE DRøF tE LSE R
Komiteen mente, at ovenstående medførte så alvor-lige etiske problemstillinger ved projektet, at der blevgivet afslag på projektet .
Etiske aspekter ved at inddrage raske børni projektProjektet omhandlende rehabilitering af alvorligtsyge børn, og hvordan det at inddrage raske børnfra det syge barns skoleklasse som ambassadører iklassen for det syge barn kan bedre barnets mulig·heder både fagligt og socialt og gøre det nemmereat komme tilbage til skolen efter endt indlæggelse.Det fremgik af materialet, at de raske børn blev re-krutteret i skolen . to af det syge barns klassekamme-rater ville blive udnævnt til ambassadører, og underindlæggelse skulle det syge barn hver anden ugehave besøg af en ambassadør . Barnet og ambassa-døren skulle fælles deltage i undervisningen m .m . påhospitalet .Komiteen drøftede de etiske aspekter ved at inddrageraske børn på denne måde og anmodede forsker-gruppen om en etisk redegørelse, bl .a . indeholdendeen vurdering af frivillighed og forventningspres i for-hold til ambassadørbørnene . Herunder, hvordan debeskyttes og hvordan der følges op på dem . Hvadsker der, hvis det syge barn siger fra/ikke ønsker rela-tionen til et ambassadørbarn? Den generelle påvirk-ning af ambassadørbørnene ønskedes belyst, og i for-bindelse med, at det blev oplyst, at der i rapportenundersøges for angst og depressionssymptomer,ønskede komiteen også en vurdering af eventuelleforsinkede reaktioner .Komiteen valgte endvidere at indhente en udtalelsefra en ekstern pædiater .Komiteen genbehandlede sagen på førstkommendemøde, hvor forskergruppen udover at sende denønskede redegørelse mødtes med komiteen ogbesvarede spørgsmål .
Efter mødet med forskeren drøftede komiteen projek-tet igen og godkendte dette, idet komiteen efter athave modtaget uddybende vurdering, beskrivelser ogovervejelser fandt, at hensynet til ambassadørbørnenevar betryggende varetaget og at muligheden for atskabe ny viden om rehabilitering af syge børn opve-jede den ulempe nogle ambassadørbørn kunneopleve .
TelemedicinRegion Hovedstaden har modtaget anmeldelse afen række telemedicinske projekter, og det har i alletilfælde været en vanskelig vurdering, om projektetskulle bedømmes som anmeldelsespligtigt til devidenskabsetiske komiteer eller ikke . Projekterne harhaft det til fælles, at formålet med projekterne er atvurdere, om brugen af telemedicin bidrager til, atpatientbehandlingen gennemføres hurtigere, merefleksibelt og evt . bedre over afstand med minimumsamme kvalitet som ved den konventionelle ambu-lante behandling .I nogle tilfælde har komiteerne vurderet, at projek-terne var kvalitetssikringsprojekter og dermed ikkeanmeldelsespligtige til de videnskabsetiske komiteer .I andre tilfælde har vurderingen været, at det atdeltage i et telemedicinsk forsøg har haft en sådanindflydelse på patientbehandlingen, at man måttebetragte projekterne som anmeldelsespligtige .Spørgsmålet om hvorvidt – og i givet fald i hvilketilfælde – telemedicinske forsøg skal betragtes somanmeldelsespligtige sundhedsvidenskabelige forsk-ningsprojekter, vil det på opfordring af Region Hoved-stadens komiteer blive drøftet i Kontaktforum i 2013 .
Årsberetning 2012
26
VÆSEN tLI G E SAGER, B EGR U N DELSER oG VI DEN S K AB S EtI SK E DR øF tELS ER
Den Nationale Videnskabsetiske KomitéKortlægning af det menneskelige genomEt videnskabsetisk område, der især har optagetDNVK i sit første leveår, er forskning inden for gene-tikken . Baggrunden er, at DNVK ved ikrafttrædelsen afbekendtgørelse af 11 . juni 2012 om information ogsamtykke mv . fra den 15 . juni 2012 fik kompetencetil at behandle sundhedsvidenskabelige forsknings-projekter med omfattende genomundersøgelser(komplekse sager) .De nye tekniske muligheder for at kortlægge detmenneskelige genom giver mulighed for at udføreomfattende analyse af genomet, hvilket giver anled-ning til en række etiske problemstillinger, når dissemetoder anvendes i forskningen .Allerede før bekendtgørelsen om 1 . instanssagertrådte i kraft, fik DNVK lejlighed til at drøfte de etiskeog juridiske problemstillinger i forbindelse med forsk-ning, der involverer omfattende gensekventering ogefterfølgende brug af oplysninger herfra . DNVK havdemodtaget en klagesag fra Færøerne, hvor DNVKskulle afgive en vejledende udtalelse . En gennem-gang af sagen viste sig at rejse en række principielleog etiske problemstillinger, som ville kunne få betyd-ning for DNVKs fremtidige behandling af 1 . instanssager om omfattende kortlægning af individets arve-masse .DNVK nedsatte derfor i foråret 2012 en arbejdsgrup-pe, der skulle se nærmere på sagen og på de princi-pielle problemstillinger . Arbejdet i arbejdsgruppenførte til, at DNVK i sommeren 2012 rettede formelhenvendelse til Ministeriet for Sundhed og Forebyg-gelse, idet DNVK kunne se nogle juridiske og etiskeproblemer med gensekventering, der ikke er tagethøjde for i den nugældende lovgivning .
Dette gjaldt især i forhold til:• Samspillet mellem forskning og klinik .• opbygning af dataregistre med genetiske data fraomfattende sekventering samt efterfølgende (forsk-ningsmæssig) brug heraf, som i dag ikke kan ansessom omfattet af komitésystemets kompetence, så-fremt der alene er tale om at anvende oplysningeri form at tegnbaserede symboler, tal og bogstaver .• Udlevering og videregivelse af genetiske data, her-under udlevering til borgeren .• Krav til indhold og omfang af genetisk rådgivning,før der foretages omfattende kortlægning af geno-met, hvad enten det sker i forbindelse med forsk-ning eller som led i klinisk genetisk virksomhed .• Situationer, hvor fund betyder, at der må meldestilbage til forsøgspersonen, uanset at denne hartilkendegivet, at pågældende ikke ønsker dette– retten til ikke viden kontra pligt til at hjælpe vedalvorlig sygdom .• Grænser ved tilbagemelding, fx ved afdækning afslægtsforhold .Ministeriet for Sundhed og Forebyggelse har efterføl-gende i december 2012 – bl .a . også efter opfordringfra Det Etiske Råd – nedsat en ministeriel arbejds-gruppe, der skal udrede lovgivningen for genomun-dersøgelser og gentest . Formålet med udredningener at skabe et overblik over retstillingen på området,samt analysere problemstillinger og foreslå løsnings-muligheder .Udredningen skal munde ud i konkrete initiativer påområdet, og repræsentanter for DNVK deltager i dettearbejde sammen med repræsentanter for Det EtiskeRåd, Ministeriet for Sundhed og Forebyggelse ogDatatilsynet . Arbejdet skal afsluttes medio 2013 medhenblik på, at efterfølgende initiativer kan behandlesinden udgangen af folketingsåret 2013/14 .
27
VÆ SE NtL IGE S AGE R , B EGR U N DELSER o G VI DEN SK AB SEt I SKE DRøF tE LSE R
Retningslinjer for komitésystemets behandlingaf sager om kortlægning af det menneskeligegenomDen Nationale Videnskabsetiske Komité har udarbej-det ”Retningslinjer for komitésystemets behandling afsundhedsvidenskabelige forskningsprojekter medomfattende kortlægning af den menneskelige arve-masse, 2 . version, af 1 . november 2012 .Retningslinjerne angiver bl .a . hvilke særlige forhold iprotokol og deltagerinformation, som forskerne skalbeskrive i genomundersøgelser .I retningslinjerne angiver DNKV desuden om vurde-ringen af projekterne:
Spørgsmål om tilbagemelding til eventuelle slægt-ninge i tilfælde af, at forsøgspersonen ikke ønskeroplysninger om egen helbredstilstand eller er død,må afgøres ud fra et lægefagligt skøn med udgangs-punkt i ovennævnte kriterier, samt sundhedslovens§ 43, stk . 2, nr . 2, og bemærkninger hertil, og kravet iautorisationsreglerne om lægers ”omhu og samvittig-hedsfuldhed” .
Tilbagemelding til forsøgspersonertilbagemelding til forsøgspersoner kan blive aktuelbåde efter fund af mutationer i kendte sygdomsgener,der specifikt undersøges, og hvis der forekommertilfældighedsfund, der opfylder en række kriterier, senedenfor .Hvis det forventes, at der under forsøget kan frem-komme væsentlige helbredsmæssige fund, skal detforud for forsøgsdeltagelsen afklares, om forsøgsper-sonen ønsker tilbagemelding om disse eller ej .
MindreårigeInkludering af mindreårige som forsøgspersoner rejsersærlige videnskabsetiske problemstillinger . Ud overkomitélovens almindelige regler vedrørende anven-delse af mindreårige forsøgspersoner vil DNVK læggevægt på, at forsøg, hvor der kan ske tilbagemelding tilforsøgspersonerne, (se Kriterier for tilbagemelding)kun må udføres på mindreårige, såfremt en tilbage-melding har væsentlig betydning for muligheden forat forebygge eller behandle sygdommen i barne- ogungdomsårene .Genetisk rådgivningVed mulighed for fund af mutationer i sygdomsgener/risikogener ved prædefinerede analyser skal der væremulighed for kvalificeret rådgivning inden samtykkeaf-givelse, samt efterfølgende, hvis der ved undersøgel-serne bliver fundet genetisk variation med væsentligbetydning for deltagerne, herunder tilfældighedsfund .DNVK lægger vægt på, at der etableres hensigtsmæs-sige procedurer for håndtering af helbredsmæssigefund, herunder tilfældighedsfund . Det anbefales, atder oprettes en komité af uafhængige sagkyndige,der ved forekomst af tilfældighedsfund skal vurdere,om der skal ske tilbagemelding, herunder processenherfor .
Kriterier for tilbagemeldingMed mindre den enkelte forsøgsperson eksplicit fra-beder sig dette, bør forsøgspersonen altid have entilbagemelding om alvorlig genetisk betinget sygdom,hvis:• Der er en rimelig grad af sandsynlighed for, at engenetisk disposition er til stede .• Der foreligger en sikker dokumenteret sammen-hæng mellem den genetiske disposition ogsygdomsudviklingen .• De tests, som benyttes for at fastslå den genetiskedisposition, er sikre .• Sygdommen i væsentlig grad kan forebygges ellerbehandles .• Sammenhængen har en væsentlig betydning forforsøgspersonen .Hvis der under forsøget fremkommer tilfældigheds-fund vedrørende forsøgspersonens helbredsmæssigeforhold, bør der ske tilbagemelding til forsøgsperso-nen om alvorlig genetisk betinget sygdom efter desamme fem kriterier, som er nævnt ovenfor .Årsberetning 2012
Konkret sagsbehandling af genomprojekter(DNVK)DNVK har i 2012 behandlet 7 projekter med omfat-tende kortlægning af den menneskelige arvemasse .De konkrete sager har bl .a . løbende medvirket tiljustering af DNVKs retningslinjer .Dispensationspraksis i genomprojekterDer er stor forskningsmæssig interesse i at kunnegennemføre forskning i de mange biobanker, der eropbygget i forskningsregi, eller i de kliniske biobanker,der findes på hospitalsafdelingerne .
28
VÆSEN tLI G E SAGER, B EGR U N DELSER oG VI DEN S K AB S EtI SK E DR øF tELS ER
Komitéloven åbner mulighed for, at komiteerne kandispensere for kravet om samtykke til forskning ibiologisk materiale, der tidligere er udtaget til behand-ling, eller til brug for et sundhedsvidenskabeligt forsk-ningsprojekt, og opbevares henholdsvis i en kliniskbiobank eller i en (forsknings)biobank, der medDatatilsynets tilladelse er videreført efter et forsknings-projekts afslutning .For registerforskning i menneskeligt biologisk mate-riale, der opbevares i en tidligere etableret forsknings-biobank, forudsættes, at det tidligere forskningsprojekt,hvori materialet blev indsamlet, forudgående var god-kendt af det videnskabsetiske komitésystem, og atforsøgspersonen i forbindelse med udtagelsen afmaterialet er blevet informeret om, at overskydendemateriale opbevares efter forsøgets afslutning medhenblik på anvendelse i et nyt forskningsprojekt .I vurderingen af, om der kan gives dispensation forkravet om samtykke, skal der foretages en viden-skabsetisk vurdering af, om det på nogen måde kanvære en belastning for vedkommende, at disse prø-ver bliver benyttet til et andet formål, og om der kanfremkomme nye helbredsoplysninger om vedkom-mende .De indledende drøftelser i DNVK vedrørende projek-ter om dispensation fra samtykkekravet delte DNVK ito dele, hvor et mindretal fandt, at genomundersøgel-ser på materiale udtaget fra tidligere forsøgspersoneralene bør anvendes efter fornyet samtykke, da det vilvære en belastning for forsøgspersonerne, hvis dekonfronteres med tilfældighedsfund fra de nye under-søgelsesmetoder, som de ikke forinden har haftmulighed for at tage stilling til .Flertallet i DNVK lagde imidlertid særlig vægt på, at depågældende forsøgspersoner tidligere havde afgivetsamtykke til forskning og genanalyser inden for sam-me sygdomskategori, at risikoen for tilfældighedsfundvar minimal, og at der var opstillet hensigtsmæssigeprocedurer i projekterne til at håndtere sådanne fund .
Eksempel 1 fra praksisTotal exom sekventering (WES) af 2000 danskeremed henblik på at identificere genetiske markører,der er associeret med kliniske og biokemiske varia·ble, som relaterer sig til abnormiteter i sukker· ogfedtstofskifte og åreforkalkning, primært i hjerte oghjerne.I projektet ønskede man at undersøge, hvilken betyd-ningen sjældne ændringer i DNA har for udvikling afstofskiftesygdomme (diabetes, fedme, forhøjet blod-tryk og åreforkalkning) . Undersøgelsen ønskedesgennemført ved at brug af total exom sekventering(WES) af den kodende del af deltagernes arvemasse .Man ønskede at anvende DNA fra 2000 personerfra otte etablerede biobanker, der hidrørte fra tidligeregodkendte forskningsprojekter . 1000 personer villeblive udvalgt ud fra tilstedeværelse af type 2-diabetes,fedme og forhøjet blodtryk . Desuden skulle udvælges1000 raske personer som kontrolpersoner .Forsker havde søgt om dispensation fra kravet omindhentelse af samtykke (komitélovens § 10) .DNVK godkendte forskningsprojektet og dispenseredesamtidig for kravet om indhentelse af samtykke .DNVK lagde ved afgørelsen konkret vægt på:• At det biologiske materiale, der ønskes anvendt iprojektet, stammede fra forsøgsdeltagere, der tid-ligere er indgået i studier, der har til hensigt atundersøge årsagerne til stofskiftesygdomme .• At forsøgspersonerne tidligere er informeret om, atder vil ske undersøgelser af arveanlæg (gener) .• At en del af deltagerne har haft mulighed for attage stilling til, om de ønsker tilbagemelding omvæsentlige helbredsmæssige fund .• At en del af deltagerne må antages at være afgåetved døden .• At projektet søger at finde genvarianter, der poten-tielt er relevante for stofskiftesygdomme . Der søgesikke efter kendte varianter af betydning for andrealvorlige sygdomme, hvorfor risikoen for tilfældig-hedsfund er minimal .
29
VÆ SE NtL IGE S AGE R , B EGR U N DELSER o G VI DEN SK AB SEt I SKE DRøF tE LSE R
DNVK lagde desuden afgørende vægt på, at der iprojektet var opstillet nogle klare og hensigtsmæssigeretningslinjer for håndtering af tilfældighedsfund, dervar i overensstemmelse med DNVKs retningslinjer af1 . november 2012 .Eksempel 2 fra praksisMonogen – genetisk undersøgelse af arvelige hjerte·karsygdommeFormålet med projektet var at afdække genetiskeårsager til sjældne arvelige hjertekarsygdomme medsandsynlig monogen arvegang . Man ønskede at fore-tage Next Generation Sequencing af alle exons ellerhele genomet i flere familier, både raske og syge,med efterfølgende brug af filtrering af de fundne gen-variationer med henblik på at identificere den ellerde sygdomsfremkaldende genetiske variationer ifamilien .DNVK afslog at godkende projektet (efter § 18, stk . 2,jf . stk . 1, nr . 4, og § 19, stk . 2, i komitéloven) .DNVK lagde vægt på, at der manglede en egentligpower analyse i projektet, og at det i øvrigt ikke villegive vægt på styrkesiden at inddrage raske børn .
Herudover fandt DNVK ikke, at projektet opfyldtekomitélovens betingelser for inddragelse af børn, dabørnene dels ikke ud fra det oplyste kunne anses forat være afgørende for projektets gennemførelse, delskunne projektet ikke formodes at have til udsigt atgavne børnene direkte (§ 19, stk . 2) .DNVK fandt det særligt betænkeligt at inddrage børn,som på inklusionstidspunktet var at betragte somværende raske . DNVK lagde herved vægt på, at detikke i projektet var tilstrækkeligt oplyst, om der for denævnte sygdomme var tale om sent eller tidligt debu-terende sygdomme, og om der således var et fore-byggelses- eller behandlingsbehov i barne- og ung-domsårene .Når der ikke er en sundhedsmæssig fordel for barnet,taler det imod inddragelse af børn i sundhedsviden-skabelige forskningsprojekter .
Årsberetning 2012
30
VÆSEN tLI G E SAGER, B EGR U N DELSER oG VI DEN S K AB S EtI SK E DR øF tELS ER
31
Udviklingstendenser, samarbejdeog koordineringDe videnskabsetiske komiteer deltager i diverse sam-arbejdsorganer, hvor varetagelsen af opgaverne koor-dineres . Samordningsforum er et forum, hvor komite-ernes sekretariater mødes og Kontaktforum udgør enplatform for samarbejde mellem komiteernes for-mandsskaber .Afsnittet beskriver også udviklingstendenserne iDanmark og inden for EU .Herudover er Kontaktforum omdrejningspunkt forkvalitetsudviklingen i komitésystemet og der har iårets løb bl .a . været drøftet følgende:• Godkendelse af disposition for en fællesårsberetning• temaer for komitésystemets årsmøde• Godkendelse af kommissorium for arbejdsgruppeom ny vejledning om kontrol• Godkendelse af skitse til proces og indhold iopgaven med testsager og audit (se afsnittet omKontrol og kvalitetsudvikling)• Status for de regionale komiteers videnskabsetiskekontrol og drøftelse af fælles tema for kontrol frem-over (se afsnittet om Kontrol og kvalitetsudvikling)
SamordningsforumDer har været afholdt to møder i Samordningsforum,hvor repræsentanter for de regionale sekretariater ogDen Nationale Videnskabsetiske Komités sekretariatmødes . Formålet med Samordningsforum er at koor-dinere sagsbehandlingen . På Samordningsforum harder i 2012 været drøftet en række spørgsmål, derknytter sig til implementering af den nye lov .Endvidere har der bl .a . været drøftet spørgsmål omrekruttering af forsøgspersoner og oplysning om fonds-støtte indkommet efter godkendelse i videnskabsetiskkomité . Samordningsforum har også drøftet ny lovgiv-ning af relevans for komitésystemet – bl .a . nye reglerom anmeldelse til Datatilsynet og nye regler for fuld-magt i lægemiddelforsøg .
Udviklingstendenser inden for densundhedsvidenskabelige forskningTendenser i forskningenDen 2 . februar 2012 blev der afholdt en konferenceom kliniske lægemiddelforsøg i Region Hovedstadenmed deltagelse af repræsentanter for erhvervslivet,sundhedsvæsenet og patienterne, hvor fokus var påudfordringer og nye muligheder for at fremme samar-bejdet med erhvervslivet .Baggrunden for konferencen var den faldende aktivi-tet i kliniske forsøg i Danmark . Konferencen gav enpejling på konkrete initiativer, som kan hjælpe til, atudviklingen vendes . I konferencen deltog repræsen-tanter fra industrien, hospitaler, Region Hovedstadensstøttefunktioner og staten .På konferencen blev der såvel fra industri som offent-lig side opfordret til fortsat dialog om dette vigtigeemne; der var bred enighed om at arbejde for enfortsat styrkelse af de kliniske forsøg i Danmark .Et outcome af konferencen har været, at RegionHovedstaden har taget initiativ til at afholde en møde-række om fase 1 forsøg i Danmark . Møderne holdesi dialogform med snak ud fra facts om forholdene forfase 1 forsøg i Danmark . Der deltager repræsentanterfra klinikere, fase 1 klinikere, myndigheder og indu-strien .
KontaktforumDet blev ved lovrevisionen forudsat, at der etablereset forum, der kan sikre fortsat koordinering og samar-bejde i det videnskabsetiske komitésystem .Kontaktforum består af formandskaberne for de regio-nale komiteer og den nationale komité og Kontaktfo-rum har i 2012 afholdt 2 møder . Fokus for møderneer erfaringsudveksling i form af orientering om ogdrøftelse af konkrete sager i henholdsvis de regionalekomiteer og den nationale komité, ligesom man hardrøftet principielle spørgsmål (fx rekrutteringsmetoder– hvornår starter et forsøg)?
Årsberetning 2012
32
U DVI KLI NGSt EN DEN SER, SAMAR B EJ DE oG KooR DI N ER I NG
Udviklingstendenser på europæisk planRevision af direktiv om kliniskelægemiddelforsøgI sommeren 2012 fremsatte Europarlamentet ogRådet forslag til en ny forordning om kliniske forsøgmed lægemidler . Forordningen skal erstatte det eksi-sterende direktiv om kliniske forsøg (direktiv 2001/20/EF – GCP-direktivet), der er blevet kritiseret for atmedvirke til omstændige ansøgnings- og vurderings-procedurer, som skal gennemføres i hver enkeltmedlemsstat .Hovedindholdet i forordningsforslaget er:• Der indføres en ny godkendelsesprocedure:• Et harmoniseret godkendelsesdossier .• Fælles anmeldelsesportal - forbundet til EU-database .• Fælles vurderingsprocedure underlagt medlems-staternes kontrol – de stater, hvor sponsor søgerom at gennemføre det kliniske forsøg, er involve-ret i vurderingen . Der udpeges en ”rapporterendemedlemsstat” .• Klare frister med begrebet ”stiltiende godkendelse”• Forum for koordinering og rådgivning, ledet afKommissionen .• Klar sondring mellem forhold, som medlemssta-terne er fælles om at vurdere, og forhold af etisk/national karakter, hvor vurdering sker af hverenkelt medlemsstat .• Medlemsstaten kan i visse tilfælde ”opt-out”(træde ud af processen), hvis den ikke er enig iden fælles vurdering af en ansøgning . Forsøgetkan så ikke gennemføres i den pågældendemedlemsstat .• Det er op til hver medlemsstat at definere deorganisatoriske rammer, der er nødvendige forat overholde godkendelsesproceduren . Der skerderfor ikke harmonisering af de etiske komiteersfunktioner eller vurderinger . Det er medlemssta-terne, der internt tilrettelægger fordelingen afopgaver på forskellige organer .• Mulighed for at gennemføre kliniske forsøg medlægemidler i akutte situationer uden samtykke ioverensstemmelse med internationale retningslinjer .
• Bestemmelser om bivirkningsindberetning forenkles:• Sponsor kan indberette formodede uventedebivirkninger direkte i Eudravigilance databasen• Forenklet årlig rapportering .• Bestemmelser om gennemførelse af forsøget(detaljerede retningslinjer for god klinisk praksis)samles i forordningen .• Definition af forsøgslægemiddel: kan være et god-kendt, det vil sige allerede markedsført lægemiddel .Et hjælpelægemiddel (ikke-testpræparater) under-lægges bestemmelser om fremstilling og mærk-ning .• Begrebet medsponsorering indføres, så flere initia-tivtagere til et forsøg kan være medansvarlige forforsøget .• Differentieret krav til forsikring – lav risiko, ej kravom obligatorisk forsikringsordning . Sponsor i risiko-forsøg skal dog sikre, at der ydes erstatning . Med-lemsstaterne forpligtes til at indføre en nationalerstatningsordning uden fortjeneste for øje (navnligfor at hjælpe ikke kommercielle sponsorer med atopnå dækning, da det til tider er vanskeligt/beko-steligt at tegne forsikring herfor) .DNVK afgav den 3 . september 2012 høringsbidrag tilMinisteriet for Sundhed og Forebyggelse .Generelt set fandt DNVK, at forordningsforslaget givermulighed for en smidigere godkendelsesproces aflægemiddelforsøg inden for EU, og vil kunne begræn-se de administrative omkostninger for sponsorer ogderved forbedre mulighederne for lægemiddelforsk-ning i Europa, også inden for akutforskningen .DNVK pegede dog på, at en væsentlig bagside vedforslaget er, at mulighederne for, at de enkelte landekan ”opt-out” af en fælles beslutning, er begrænsede .Desuden bemærkede DNVK, at de foreslåede tids-frister i den fælles beslutningsproces vil gøre detsærdeles vanskeligt at opretholde den nuværendeorganisering af komitésystemet for så vidt angår læge-middelforsøg (læs hele DNVKs høringssvar i afsnittetom Høringer) .
33
U DVI KL I NG St E N DE N S E R , SAM AR B EJ D E oG KooR DI N ER I NG
Forslag til forordning om genereldatabeskyttelsePå et andet område af betydning for den sundheds-videnskabelige forskning har Europa-Kommissionenfremsat forslag til ny regulering . Det drejer sig omEuropa-Kommissionens forslag til Europa-Parlamen-tets og Rådets forordning om beskyttelse af fysiskepersoner i forbindelse med behandling af personop-lysninger og om fri udveksling af sådanne oplysninger(generel forordning om databeskyttelse) .Forslaget, der skal erstatte det gældende databeskyt-telsesdirektiv (95/46/EF), som i dansk ret er imple-menteret ved persondataloven, har stor betydning forsundhedsområdet, den sundhedsvidenskabeligeforskning i Danmark og det videnskabsetiske komité-systems arbejdsområde, da det bl .a . regulerer opbe-varing af personhenførbare oplysninger i forbindelsemed forskning og biobanker .Hovedpunkter i forslaget til forordning(set fra komitésystemets synsvinkel):• Sikre borgere retten til at få slettet alle oplysninger(med mindre modstående hensyn) – retten til atblive ”glemt”• Sikre at samtykke – hvis krav – gives udtrykkeligt iform af erklæring eller handling• Let adgang til egne oplysninger og til at få kopi afdata• Fjerne den generelle anmeldelsespligt - men givedatabeskyttelsesmyndighederne bedre beføjelser tilat udføre undersøgelser, træffe afgørelser og iværk-sætte sanktioner• Etablere ”one-stop-shop”, så registeransvarlige i EUkun skal henvende sig et sted (i det land, hvor virk-somheden har hovedkontor)• Garantere beskyttelse af EU-borgeres persondataefter forordningen i situationer, hvor der sker over-førsel af oplysninger til tredjelande . Afgørelser omsikre tredjelande .DNVK afgav den 13 . juni 2012 bidrag til Ministerietfor Sundhed og Forebyggelse . Ministeriet afgav senereet samlet høringssvar til Justitsministeriet på heleministerområdet .
Det er Justitsministeriet, der repræsenterer Danmarkved forhandlingerne om forordningsforslaget i Rådet .DNVK havde desuden forud deltaget i en række mø-der i Ministeriet for Sundhed og Forebyggelse, derhavde til hensigt at forsøge at klarlægge forordnin-gens betydning på ministerområdet .I høringssvaret pegede DNVK overordnet på, at detser ud til, at man med forordningsforslaget vil kunnefortsætte den sundhedsvidenskabelige forskning i fxbiologisk materiale som hidtil, ligesom det fortsat vilvære muligt at indsamle materiale til fremtidig brug .DNVK bemærkede dog, at det ikke længere klartfremgår, at allerede indsamlet materiale kan brugestil fremtidig forskning .DNVK fandt derfor, at man bør sikre, at ændringerneikke får betydning for opretholdelse af den praksis,der i dag reguleres af de eksisterende danske regleri sundhedsloven, komitéloven og persondatalovensærligt vedrørende kliniske biobanker, biobankforsk-ning og opbevaring af data efter afslutning af forsøgs-deltagelse . Bestemmelsernes konsekvenser må isidste ende vurderes i forhold til rækkevidden af for-ordningens art . 81 og 83, der giver mulighed for fast-sættelse af nationale regler .DNVK havde desuden en række bemærkninger tilenkelte bestemmelser og spørgsmål til rækkeviddenheraf (se hele DNVKs høringssvar i afsnittet omHøringer) .Ministeriet for Sundhed og Forebyggelse afgav i maj2012 høringssvar til Justitsministeriet, som blev fulgtop af et fælles brev fra sundhedsministeren og forsk-ningsministeren til justitsministeren . I brevet blev detpointeret, at det er væsentligt, at der ikke indføresskærpelse af reglerne på forskningsområdet, såledesat vi i Danmark fortsat kan udnytte de unikke forud-sætninger for videnskabelig forskning, herunder sund-hedsvidenskabelig forskning, som vi har i kraft af vel-udbyggede danske registre og biobanker .
Årsberetning 2012
34
U DVI KLI NGSt EN DEN SER, SAMAR B EJ DE oG KooR DI N ER I NG
35
Kontrol og kvalitetsudviklingIfølge komitéloven skal de videnskabsetiske komiteerføre tilsyn med, at et godkendt projekt gennemføres ioverensstemmelse med loven . Dette gælder for pro-jekter, der ikke er lægemiddelforsøg . Lægemiddelfor-søg skal inspiceres af Sundhedsstyrelsen . Den nykomitélov giver komiteerne adgang til relevante deleaf patientjournalen i forbindelse med gennemførelseaf kontrollen, og repræsentanter fra komitésystemethar nu ret til uden forudgående retskendelse at fore-tage kontrol på virksomheder, sygehuse m .v . Lovengiver endvidere hjemmel til at stoppe et projekt ellereventuelt udstede påbud . De nye regler kan desudensanktioneres med straf . Nedenfor beskrives kontrol-aktiviteterne i de enkelte regioner .evt . udskydelse . Det var desværre ikke muligt at ud-tage et nyt projekt, inden den påtænkte dato ogheller ikke muligt at finde en ny dato inden åretsudgang . Der er derfor kun udført egentligt tilsyn påét projekt i 2012 .tilsynet blev udført på forsøgsstedet og foregik såle-des, at de tilsynsførende komitémedlemmer talte medforsøgsansvarlige og et medlem af forskningsgruppenom status på forsøget . Forsøgsansvarlige fremvistedesuden et af de lokaler, der typisk bruges til afhold-else af mundtlige informationssamtaler . Samtidig sadsekretariatsmedarbejderne i et separat lokale oggennemgik det relevante projektmateriale .tilsynet viste få mindre uoverensstemmelser i forholdtil datering på enkelte erklæringer, og desuden lå deren senere version af protokollen, end den godkendte .Forskellen mellem denne version og den godkendtevar alene en sproglig uddybning af to begreber . Her-udover blev forsker først i forbindelse med adviserin-gen opmærksom på, at der skal foreligge en skriftligdelegation, hvis andre skal afgive information og ind-hente samtykke . En sådan delegation forelå derfor påtilsynstidspunktet, men havde ikke været udformet,da rekrutteringen påbegyndtes . Komiteen bad omfremsendelse af opdateret protokol og fandt herud-over ikke anledning til yderligere .Efter tilsynet udfærdigede sekretariatet et rapportud-kast, der først blev godkendt af de deltagende komi-témedlemmer og herefter sendt til kommenteringhos forsker . Denne fik en frist på 30 dage, men hav-de ingen bemærkninger . tilsynsrapporten blev heref-ter forelagt de øvrige komitémedlemmer til godken-delse .Erfaringerne er, at forskerne virker meget interesse-rede og samarbejdsvillige og gerne vil fortælle omderes projekt . Den korte frist gav lidt udfordringer forden forsøgsansvarlige, der blev udført tilsyn hos, menhan fik det dog hurtigt løst, da han prioriterede atvære til rådighed under hele tilsynet .Ligeledes som led i komiteens tilsynsforpligtelse erder løbende over året blevet fulgt op på forskernestilbagemeldinger på projektafslutning i forhold til god-kendelsesperioden .
Den Videnskabsetiske Komitéfor Region NordjyllandDer har ikke i løbet af året været behandlet projekter,der har givet komiteen anledning til, allerede vedbehandling, at udvælge projektet til kontrol . Der blevderfor, ultimo 2012, udvalgt to projekter ved lodtræk-ning . Langt hovedparten af de projekter, der bliverbehandlet i komiteen, kommer enten fra en sygehus-afdeling eller fra universitetet . Komiteen besluttedederfor, at der skulle udtrækkes et projekt fra hhv .sygehus- og universitetsregi, da dette også kunne givekomiteen et bredere erfaringsgrundlag i forhold til til-synsopgaven .tilsynstemaet var gennemgang af samtykkeerklærin-ger samt øvrigt projektmateriale .tilsynsgruppen bestod af tre komitémedlemmer ogto sekretariatsmedarbejdere . Der var på forhånd fast-lagt to tilsynsdatoer og ca . 1-1½ uge før denne dato,kontaktede sekretariatet telefonisk de to forsøgsan-svarlige med varsling om dato og tidspunkt, oplysningom tilsynstema, hvilke dokumenter komiteen ønske-de adgang til samt praktiske oplysninger om deltagerei tilsynet, den praktiske afholdelse (lokation) og ikkemindst, at projektet ikke var udtaget på baggrund afen mistanke om uregelmæssigheder . Disse oplysnin-ger blev ligeledes fremsendt skriftligt . Den ene for-søgsansvarlige har flere igangværende projekter ogvar derfor ikke på adviseringstidspunktet opmærksompå, at netop det udtagne projekt var bagefter tidspla-nen i forhold til igangsættelse, og der var endnu ikkerekrutteret deltagere, hvorfor tilsynet blev aflyst – medÅrsberetning 2012
36
KoNtR oL oG KVALItEtS U DVI K LI NG
De Videnskabsetiske Komiteerfor Region MidtjyllandRVK Midtjylland har ført kontrol med godkendteprojekter på følgende områder:
Løbende kontrolKomiteerne fører løbende kontrol med, at forskereoverholder deres forpligtelser til at indsende den år-lige sikkerhedsrapport samt melde projektet afsluttetog indsende den endelige rapport .I forbindelse med godkendelsen af et projekt sættesder erindring i sagen om både afslutningstidspunkt ogdato for den næste årlige sikkerhedsrapport . Erindringom afsluttende rapport registreres, når komiteenmodtager underretning om afslutning af projektet .Såfremt disse oplysninger ikke indsendes, rykkersekretariatet for dem .Der er rigtig mange forskere, der ikke er opmærksompå, at deres tilladelse er udløbet, og at de skal ind-sende en årlig sikkerhedsrapport . Sekretariatet har i2012 udsendt en stor mængde rykkere omkringdette .Når forskerne melder tilbage, giver det som regel ikkeanledning til yderligere bemærkninger . I 2012 var derto tilbagemeldinger, der gav anledning til yderligereundersøgelser:Projekt 1Forsker oplyste i sin årlige sikkerhedsrapport, at dervar ændret på forsøgets design . Man havde valgt atlade en undersøgelse udgå . Komiteen undrede sigover dette, da der ikke var anmeldt en tillægsprotokol .Komiteen kontaktede derfor forsker og bad om enredegørelse .Forsker havde været af den opfattelse, at når man togen invasiv undersøgelse ud af projektet, skulle detikke anmeldes til komiteen, da forsøgspersonernedermed blev udsat for mindre risici .Komiteen indskærpede over for forsker, at alle æn-dringer i forsøgets design skal anmeldes til komiteen .Projekt 2I den afsluttende rapport oplyste forsker, at der havdeværet inkluderet 10 personer i projektet . Dette undre-de komiteen, da projektet var godkendt til at inkludere
36 personer . Komiteen bad derfor om en redegørelsefor, hvorfor der kun var blevet inkluderet 10 personer,samt hvilken betydning det havde for projektets viden-skabelige konklusioner . Forsker oplyste, at man havdevalgt at undlade at udføre en del af projektet . Komi-teen kunne konstatere, at denne ændring ikke varblevet anmeldt til komiteen .Komiteen afventer pt . en nærmere redegørelseomkring hændelsesforløbet .
Diverse henvendelser og oplysningerKomiteerne følger hvert år op på oplysninger omuregelmæssigheder i projekter . Det kan være forskerselv, der retter henvendelse om et konkret projekt,som han har iværksat og nu er kommet i tvivl, omskal anmeldes, men det kan også være oplysningerfra andre, avisartikler eller forsøgsannoncer, der giveranledning til, at komiteen følger op på projekter .I 2012 har komiteen foretaget 2 nærmere undersøg-elser på denne baggrund:Projekt 1Komiteen havde udstedt en betinget godkendelse,hvor betingelsen kun vedrørte nogle få af de inklude-rede forsøgssites . Komiteen fik telefonisk oplysningom, at et af de sites, som betingelsen ikke vedrørte,allerede var gået i gang med projektet . Der er ingensites, der må påbegynde projektet før der er udstedtendelig godkendelse, og komiteen kontaktede derforden forsøgsansvarlige på det pågældende site . Denforsøgsansvarlige kunne dog oplyse, at der var taleom en fejlinformation, og at man naturligvis afventededen endelige godkendelse fra komiteen .Projekt 2I dette projekt rettede en forsker henvendelse tilkomiteen med henblik på vurdering af anmeldelses-pligten . Forsker oplyste endvidere, at han alleredehavde inkluderet 4 personer i projektet .Komiteen vurderede, at der var tale om et anmeldel-sespligtigt projekt .Forsker fik besked om at anmelde projektet straks, ogat de 4 inkluderede var berettiget til erstatning for athave deltaget i et sundhedsvidenskabeligt forsknings-projekt, der ikke var godkendt af komiteen .
37
Ko N tRo L o G KVA LI t Et SU DVI KLI NG
InspektionerKomiteerne besluttede at foretage to inspektioner iefteråret 2012 af to forskningsprojekter godkendt afhenholdsvis komité I og komité II .Komiteerne besluttede, at inspektionerne skulle havesærlig fokus på dokumenter og indhentelse af infor-meret samtykke (underskrift på samtykkeerklæring-erne) .Komiteerne besluttede ligeledes, at projekterne skullevære godkendt efter ikrafttrædelse af den nye komité-lov, og at projekterne skulle tilfældigt udvælges, dogsåledes at der skulle indgå habile forsøgspersoner .Sekretariatet foretog inspektionerne på vegne afkomiteerne .Forsker blev forinden varslet om inspektionen og op-lyst om, hvilke dokumenter, der skulle foreligge vedinspektionen .Under inspektionen fremlagde den forsøgsansvarligeprojektet, herunder særligt forløbet for rekruttering,informering og indhentelse af det informerede sam-tykke fra forsøgspersonerne .Herefter gennemgik sekretariatet dokumenterne medhenblik på at kontrollere, at de dokumenter forskerarbejder efter også er de godkendte dokumenter, ogsekretariatet gennemgik samtykkeerklæringerne .Efterfølgende redegjorde sekretariatet for de eventu-elle fejl og mangler sammen med forsker, og der varen generel drøftelse af indhentelse af det informe-rede samtykke, og hvornår og hvordan samtykke-erklæringen skal underskrives .Efter inspektionen sendte sekretariatet en kontrol-rapport til forsker med de bemærkninger som inspek-tionen havde givet anledning til . Forsker fik herefteranledning til at kommentere på rapporten indenkomiteen traf endelig afgørelse om, hvordan der skalfølges op på inspektionen .Projekt 1Komiteen foretog inspektion i projektet den 21 .november 2012 . Alle forsøgspersoner havde gen-nemført projektet, og forsker var i gang med at gøredata op .Årsberetning 2012
Komiteen fandt følgende uregelmæssigheder iprojektet:1 . Der manglede 4 samtykkeerklæringer .2 . Det blev under inspektionen oplyst, at nogle afpatienterne havde fået foretaget en skanning forat se, om de kunne indgå i forsøget .3 . Det blev endvidere oplyst, at der var fjernet enskanning fra forsøgets design . Dette var ikkeanmeldt til komiteen .Komiteen oplyste, at data fra de 4 personer, hvor derikke var en samtykkeerklæring, ikke kunne indgå iprojektet . Forsker anmeldte efterfølgende en tillægs-protokol med henblik på at indhente de manglendesamtykker . tillægsprotokollen blev godkendt af komi-teen .Komiteen oplyste, at før der er afgivet informeretsamtykke, kan der kun foretages screening for in- ogeksklusionskriterier gennem interviews . Egentlige un-dersøgelser betragtes som en forsøgsrelateret proce-dure, og der skal derfor være indhentet informeretsamtykke, før disse foretages .Komiteen forklarede videre, at når man fjerner enundersøgelse, ændrer man forsøgets design, hvilketkræver godkendelse fra komiteen .Da projektet var afsluttet, fandt komiteen ikke anled-ning til at foretage yderligere omkring nr . 2 og 3 .Projekt 2Komiteen foretog inspektion i projektet den 21 .november 2012 .Komiteen fandt følgende uregelmæssigheder iprojektet:1 . Deltagerinformationen var ikke vedlagt ”Forsøgs-personens rettigheder i et sundhedsvidenskabeligtprojekt”, når deltagerinformationen blev udleverettil potentielle forsøgspersoner .2 . Den udleverede deltagerinformation var ikke blevetopdateret med den seneste tildelte økonomiskestøtte til projektet .3 . Der var uregelmæssigheder på 5 samtykkeerklæ-ringer, fx at lægen ikke havde anført datoen for sinunderskrift eller, at der var gået uforholdsmæssigtlang tid mellem forsøgspersonens og lægensunderskrift .
38
KoNtR oL oG KVALItEtS U DVI K LI NG
Under inspektionen var der en generel drøftelse afindhentelse af det informerede samtykke fra forsøgs-personer, og hvornår og hvordan samtykkeerklærin-gen skal underskrives . Komiteen bemærkede i denforbindelse, at det er vigtigt, at datoen for lægensunderskrift er den dato han rent faktisk skriver underog ikke datoen for indhentelse af samtykket . Sidst-nævnte forhold skal ses i sammenhæng med densærlige procedure for indhentelse af samtykke, der erblevet godkendt i det pågældende forsøg .Efterfølgende var der en mailkorrespondance mellemkomiteen og sekretariatet om, hvilke retningslinjer for-søgsansvarlige skal følge, når han skal opdatere delta-gerinformationen med den løbende støtte han mod-tager til projektet .Inspektionen gav anledning til at komiteen gav for-søgsansvarlige påbud om at:• Deltagerinformationen vedlægges ”Forsøgsper-sonens rettigheder i et sundhedsvidenskabeligtprojekt”, når deltagerinformationen blev udleverettil potentielle forsøgspersoner .• At deltagerinformationen opdateres med denøkonomiske støtte modtaget til projektet efter demellem forsker og komiteen vedtagne retningslinjer .
Den Videnskabsetiske Komitéfor Region SyddanmarkKomiteen besluttede, at der i 2012 skulle gennemfø-res kontrol i et projekt, som havde påkaldt sig komite-ens opmærksomhed ved i rekrutteringsproceduren atbeskrive en prærandomisering – altså at forsøgsdelta-gerne blev randomiseret til to forsøgsgrupper, før dervar afgivet skriftligt informeret samtykke . Efterfølgendeblev der meddelt afslag i projektet, idet den forsøgs-ansvarlige ikke ændrede rekrutteringsproceduren somønsket af komiteen .Et stort set identisk forsøg blev efterfølgende anmeldtog godkendt af komiteen, idet der nu var beskreveten korrekt rekrutteringsprocedure .temaet for komiteens kontrolbesøg var derfor, omder var indhentet korrekt skriftligt samtykke, herunderom den forsøgsansvarlige kunne fremvise under-skrevne samtykkeerklæringer for alle inkluderedeforsøgsdeltagere .Ved kontrolbesøget kunne den forsøgsansvarlige ikkefremlægge samtykkeerklæringerne, og komiteensrepræsentanter (formanden, et lægmedlem samt tosekretariatsmedarbejdere) konstaterede, at de admi-nistrative procedurer for dokumenthåndtering ogjournalføring var mangelfulde . Endelig indikeredekontrolbesøget, at den forsøgsansvarlige ikke modtogtilstrækkelig vejledning og ressourcer til forsvarliggennemførelse af forsøget .Komiteen behandlede sagen på et komitémøde ogrettede henvendelse til forsknings- og afdelingsledel-sen med henblik på en redegørelse . Efterfølgende erforsøget blevet stoppet .
AfslutningKomiteerne er i forbindelse med sin kontrol i 2012især stødt på følgende fejl:• Generelt manglende overblik over, hvilke oplysnin-ger, der skal indsendes til komiteen (årlig rapportom sikkerhed, underretning om afslutning og afslut-tende rapport) .• En opfattelse af, at man kan fjerne undersøgelserog analyser fra forsøgets design uden ansøgning tilkomiteen .• Mangler ved samtykkeerklæringer .
39
Ko N tRo L o G KVA LI t Et SU DVI KLI NG
Den Videnskabsetiske Komitéfor Region SjællandRVK Sjælland udtog samtlige 14 forsøg ved en enkeltafdeling med et aktivt forskningsmiljø til kontrol for at:• Gennemgå et stort antal projekter med et begræn-set tidsforbrug i en region med relativt store afstan-de mellem sygehusene .• Belaste så få afdelinger som muligt så lidt sommuligt under kontrollen .Ifølge en søgning i komitésystemets database var dermedio januar 2013 registreret 271 godkendte oguafsluttede forsøg i Region Sjælland . Det vil sige, atkomiteen i 2012 har kontrolleret lige over 5% af deforsøg, der er i gang i regionen .Forskerne blev adviseret 18 dage før kontrolbesøgetfor på én gang at tilgodese følgende konkurrerendeog delvis modsat rettede hensyn:• Sikring af et retvisende billede af forsøgene ved enkort frist for at minimere risikoen for, at dokumentereller procedurer ændres .• En maksimal generalpræventiv effekt via bevidsthedhos andre forskere om muligheden/risikoen forbesøg med en relativt kort frist .• Forebyggelse af at kontrollen påvirker patientbe-handlingen negativt via aflysninger . Dette taler foren relativt lang frist .• Maksimering af antallet af kontrollerede forsøg vedat give en relativt lang frist, så inspektion foretagespå et tidspunkt, hvor forskerne ikke har planlagtophold uden for sygehuset .For at maksimere antallet af kontrollerede forsøg fikforskerne flere datoer at vælge mellem, og de fandt ifællesskab en dato, hvor samtlige forsøg kunne kon-trolleres ved at forsøgsansvarlige eller et medlem afforskergruppen var til stede .I den indledende henvendelse pr . mail til forskerne:• Blev der redegjort for baggrunden for kontrollen .• Blev det præciseret, hvilke dokumenter forskerneskulle medbringe til kontrollen .• Blev det fremhævet, at forsøget var udtaget somled i en stikprøvekontrol og ikke på konkret mistan-ke om uregelmæssigheder i gennemførelsen afforsøget .
Sygehusledelse og afdelingsledelse blev orienteretom besøget, idet det også over for disse blev frem-hævet, at der alene var tale om en stikprøvekontrol,og at afdelingen ikke var udtaget til kontrol på mistan-ke om uregelmæssigheder i gennemførelsen af forsø-gene .Kontrollen blev gennemført som inspektion på stedetmed deltagelse af komiteens formand og næstfor-mand samt en medarbejder fra komitésekretariatet .Hver kontrol blev indledt med en kort redegørelseover for forsker af baggrunden for og formålet medkontrollen .For hvert forsøg blev undersøgt:• overensstemmelse mellem anvendte dokumenterog godkendte dokumenter . Konkret blev følgendedokumenter sammenlignet: Protokol, deltagerinfor-mation(er) samt samtykkeerklæring(er) .• om der forelå godkendelse fra Datatilsynet af data-baser via Region Sjællands paraplygodkendelse fraDatatilsynet .• om der forelå underskrevne samtykkeerklæringerfor forsøgspersonerne .• om underskrevne samtykkeerklæringer så trovær-dige ud .• Sikkerhed vedr . opbevaring af dokumenter .Flere af forsøgene indgik i ph .d .-forløb . Én forsøgsan-svarlig kunne ikke deltage, da kontrolbesøget fandtsted, men en overlæge fra forskergruppen redegjordefor dette forsøg, og alle de ønskede dokumenter blevfremlagt ved inspektionen . Ét forsøg var aldrig blevetpåbegyndt og kunne derfor ikke kontrolleres . Efterføl-gende blev det slutregistreret i komitésystemets data-base som ”aldrig iværksat” . Der blev således kontrol-leret 13 forsøg . Hver kontrol tog i gennemsnit mellemet kvarter og en halv time, om end fire forsøg havdeså mange fællestræk, at de blev behandlet parallelt(parvis) . Samtlige dokumenter, som forskerne var ble-vet bedt om at tilvejebringe, var fundet frem forud forinspektionen . Ved gennemgangen af fire forsøg blevdet oplyst, at de var afsluttet, uden at komiteen dogvar orienteret om dette, og forsøgene blev slutregi-streret efter inspektionen .
Årsberetning 2012
40
KoNtR oL oG KVALItEtS U DVI K LI NG
Efter inspektionen udarbejdede komitésekretariatetudkast til en inspektionsrapport for hvert forsøg, derblev sendt til den, der havde gennemgået forsøgetved inspektionen, idet disse blev bedt om at kom-mentere rapporten inden for 30 dage . Alle inspek-tionsrapporterne blev godkendt af forskerne udenbemærkninger inden for få dage .Kun i ét tilfælde var der afvigelse mellem det anvend-te og det godkendte materiale: Komiteens forgængerhavde godkendt en protokol af marts 2005, men derforelå en protokol af juni 2008 i sagen . Det blev op-lyst, at der var sket en revision af den godkendte pro-tokol alene som følge af krav fra universitetet i forbin-delse med aflevering af en ph .d .-afhandling, der bl .a .byggede på resultaterne fra dette forsøg . Denne for-klaring blev underbygget af, at ændringen var sketnæsten et halvt år efter sidste forsøgspersons sidstebesøg i januar eller februar 2008 (den sidste forsøgs-person var blevet rekrutteret i 2007) . Der lå ikke no-gen protokol-versioner i sagen fra perioden mellemmarts 2005 og juni 2008 .I ingen af forsøgene var der meddelt dispensation frakravet om indhentelse af informeret samtykke, hvor-for samtykkeerklæringer blev gennemgået i alle dekontrollerede forsøg . I forsøg med et stort antal for-søgspersoner skete det stikprøvevis . I et forsøg varder således givet tilladelse til at inkludere 3 .500 for-søgspersoner – i hovedparten af forsøgene var dergivet tilladelse til at inkludere 100-200 forsøgsperso-ner . I ingen tilfælde opstod der mistanke om mani-pulation med en eller flere samtykkeerklæringer .Med undtagelse af tre forsøg var alle de gennem-gåede samtykkeerklæringer underskrevet af bådeforsøgsansvarlig og forsøgsperson:• I ét forsøg manglede der underskrift fra den for-søgsansvarlige læge på enkelte samtykkeerklærin-ger, og i ét forsøg på en enkelt samtykkeerklæring .Dette blev forklaret med, at der ved informations-samtalen var fokus på at indhente forsøgsperso-nens underskrift på forskers kopi, og på at bådeforsker og forsøgsperson underskrev på forsøgs-personens kopi af samtykkeerklæringen .
• I ét forsøg var én samtykkeerklæring ikke under-skrevet af forsøgsperson og forsøgsansvarlig . Dervar tale om en forsøgsperson fra kontrolgruppenog ikke fra interventionsgruppen . Forsøgspersonenhavde udfyldt et spørgeskema, og det var reeltumuligt for forsøgspersonen at gennemføre delta-gelsen uden at blive opmærksom på, at vedkom-mende deltog i et forsøg . I samme forsøg var tosamtykkeerklæringer underskrevet af forsøgsper-sonen, men ikke af forsøgsansvarlige .Med én undtagelse forelå der for alle forsøg godken-delse af anmeldelse af registre fra Datatilsynet viaRegion Sjællands paraplygodkendelse fra Datatilsynet .Den manglende godkendelse i et forsøg skyldtes, atforsker havde fejlfortolket den præcise betydning afbegrebet ”paraplygodkendelse”, og forsker har efter-følgende anmeldt databasen til Datatilsynet viaRegion Sjællands paraplygodkendelse .Data fra ét forsøg blev opbevaret af monitor . Alleøvrige data blev opbevaret i lokaler på sygehuset, dervar aflåst uden for daglig arbejdstid (sekretariater,sygehusafdelingens forskningskontor eller forskerneskontorlokaler) eller permanent (arkivrum i sygehusetskælder) .For to forsøgs vedkommende var den godkendte stu-dieperiode udløbet (i det ene tilfælde mens den derstod for forsøget til daglig var på barsel) . Det var hen-sigten at få studieperioden forlænget ved hjælp afen tillægsprotokol . For fire forsøg var den godkendtestudieperiode udløbet, uden at forsøget var meldt af-sluttet til komiteens sekretariat, og forsøget blev slut-registreret i komitésystemets database efter inspek-tionen . Der blev udleveret slutrapport for to af disseforsøg i form af en eller flere artikler og/eller en ph .d .-afhandling . Der fremsendes en eller flere publikatio-ner som slutrapport for to forsøg, når publikationernefra forsøget er blevet offentliggjort .
41
Ko N tRo L o G KVA LI t Et SU DVI KLI NG
Ved inspektionen blev der indhøstet følgende erfarin-ger, hvoraf flere bekræftede erfaringerne fra komite-ens videnskabsetiske kontrol i 2011:• Forberedelsen af inspektionen var meget arbejds-krævende og tilnærmelsesvis proportional medantallet af kontrollerede forsøg – der er kun småstordriftsfordele ved at kontrollere et større antalforsøg, da der skal gennemgås en række konkretedokumenter i hvert forsøg .• Fleksibilitet mht . tidspunktet for inspektionen gjordedet muligt at kontrollere samtlige forsøg i stedet forhalvdelen som i 2011 .• En forudgående dialog om hvilke dokumenter derhelt konkret skulle fremlægges ved inspektionen,begrænsede forskernes - og især afdelingssekreta-riatets – arbejde . Forskerne fremhævede, at frem-finding af samtlige patientjournaler i samtlige forsøgville have været en stor belastning for afdelingenssekretariat .• tilsyneladende betød det meget for forskerne, atbåde de selv og deres ledelser udtrykkeligt havdefået besked om, at afdelingen/forsøgene var udta-get ved en stikprøvekontrol .• Den nationale manual var velegnet som udgangs-punkt for at udvælge centrale punkter af relevansfor kontrol af hvert enkelt forsøg .• Kontrollen indebar lejlighed til at besvare spørgsmålfra forskerne, der naturligt blev rejst vedrørendekomitéloven såvel som tilstødende områder .• Betegnelsen ”paraplygodkendelse” om Datatilsy-nets ramme-godkendelse til regionerne med hen-blik på forenklet anmeldelse af forsøg via regionentil Datatilsynet giver anledning til forvirring blandtnogle forskere, der går ud fra, at en ”paraplygod-kendelse” må indebære, at der ikke er behov for atanmelde registre etableret inden for rammerne af”paraplyen” .På baggrund af erfaringer fra den daglige drift samtinspektionen i 2011 blev der set særligt på, hvorvidtuniversitære krav om ændringer af protokoller efter-følgende var anmeldt som tillægsprotokoller . Det varikke tilfældet i ét forsøg . Dette er således et relevantformelt indsatsområde, om end potentialet for at styr-ke forsøgspersonernes sikkerhed ad denne vej for-mentlig er begrænset .
På et tilgrænsende område kan det overvejes, omman fortsat skal benytte betegnelsen ”paraplygodken-delse” om Datatilsynets ramme-godkendelse til regio-nerne, idet den tilsyneladende opleves som tvetydigaf forskere og derfor fører til en underrapportering afregistre .
De Videnskabsetiske Komiteerfor Region HovedstadenDe 6 videnskabsetiske komiteer besluttede i efteråret2012, at kontroltemaet for 2012 ligesom i 2011skulle være samtykkeerklæringer .Der blev udtrukket 20 tilfældige projekter ud af de ialt 640 projekter, der blev anmeldt i 2011 .Kriterierne for udvælgelse var, at der skulle være taleom et projekt anmeldt i 2011 . Der måtte ikke væretale om registerforskning med dispensation fra ind-hentelse af samtykke, forsøget måtte ikke være etlægemiddelforsøg, og forsøget måtte ikke af andenårsag være udtrukket til tilsyn .En ”kontrolgruppe” nedsat blandt medlemmer afkomiteernes formandskaber bestemte, at kontrollenskulle foretages af sekretariatet .Kontrollen blev gennemført efter reglerne i den tid-ligere gældende komitelov (lov nr . 402 af 28 . maj2003 om et videnskabsetisk komitesystem og be-handling af biomedicinske forskningsprojekter medsenere ændringer), da de udtrukne projekter eranmeldt før den 1 . januar 2012, hvor den nye komi-telov trådte i kraft .Sekretariatet gennemførte kontrolbesøgene i periodenfra midten af august 2012 til midten af oktober 2012 .I alle 20 projekter havde kontrolteamet forinden vars-let forsøgsansvarlig om, at projektet var udtaget tilkontrol, og at kontrolteamet ville indfinde sig på for-søgsstedet til kontrol af samtykket på en bestemt dag .Ved kontrolbesøget fremlagde forsøgsansvarlig og evt .andre deltagere fra projektgruppen kort procedurenfor rekruttering af - og kontakten til forsøgspersonerne,samt hvordan indhentelsen af det informerede sam-tykke var foregået .
Årsberetning 2012
42
KoNtR oL oG KVALItEtS U DVI K LI NG
Herefter gennemgik kontrolteamet de foreliggendesamtykkeerklæringer . Først blev det sikret, at det varden godkendte version af samtykkeerklæringen, derblev anvendt, hvorefter udfyldelsen af samtykkeerklæ-ringen blev gennemgået .Forsøgsansvarlig fik ved tilsynsbesøget mulighed for atgive en forklaring på evt . uoverensstemmelser og fejl,som teamet havde fundet . Forsøgsansvarlig blev her-efter oplyst om proceduren for korrekt udfyldelse ogindhentelse af samtykke, og blev desuden vejledt ireglerne herom .Efter hvert kontrolbesøg blev der uarbejdet et udkasttil kontrolrapport, som blev sendt i høring hos forsøgs-ansvarlig . Endelig kontrolrapport blev herefter uarbej-det med forsøgsansvarliges eventuelle bemærkninger .Kontrolteamet havde bemærkninger til alle de udtruk-ne projekter på nær 2, hvoraf der i det ene alene varen enkelt bemærkning omkring en uhensigtsmæssig-hed . 3 af projekterne havde så graverende fejl, at dis-se blev overgivet til komiteerne som tilsynssager .Kontrolrapporten i sin helhed kan ses påwww .regionh .dk
øvrige fejl og mangler var manglende afkrydsning af,hvorvidt forsøgspersonen ønskede oplysninger omegen helbredstilstand og om forskningsprojektet . Deter forsøgsansvarliges ansvar at sikre, at forsøgsperso-nen får alle relevante oplysninger om forsøget .Det er kontrolteamets vurdering, at der ikke er taleom uvilje hos forsøgsansvarlig, men snarere, at der ertale om manglende kendskab til de korrekte regleromkring håndtering af og proceduren for udfyldelse,afgivelse og indhentelse af samtykket .I alle tilfælde har de forsøgsansvarlige været megetåbne overfor kontrollens besøg og været villige til atindrette sig på at følge de korrekte procedurer for ind-hentelse af et korrekt samtykke . Hvor der var fejl ogmangler af formel betydning, har forsøgsansvarligtaget imod kontrollens kritik og har efterfølgende ialle tilfælde indsendt tillægsprotokoller .I de projekter, hvor der fandtes mangler af meregraverende art overgik 3 projekter til tilsynssager ogskulle behandles af den godkendende komité . I dissetilfælde var der tale om, at forsøgspersonens skriftligesamtykke manglede . I det ene projekt fandtes det, atforsøgspersonens underskrift på et forsøgsrelateretdokument kunne betragtes som en tilkendelse omdeltagelse i forsøget . I 2 tilfælde indgik forsøgsperso-nen i forsøget inden der forelå et skriftligt samtykkefra forsøgspersonen (forældrene) . I den tredje sag,var der alene givet mundtlig tilsagn fra påførendeom deltagelse i forsøget .I størstedelen af sagerne har forsøgspersonerne ellerstedfortræderen afgivet et skriftligt samtykke, men ienkelte tilfælde er det tale om, at indhentelse af detinformerede samtykke er sket på et utilstrækkeligtgrundlag .Forsøgsansvarlige på forsøgssitene har alle givet ud-tryk for, at forsøgspersonerne alle er blevet grundigtog korrekt informeret omkring forsøgene . Det et der-for kontrollen vurdering, at forsøgspersonernes grund-læggende rettigheder er blevet overholdt og at del-tagelsen i forsøgene er sket på frivillig basis .Det er kontrollen vurdering, at den foretagne kontrolviser, at der fortsat er behov for fokus på, at det infor-merede samtykke indhentes korrekt .
Kontrolgruppens samlede konklusion – somer til·trådt af de 6 videnskabsetiske komiteer iRegion Hovedstaden:Kontrolteamet fandt, at mange af de fejl og mangler,der blev konstateret i de udtrukne projekter var gen-gangere fra sidste års kontrol . Langt den hyppigste fejlvar fortsat, at det var den informerende person, derhavde skrevet under, i stedet for den forsøgsansvar-lige, som det er foreskrevet i henhold til den dagæl-dende komitélov . Hvor det sidste år mest af alt skyld-tes en generel misforståelse af de gældende regler,skyldtes det i år mere, at forsøgsansvarlig var af denopfattelse, at de nugældende regler om, at den infor-merende person (efter skriftlig delegation) kan atte-stere samtykkeerklæringen, også gjaldt i deres pro-jekter .De generelle og mindre væsentlige mangler var fejlomkring dato, udfyldelse af navn på forsøgspersonen,informerende person og/eller forsøgsansvarlig, samtpåsætning af labels .
43
Ko N tRo L o G KVA LI t Et SU DVI KLI NG
Den Nationale Videnskabsetiske KomitéKlage over afgørelse truffet eftervidenskabsetisk kontrol (DNVK sag)Kontrol i det videnskabsetiske komitésystem kan fåretlige konsekvenser for den ansvarlige for forsøget,hvis der konstateres uacceptable afvigelser . Udoverat et igangværende forsøg kan standses, er der bl .a .strafferetslige konsekvenser, såfremt komitéloven erovertrådt, og pligt til at betale godtgørelse til forsøgs-personer, der er indgået i et forsøg, der er udført istrid med komitéloven .DNVK har i 2012 behandlet en særdeles kompleksklagesag, hvor en forsker klagede over en afgørelse,som en regional komité havde truffet i forbindelsemed, at projektet var udtrukket til videnskabsetiskkontrol, og den regionale komité havde gennemførtet kontrolbesøg på forsøgsstedet . Det bemærkes, atafgørelsen er truffet efter reglerne i den tidligere ko-mitélov, da forsøget er godkendt før 1 . januar 2012 .Tilbagekaldelse af godkendelseAf sagen fremgik, at den regionale komité havde ud-trukket projektet til videnskabsetisk kontrol, og havdegennemført et kontrolbesøg på forsøgsstedet .Ved kontrollen oplyste den forsøgsansvarlige bl .a ., atproceduren ved informationssamtalen havde været,at der allerede på forhånd var sket randomisering afforsøgsdeltagerne til forskellige behandlingsgrupper .Dette var i strid med 2 betingede afgørelser truffetforinden af den regionale komité, hvor det blev stilletsom vilkår for godkendelse af projektet, at der ikkemåtte foretages forsøgsrelaterede procedurer, herun-der randomisering, før forsøgspersonerne havde fåetinformation og afgivet samtykke til deltagelse i forsøget .Den regionale videnskabsetisk komité traf herefter af-gørelse om konsekvenserne af overtrædelsen af vilkå-ret . Komiteen konstaterede, at forsøget ikke var gen-nemført i overensstemmelse med godkendelsen ogkonstaterede, at der ikke måtte henvises til, at detgennemførte projekt var godkendt af komiteen . Des-uden rådede komiteen til, at resultaterne fra forsøgetikke blev offentliggjort og henstillede, at forsøgsperso-nerne blev orienteret om, at de havde deltaget i et for-søg, der ikke var udført i overensstemmelse med dengivne tilladelse og derfor havde ret til godtgørelse .Årsberetning 2012
Den forsøgsansvarlige klagede over den regionalekomités afgørelse, idet den havde stor betydning formuligheden for at publicere resultaterne fra under-søgelsen .Princippet om, at forsøgspersonerne skal have mod-taget information om forsøget og skal have afgivetsamtykke til deltagelsen inden forsøget igangsættes,betragtes som et af de mest grundlæggende og vig-tige hensyn i komitéloven, hvilket er direkte afspejleti komitélovens § 3 .DNVK traf afgørelse om, at godkendelsen af projektetskulle tilbagekaldes .DNVK lagde vægt på, at den forsøgsansvarlige alle-rede inden godkendelse af projektet ved to betingedeafgørelser var blevet gjort opmærksom på, at detønskede design (prærandomisering) ikke kunnegodkendes . DNVK fandt derfor ikke, at den forsøgs-ansvarlige – der havde valgt at opfylde vilkåret ved atindsende revideret projektmateriale – ved den seneregennemførelse af prærandomisering i strid med vil-kåret kunne have en berettiget forventning om, at til-ladelsen kunne bestå .DNVK mente desuden ikke, at tilbagekaldelsen afgodkendelsen var til hinder for, at resultaterne af for-søget kunne offentliggøres fx på en hjemmeside elleri publikationer, der ikke stiller krav om, at forsøget ergodkendt af en videnskabsetisk komité .Efter komitéloven kan den, der iværksætter et projekti strid med vilkårene for tilladelsen, jf . kapitel 4-6 ikomitéloven, straffes med bøde eller fængsel indtil 4måneder . DNVK besluttede på den baggrund at rettehenvendelse til anklagemyndigheden for at orientereom, at projektet var gennemført i strid med vilkårene .DNVK henledte desuden opmærksomheden på, atforsøgspersoner, der har deltaget i et forsøg, der eriværksat i strid med reglerne i komitéloven, eller somikke har afgivet et informeret samtykke, har ret til engodtgørelse på 1 .000 kr . fra sponsor, med mindre detkan dokumenteres, at forholdet ikke skyldtes en fejlfra den forsøgsansvarliges eller sponsors side .
44
KoNtR oL oG KVALItEtS U DVI K LI NG
Audit og testsager (DNVK)Det forudsættes i den nye komitélov, at komitésyste-met i overensstemmelse med anbefalinger fra ud-valget bag betænkning nr . 1515, marts 2010, skalgennemføre testsager og audits som metode til atfremme kvalitetsudvikling, kvalitetssikring og læring ikomitésystemet .Hensigten er, at den nationale komité skal have mu-lighed for at gennemføre testsager, hvor alle regionalekomiteer skal behandle samme fiktive sag som DNVKudsender . Udvalget bemærker, at testsagerne skal an-vendes i et læringsperspektiv og ikke med henblik påkontrol . Det er endvidere vigtigt, at evaluering af test-sagerne sker i fællesskab og i fuld åbenhed . Udvalgetanerkender, at gennemførelse af testsager er ressour-cekrævende . Derfor skal metoden kun anvendes ibegrænset omfang, fx én gang om året .Den nationale komité skal desuden have mulighedfor at gennemføre audits på sager, der allerede er af-gjort i de regionale komiteer . Audits skal anvendes iet læringsperspektiv og ikke med henblik på kontrol .Derfor er det også vigtigt, at auditresultaterne gøresalment tilgængelige for alle komiteer, så der sikresvidensdeling og ensartet praksis .
opgave med audit og testsager forudsætter ikke blotet tæt samspil med de regionale sekretariater, menogså et tæt samspil med de regionale komiteer .opgaven drøftes og besluttes i Kontaktforum, som eromdrejningspunktet for opgaven, mens den praktiskegennemførelse koordineres af Samordningsforummed DNVK som tovholder .DNVK har i 2012 udarbejdet en skitse til proces ogindhold i opgaven med testsager og audit, som harværet drøftet i Samordningsforum og forelagt Kon-taktforum til godkendelse .Det er bl .a . besluttet, at specifikke områder for auditkan være:• Børnesager• Dispensation for samtykkekravet (§ 10)• Anmeldelsespligt• Samtykkeerklæringer• oprettelse af forskningsbiobanker• økonomi i projektet• FormaliaI 2013 skal udarbejdes en detaljeret proces- og ind-holdsplan, der relaterer sig til de vedtagne områderfor henholdsvis audit og testsager, og den første auditskal gennemføres .
45
ÅrsmødeDet årlige fællesmøde for de videnskabsetiske komi-teer blev i 2012 afholdt i Roskilde med deltagelse afmedlemmer af de regionale videnskabsetiske komi-teer, DNVK, sekretariaterne, andre myndigheder ogsamarbejdspartnere . Der var i alt 99 deltagere .Den videnskabsetiske hæderspris 2012 blev uddeltpå årsmødet . Se afsnittet om Den videnskabsetiskehæderspris .Den årlige beretning fra DNVKs formand, Johs Gaub,fokuserede bl .a . på nedsættelse af Den NationaleVidenskabsetiske Komité og komiteens mange nyeopgaver:”Den nationale komité har ifølge loven til opgave atstyrke koordinering af komitésystemet ved at udste·de vejledende retningslinjer, gældende også for deregionale komiteer, som DNVK ikke har instruktions·beføjelser overfor. Den ny lov slår fast, at ved behovfor bindende retningslinjer kan den nationale komitéudarbejde forslag med indstilling til Ministeriet forSundhed og Forebyggelse. Det har vi endnu ikkebenyttet os af.Det er dog forudsat, at koordinering sker i tæt sam·arbejde med de regionale komiteer, bl.a. gennemKontaktforum, der består af formænd og næstfor·mænd fra de regionale komiteer og DNVK. Vi holderi morgen det andet møde i Kontaktforum, erfaring·erne fra det første møde var meget positive og fårmig til at mene, at vi godt kan holde kontakten ogfodslaget gennem halvårlige møder.DNVK har også til opgave at holde sig ajour medden internationale udvikling. Det sker ved deltagelsei europæiske møder om bioetik og ved, at DNVKlejlighedsvis afgiver høringssvar om ændringer iregelsættet for gennemførelse af kliniske forsøg.Med hensyn til deltagelse i møder er det DNVKs poli·tik, at medlemmer og sekretariat inden for budgettetsrammer kan og skal deltage i relevante møder. Alleved, at det er hårdt arbejde at deltage i møder afdenne karakter, ikke mindst fordi DNVK forventerog kræver, at der aflægges en udførlig rapport omudbyttet af mødet til benefice for hele komiteen, iudvalgte tilfælde også for resten af komitésystemet.Jeg havde selv sammen med Vibeke Graff mulighedfor at deltage i et møde i januar, med det informe·rede samtykke som tema. Nogle af de indtryk, vi fikmed hjem, var en udbredt utilfredshed med de be·grænsede muligheder for akut·forskning; tvivl omhvor informeret og utvungent samtykke kan værehos forsøgspersoner fra lande med en mere kollektivsamfundsindretning, hvor stammen eller familiensældste træffer alle afgørende beslutninger; eller ilande, hvor det ikke er kutyme at fortælle alvorligtsyge patienter om deres diagnose; og dokumenterervi i det hele taget vilkårene, hvorunder informeretsamtykke indhentes, herunder forsøgspersonensforståelse?Nu skal vi lige have pusten oven på den nye lov,men intet tyder på, at den videnskabsetiske udviklingnu har nået sit endelige og optimale stade.”(Uddragaf formandens beretning . Hele beretningen kan sespå DNVKs hjemmeside www .dnvk .dk) .Udover DNVKs formand afgav en repræsentant forde regionale komiteer beretning om årets gang i enregional komité . I år var det formand for komité II,Jørgen Aagaard, ved De Videnskabsetiske Komiteerfor Region Midtjylland, der bl .a . orienterede om, atdet var vigtigt for komiteerne i regionen at give engod service til forskerne . Dette kom bl .a . til udtrykved, at man godt kan finde på at indkalde forsker tilsamtale ved et komitémøde for at forklare om projek-tet, hvilket skaber dialog og gensidig respekt .Hovedtemaerne på årsmødet var i øvrigt: Genompro-jekter – Nye udfordringer, Det informerede samtykkeog Vidensdeling og erfaringsudveksling .En Session handlede om denye udfordringer medGenomprojekter .Professor Gunna Christiansen præsenterede hoved-punkter i Det Etiske Råds kommende rapport omGenomundersøgelser .Herefter forklarende professor, forskningsoverlæge,ph .d . Anders D . Bjørglum, Institut for Biomedicin,Aarhus Universitet, omGenomprojekter set fra enforskers side .
Årsberetning 2012
46
ÅR S MøDE
Endelig gav klinikchef, professor Anne Marie Gerdes,Klinisk Afdeling, Rigshospitalet, en gennemgang afGenomprojekter med en klinisk tilgang .Under emnet ”Det informerede samtykke” gav lektorAnders tversted Silber, Københavns Universitet enetisk vinkel pådet informerede samtykke og forsøgs·personers autonomi.Herefter berettede professor, dr . jur . Mette Hartlev(næsteformand i DNVK), Københavns Universitet, omdegældende regler om det informerede samtykke.
Ph .d . studerende Sarah Wadmann, Institut for Folke-sundhedsvidenskab, Københavns Universitet, gavafslutningsvis sit bud påbetydningen af informationfor patienters samtykke til deltagelse i kliniske forsøg .oplægget baserede sig på en observation- og inter-viewundersøgelse af kroniske patienter under delta-gelse i et klinisk forsøg .
47
Den videnskabsetiske hædersprisDen Videnskabsetiske Hæderspris blev indstiftet afDen Centrale Videnskabsetiske Komité i 2002, ogDen Nationale Videnskabsetiske Komité videreførerdenne tradition .Prisen uddeles hvert andet år, så det var såledessjette gang prisen blev uddelt . Prisen består af etsymbolsk beløb på 10 .000 kr . samt et indrammetdiplom .Prisen tildeles en person, en gruppe, en organisationeller virksomhed, som har gjort en fremragende ogtankevækkende indsats på det videnskabsetiske om-råde i relation til sundhed og sygdom .Prisuddelingen fandt sted på årsmødet på ComwellRoskilde, og prisen blev givet til:Professor, ph .d ., dr .h .c ., forskningschef,overlæge Erik SimonsenPsykiatrisk Forskningsenhed, Region SjællandPrisen blev overrakt af departementschef Per okkels,Ministeriet for Sundhed og Forebyggelse .Motiveringen for tildelingen var, at:”Professor, ph .d ., dr .h .c ., forskningschef, overlægeErik Simonsen har med sit stadige fokus på viden-skabsetisk kvalitet ydet en betydelig indsats forpsykiatrisk forskning .Erik Simonsens interesse for dette vigtige forsknings-område har indebåret årelang opfølgning af patientermed psykiske lidelser, og hans indsats på dette feltvidner om omhu og omsorg for de medvirkendepatienter . Eksempelvis det informerede samtykke,som her udgør en særlig udfordring . Ved en grundigproces med gennemførelse af informationssamtale,udførligt skriftligt materiale og efterfølgende ny kon-takt med henblik på yderligere afklaring, har ErikSimonsen i sine studier skabt et solidt grundlag forden enkeltes beslutning om samtykke . Han har her-ved sikret rekruttering af forsøgspersoner, der harhaft interesse i ofte årelang deltagelse .”Læs mere på www .dnvk .dk, om os, Hæderspris,hvor takketale kan læses i sin helhed .
Årsberetning 2012
48
DEN VI DE N SK A B S EtI SK E HÆDER S P R I S
Professor, ph.d., dr.h.c., forskningschef, overlæge Erik Simonsen og departementschef Per Okkels.
49
Internationalt samarbejdeDet internationale samarbejde på komitéområdetforegår primært på nordisk og europæisk plan .Formålet er at fremme god klinisk praksis og motivereanvendelse af fælles standarder af høj kvalitet i allestadier af den sundhedsvidenskabelige forskning iEuropa . EFGCP arrangerer normalt flere årlige work-shops samt en årlig konkurrence .DNVKs formand og sekretariatschef deltog i foråret2012 i en 2-dages workshop om det informeredesamtykke .Informationen til deltagerne skal sikre, at forsøgsdelta-gere kan vurdere forholdet mellem risiko og gavn veddeltagelse i forsøget . En oplægsholder pegede på, atdet er komiteernes opgave at sikre, at mængden afinformation ikke bliver for stor, sådan at det reelt eruforståelig information for deltagerne .En patientrepræsentant oplyste, at patienter ønskerviden om aktuelle kliniske forsøg, fx på en samlethjemmeside, adgang til uafhængig vurdering af pro-jektet, oversigt over andre forsøg på området, hvorog hvordan forsøgspersoner kan få oplysning omresultaterne og om opfølgning på forsøget .En workshop om forsøg i akutte situationer havdefokus på, at der blev gennemført for lidt forskning idenne kategori til skade for patientgruppen .
EUDNVKs sekretariatet deltager sammen med Sund-hedsstyrelsen i EU Kommissionens såkaldte Ad HocGroup . Formålet med arbejdsgruppen er at udviklefælles vejledninger med henblik på en mere harmo-niseret lovgivning og praksis vedrørende kliniske læge-middelforsøg i medlemslandene . Alle EU-lande errepræsenteret i gruppen . I år har gruppen bl .a . drøftetrevisionen af direktivet om kliniske lægemiddelforsøg,idet Kommissionens sekretariat bl .a . ønskede en for-udgående drøftelse af definitionsbestemmelser .Fra dansk side fremlagde man efter opfordring fraKommissionens sekretariat – og efter konsultation afPatientforsikringen – et overblik over den danskepatientforsikringsordning i forhold til kompensation tilforsøgspersoner, der kommer til skade ved deltagelsei et forsøg .
EurecnetDNVKs sekretariat tegner DNVK/Danmark i et EUstøttet 3-årigt projekt – EURECNEt, som er et netværkaf europæiske regionale videnskabsetiske komiteer(EUREC) – se www .eurecnet .org .DNVKs sekretariat og et DNVK medlem deltog iseptember i en EURECNEt konference . temaet varvidenskabelige, etiske og juridiske udfordringer forvidenskabsetiske komiteer ved Whole genomesequencing .På konferencen blev drøftet de juridiske og etiskeproblemstillinger vedrørende anvendelse af de nyemetoder til hel genom sekventering, herunder forhol-det til EU-reglerne om beskyttelse af personoplysnin-ger . De væsentlige etiske dilemmaer var spørgsmåletom videregivelse af oplysninger om tilfældighedsfundog retten til ikke viden, samt spørgsmålet om videre-givelse af oplysninger til pårørende .
Symposium ”Biobanks and biomedicalcollections”DNVKs sekretariat deltog den 19 .-20 . juni 2012 iEuroparådets Symposium ”Biobanks and biomedicalcollections” .Baggrunden for konferencen var, at Europarådetsanbefaling om forskning i biologisk materiale afmenneskelig oprindelse fra 2006 er under revision(Recommendation Rec(2006)4 of the committee ofministers to member states on research on biologicalmaterials of human origin (and explanatory memo-randum) Council of Europe) .
EFGCPDNVKs sekretariat og formand er medlem af Europe-an Forum for Good Clinical Practice (EFGCP), som eren non-profit organisation, der er etableret af og forenkeltpersoner med en professionel involvering isundhedsvidenskabelig forskning .Årsberetning 2012
50
I NtE R NAtIoNALt S AMA R B E J DE
Mødet gav eksempler på en række tendenser, foran-dringer og erfaringer, der ifølge oplægsholderne pegerpå behovet for revision, fx:• Udviklingen inden for genetik, herunder ikke mindstgenom-undersøgelser, der frembringer storemængder af data af potentiel relevans for forsøgs-personer, herunder tilfældighedsfund .• En vis bevægelse hen imod en sammensmeltningaf diagnostik og forskning for så vidt at de prøver,der indsamles i behandlingsregi, ønskes anvendt iforskning, og at lægerne i stigende grad har behovfor forskernes viden til at fortolke de fund, de gør .• Behovet, af hensyn til en effektiv udnyttelse afmaterialerne, for deling af data og for ikke-anonymi-tet, som sammen med de stadig bedre mulighederfor at reidentificere individer ud fra anonyme dataudfordrer donorernes anonymitet . Udviklingen ergået hurtigt også med de private biobanker ogingen har overblik fx over omfanget af prøver, dersendes over landegrænser .• Utilfredshed med det traditionelle samtykke, mensamtidig en erkendelse af forudsætningen for effek-tiv forskning er robuste etiske procedurer med hen-blik på at sikre donorernes interesser og at sikre ettillidsfuldt forhold mellem forsøgspersoner og bio-banker .Hovedkonklusioner fra mødet var:• Skiftet hen imod brugen af omfangsrige, langvarigebiobanker som forskningsinfrastrukturer rejser storespørgsmål ved den nuværende praksis med infor-meret samtykke, både fordi de unødigt kan kommetil at begrænse mulighederne for at drage nytte afforskningen, og fordi de kan medføre, at donorernestilles i en urimelig position .• Løsningen i sådanne sammenhænge kan være atslække på kravene til samtykke – også retten til attrække sig og adgangen til personlige resultater blevdiskuteret – men til gengæld sikre en kontinuerligdialog med donorerne samt andre procedurer, derkan sikre et tillidsfuldt forhold .• Generelt blev der rejst tvivl om mulighederne for atopnå de opstillede hovedformål bedst via interna-tional ”hard law”, jf . kan effekten af en detaljeretdeltagerinformation være, at det bliver endnu merevanskeligt for donorer at forholde sig til samtykket .
NORDENNordisk sekretariatsmødeDNVKs sekretariat deltager årligt i et fælles mødemed de andre nordiske landes centrale myndighederpå komitéområdet . I 2012 var forskningsprojektervedrørende omfattende sekventering af arvemassenpå dagsordenen .Forud for mødet havde Norge udsendt retningslinjerfor videnskabsetisk godkendelse af disse forsøg . Manhavde indtil videre lagt til grund, at de gældenderegler sætter tilstrækkelig ramme for vurdering afprojekter .I øvrigt havde man i Norge gjort følgende overvejelseromkring anvendelse af de nye metoder:• Der stilles som udgangspunkt ikke krav om tilbage-melding/tilbageførsel af resultat i samme grad somi klinikken, da formålet er at frembringe ny viden,og da teknikkerne, der indgår i forsøget, ikke er altider tilstrækkeligt valideret .• Ved tilfældighedsfund stilles der krav om tilbage-melding, hvis der er tale om alvorlige helbreds-mæssige konsekvenser (validerede gener) .• Det skal være beskrevet i protokollen, hvordan detgribes an . Er der tale om et forsøg, der er omfattetaf den norske bioteknologilov, stilles der desudenkrav om genetisk rådgivning før, under og efterforsøget .I øvrigt havde man fra de resterende lande gjort sigfølgende overvejelser:• Information og genetisk rådgivning bør gives påforhånd, så der er mulighed for at sige fra .• Ved alvorlige helbredsmæssige konsekvenser skalder gives tilbagemelding efter almindelige læge-faglige skøn .
51
HøringerI nogen sammenhænge afgiver komitésystemethøringssvar regionsvis og i andre tilfælde afgiverDNVK et høringssvar på vegne af komitésystemet .Nedenfor gengiver de regionale komiteer deresrespektiver høringssvar og DNVK uddrager essensenaf de høringssvar, som DNVK har afgivet .Som et eksempel er problematikken omkring de kor-tere tidsfrister og konsekvensen af, at et land ikke kanoverholde disse – nemlig den stiltiende godkendelse– kan nævnes, at et klinisk lav-interventionsforsøg(med kortere frister) formodes at kunne være et for-søg, hvor et godkendt lægemiddel afprøves på børn . Iløbet af den korte frist skal der også inddrages pædia-trisk ekspertise . overholdelse af fristerne uden at risi-kere, at den vurdering der i dag foretages hos Sund-hedsstyrelsen samt den videnskabsetiske vurderingbliver overfladisk, synes umiddelbart at blive en storudfordring for medlemslandene . og man må altidholde sig for øje, at hensynet til forsøgspersonernesrettigheder, sikkerhed og velbefindende skal gå forudfor videnskabelige og samfundsmæssige interesser .
De regionale komiteers høringssvarRVK NordjyllandHøringssvar fra Den Videnskabsetiske Komité forRegion Nordjylland afgivet som bidrag til RegionNordjyllands høringssvar til EU·forslag om kliniskelægemiddelforsøgDen Videnskabsetiske Komité for Region Nordjyllandhar følgende bemærkninger til det udsendte for-ordningsforslag . overordnet set bifaldes det, at manønsker at fremme den sundhedsvidenskabeligeforskning i Europa . Men komiteen finder dog, at derer visse betænkeligheder forbundet med forslaget .Medlemslandenes vedtagelse af forordningsforslagetvil betyde, at det nuværende godkendelsessystemskal nytænkes i Danmark – et medlem foreslår, atman evt . i Danmark laver et godkendelsessystem i tospor; et internationalt spor og et nationalt spor . Debeskrevne godkendelsesprocedurer vil være uforene-lig med det nuværende system/nuværende organise-ring og vil i høj grad lægge op til centralisering for atkunne opfylde tidsfristerne for den behandling, der idag dels foregår hos Sundhedsstyrelsen og dels i devidenskabsetiske komiteer . Dette er efter komiteensmening meget betænkeligt – og synes at være ikkeblot en afbureaukratisering, men også en afdemokra-tisering .Komiteen finder det ligeledes betænkeligt, at mulig-hederne for ”opt-out” er meget begrænsede samt atet land stiltiende godkender et projekt, hvis det ikkenår at gøre indsigelser grundet den meget korte frist,hvori der fremadrettet også skal høres minimum énpatient .Lægemiddelforsøg er ofte komplekse forsøg og dettesynes at være svært foreneligt med en meget korttidsfrist til sagsbehandlingen .
RVK SjællandHøring om Bekendtgørelse om ændring afbekendtgørelse om undtagelse fra pligten tilanmeldelse af visse behandlinger, som foretagesfor en privat dataansvarligPå vegne af Den Regionale Videnskabsetiske Komitéfor Region Sjælland skal der hermed takkes for mulig-heden for at kommentere ovennævnte udkast tilbekendtgørelse og afgives følgende bemærkninger:Udkastet skal ses på baggrund af, at det er lykkedesat harmonisere reglerne for anmeldelse, idet al for-skerinitieret anmeldelsespligtig sundhedsforskning,der foretages i regi af en region, skal anmeldes somoffentlig forskning .Det er særligt på denne baggrund vanskeligt at segevinsten ved de foreslåede § 2, stk . 3, nr . 3 og 5,der indebærer en svækkelse af kontrollen medprivate registre samt:• Uklarhed om hvilke forsøg der skal anmeldes tilDatatilsynet, og hvilke forsøg der ikke skal det:Et eksempel er et ph .d .-forløb der foregår i en privatvirksomhed med vejledere fra et universitet og meden arbejdsplads på både universitet og i den privatevirksomhed .• Et inkonsekvent regelsæt når kandidat-studerendeikke skal anmelde et register (jf . nr . 5), mens ph .d .-studerende omvendt må antages at skulle gøre det,da de ikke er nævnt i nr . 5 .• Et incitament for forskere i den offentlige sektor tilat forsøge at klassificere ellers anmeldelsespligtigeregistre i den offentlige sektor som private registre .
Årsberetning 2012
52
HøR I NGER
For en god ordens skyld skal det nævnes, at devidenskabsetiske komiteer hverken har kompetenceeller ressourcer til at påse overholdelsen af person-dataloven .Høringssvar fra RVK Sjælland til Justitsministerietom forslag til generel forordning om data·beskyttelsetak for lejligheden for sekretariatet for Den RegionaleVidenskabsetiske Komité for Region Sjælland til atkommentere forslaget til generel forordning om data-beskyttelse .En forordning gældende for hele EU vil overordnetvære en hensigtsmæssig foranstaltning, da det er for-nuftigt at sikre beskyttelse af borgernes personoplys-ninger på et ensartet niveau i hele EU . Dette vil ogsåsmidiggøre håndtering af videregivelse af personop-lysninger til sundhedsinstanser i de øvrige EU-lande .Dette bliver stadig mere relevant for den sundhedsvi-denskabelige forskning, idet prøver fra forsøg der gen-nemføres parallelt i flere lande ofte samles med hen-blik på analyse på ét enkelt laboratorium for atreducere usikkerheden ved analyserne .Forslaget er dog foreløbig formuleret i meget gene-relle termer så det er vanskeligt at vurdere konse-kvenserne af gennemførelse af forslaget for datasik-kerhed, arbejdsgange og økonomi i forbindelse medarbejde med databeskyttelse . Sådanne vurderingerforudsætter en konkretisering/uddybning af definitio-ner og krav på bl .a . følgende områder:• Passende tekniske og organisatoriske kontroller• Vigtige samfundsinteresserSekretariatet for RVK Sjælland har i øvrigt følgendemere specifikke kommentarer og spørgsmål:Forslaget til forordning indebærer, at der fremover for-ventes pålagt drakoniske sanktioner fra administrativtniveau (tilsynsmyndigheden) for at opnå en special-og generalpræventiv effekt – også i tilfælde af uagt-som overtrædelse af forordningens bestemmelser .Det er væsentligt, om der vil foreligge en ankemulig-hed . Dette understreges af, at de nævnte bødestør-relser reelt kan have en prohibitiv effekt for gennem-førelse af sundhedsvidenskabelige forsøg, somkomitésystemet på én gang skal føre kontrol medog fremme .
I de indledende betragtninger i kommentar 26 påside 22-23 nævnes medicinsk udstyr og in vitro-diag-nostik . I den eksisterende danske lovgivning er medi-coteknisk udstyr specifikt undtaget fra kravene omlogning og adgangskontrol m .v . Det er væsentligt, omdenne undtagelse vil bortfalde med den kommendeforordning, og i givet fald har det stor økonomisk be-tydning, om undtagelsen bortfalder for fremtidigt ind-købt udstyr eller også gælder for den eksisterendeapparaturpark .I afsnit 2 .5 i Justitsministeriets grund- og nærheds-notatet afsnit 2 .5 angives det bl .a . at: ”Som ennyskabelse stiller forslaget også krav om, at den regi-steransvarlige og registerføreren skal opbevare doku-mentation for enhver behandling af personoplysnin-ger, de gennemfører” [notatets side 8, 2 . afsnit] .Det er væsentligt, om der her henvises til udkastetsartikel 28 eller til anden form for dokumentation, bl .a .fordi kravene i artikel 28 forekommer væsentlig merebegrænsede end i notatet: Notatet giver indtryk af,at man skal dokumentere de enkelte analyser, somgennemføres af data, mens det i artikel 28 opregnes,at man skal dokumentere bl .a . formålene med data-behandlingen og kategorierne af data – en dokumen-tationsbyrde der er væsentlig mindre omfattende endnotatet giver indtryk af . Såfremt man skal dokumen-tere de enkelte analyser, vil det indebære en megetomfattende arbejdsopgave i forbindelse med isærregisterforskning, men også andre studier, hvor for-skerne har behov for at teste mange forskellige kom-binationer af data og analyseteknikker for at kunneudvikle ny viden .
Den nationale komités høringssvarDNVK har i 2012 afgivet 27 høringssvar . I en del afhøringer havde DNVK ikke bemærkninger .DNVK afgav to omfattende høringssvar vedr . to nyeforordningsudkast fremsat af Europa-Parlamentet ogRådet vedr . Revision af direktiv om kliniske læge-middelforsøg og Forslag til forordning om genereldatabeskyttelse . Høringssvarene er omtalt i afsnittetom Udviklingstendenser, samarbejde og koordinering .På næste side er kort gengivet DNVKs øvrige hørings-svar af videnskabsetisk relevans .
53
H øR I NGE R
Høringssvar vedr . udkast til bekendtgørelse omændring af bekendtgørelse om undtagelse frapligten til anmeldelse af visse behandlinger, somforetages for en privat dataansvarligVed bekendtgørelsen undtages visse forsknings-projekter, der udgår fra private (dataansvarlige) fraanmeldelsespligten til Datatilsynet . Persondatalovenskal dog fortsat følges i projekterne .DNVK forudsatte, at det fortsat vil være Datatilsynet,der fører kontrol med behandling af følsomme per-sonoplysninger i sundhedsvidenskabelige forsknings-projekter, og at forslaget ikke indebar nye opgaver forkomitésystemet . DNVK tilkendegav, at hvis de viden-skabsetiske komiteer i forbindelse med den viden-skabsetiske kontrol støder på forhold, der tyder påovertrædelse af persondataloven, vil komiteerneorientere Datatilsynet herom .Det fremgik af forslaget, at behandlinger af personop-lysninger i forbindelse med sundhedsvidenskabeligeforskningsprojekter omfattet af lov om videnskabs-etisk behandling af sundhedsvidenskabelige forsk-ningsprojekter er undtaget, men samtidig omfatterforslaget kun private dataansvarlige . DVNK mente,at det var uklart, om forskere, der gennemfører etsundhedsvidenskabeligt forskningsprojekt som led iansættelse på et regionalt sygehus, som ikke sker isamarbejde med fx en privat sponsor, er omfattet afundtagelsen fra anmeldelse, og bad om en præcise-ring heraf .Endelig gjorde DNVK opmærksom på, at projekter,der ikke betragtes som sundhedsvidenskabeligeforskningsprojekter, og som dermed falder uden forkomitésystemets kompetenceområde (evt . efter enkonkret vurdering – sager i ”gråzonen”), fortsat vilvære anmeldelsespligtige til Datatilsynet, hvorfor detbør sikres, at forskerne er tilstrækkeligt informeretherom .Høringssvar vedr . forslag til lov om ændring aflov om klage· og erstatningsadgang inden forsundhedsvæsenetDen tidligere Centrale Videnskabsetiske Komité (CVK)har ved afgivelse af problemnotat af 10 . september2009 til Udvalget for revision af komitéloven gjortudvalget og Ministeriet for Sundhed og Forebyggelseopmærksom på, at forsøgsdeltagere, der deltager iÅrsberetning 2012
forsøg, der ikke er omfattet af dækningen i patientfor-sikringsordningen, ikke er lige så godt dækket, somdeltagere omfattet af ordningen . CVK pegede derforpå, at sådanne deltagere bør omfattes af patientfor-sikringsordningen .Da der ifølge lovforslaget og en gældende bekendt-gørelse fortsat er et område for privat forskning, derikke er omfattet af patientforsikringsordningen, fx hvisforskningen alene gennemføres på en privat klinikefter kontrakt med en sponsor, gjorde DNVK på nyopmærksom på problemstillingen .Høringssvar vedr . kortlægning af behovet forplacebo i kliniske lægemiddelforsøgHøringen er udsendt på baggrund af et rejst spørgs-mål om, hvorvidt det bør gøres lovpligtigt for læge-middelvirksomheder at udlevere ”ægte” placebo afderes produkter til uvildig forskning .DNVK bemærkede, at komiteen ikke har stiftet be-kendtskab med ovenstående problemstillinger i for-bindelse med behandling af sundhedsvidenskabeligeforsøg .DNVK mente, at det bør være muligt at gennemføreplacebokontrollerede undersøgelser – om nødvendigtved at sikre, at den forsøgsansvarlige, mod betaling,kan få adgang til placebomedicin, der udseendemæs-sigt er identisk med originalproduktet .Høringssvar vedr . revideret udkast til bekendtgø·relse om information og samtykke til deltagelse isundhedsvidenskabelige forskningsprojekter samtom anmeldelse af og tilsyn med sundhedsviden·skabelige forskningsprojekterDNVK foreslog, at ”omfattende” indgår i afgrænsnin-gen af, hvilke sager om kortlægning af individetsarvemasse, der betragtes som komplekse forsknings-områder, og som skal anmeldes til DNVK efter be-kendtgørelsens § 2, nr . 4, idet DNVK bemærkede, atder sker meget sundhedsvidenskabelig forskning, derindebærer kortlægning af det menneskelige individsarvemasse på specifikke områder .
54
HøR I NGER
DNVK mente desuden, at omfattende kortlægning afdet menneskelige individs arvemasse generelt inde-holder så mange væsentlige etiske problemstillinger,at det vil være hensigtsmæssigt, at også forskning ianonymt eller fuldstændigt anonymiseret materiale idenne kategori anmeldes efter bekendtgørelsens § 2,nr . 4, på trods af, at fuldstændigt anonym eller anony-miseret menneskeligt biologisk materiale ikke skal an-meldes til komitésystemet, såfremt materialet er lov-ligt indsamlet ifølge loven på indsamlingsstedet, jf .komitélovens § 14, stk . 3 .DNVK forslog desuden, at der indsættes en over-gangsbestemmelse for anvendelse af bekendtgørel-sens §§ 12 og 13 om delegation af adgangen til atattestere samtykkeerklæringerne .Ved § 13, stk . 2, er tiltænkt en lempelse af reglernefor den forsøgsansvarlige, der kan delegere ikke kunadgangen til at afgive information og modtage etsamtykke fra forsøgspersonerne, men også til at atte-stere, at information er givet . Da der er tale om enlempelse for forsker, vil det være hensigtsmæssigt, atmuligheden for at delegere attestationspligten ogsåkan anvendes i allerede igangsatte projekter, fx såle-des at forsker i forbindelse med anmeldelse af en til-lægsprotokol efter bekendtgørelsens ikrafttræden kananmelde ændringer i attestationsproceduren vedr . etprojekt, der er anmeldt før bekendtgørelsens ikraft-træden .
Høring over udkast til forslag til ændring afkomitélovenVed ændringsforslaget blev det i komitéloven slåetfast, at en tilbagekaldelse af et samtykke i et sund-hedsvidenskabeligt forskningsprojekt som udgangs-punkt kun vil have virkning fremover, sådan at oplys-ninger, der allerede indgår i forskningsprojektet,fortsat vil kunne være en del af forskningsresultatetog behandles i overensstemmelse hermed .DNVK kunne tilslutte sig forslaget og fandt det hen-sigtsmæssigt, at der samtidigt skabes klarhed over, atforsøgspersonen altid vil have mulighed for at gøreindsigelse over for den dataansvarlige med den vide-re behandling af oplysningerne (efter persondatalo-vens § 35) .DNVK pegede på, at der kan være behov for en nær-mere definition af, hvornår der er tale om en aktiv til-bagekaldelse af et samtykke, da dette også har betyd-ning for forskers adgang til at følge patienten ipatientjournalen (jf . sundhedslovens § 46, stk . 1) .DNVK pegede på, at der ud fra et videnskabeligtsynspunkt kan være afgørende forskel mellem aktivtilbagekaldelse af samtykke og ophør af forsøgsmedi-cin, og der kan være faglige og videnskabelige grundetil fortsat at følge en patient fremadrettet, selv om pa-tienten er ophørt med at tage sin forsøgsmedicin .
55
English summarythe Danish committees on health research ethics areestablished by the regions and deal with all types ofprojects in the area of health research which involvehumans or human biological material . the commit-tees must ensure that notified projects are carried outin an ethically responsible manner so that trial sub-jects are protected while at the same time new know-ledge is created . the role of the National Committeeon Health Research Ethics is to coordinate work inthe regional committees and deal with complaintsas well as projects within especially complex fieldsof research .In the past each committee published an annualreport . In the future an annual report covering thewhole committee system will be published in orderprovide for overall coherence and transparency .the new Committee Act has introduced the followingamendments:• A strengthened national committee has beenestablishedwith an extended range of tasks andpowers, 13 members and reduced regional repre-sentation . the national committee must reinforcecoordination of the committee system, e .g . throughissuing more guidelines as well as binding instruc-tions .• The chairmen of the regional committees mustbe elected from the group of committee mem·bers who are active researchers .• The concept ”biomedical” has been replaced by”health research”with a view to modernizing theact .• Research into anonymous biological materialneed no longer be notifiedif the material inquestion has been gathered in accordance withnational legislation .• The national committee must process caseswithin especially complex fields:• Research undertaken in acute situations• Research into biological material that has beenremoved in connection with forensic autopsies• Research concerning pharmaceuticals for advan-ced therapy• Research involving extensive individual genomemapping (genome sequencing)• Research concerning psychosurgery• Targeted and progressive follow·up and controlbased on an overall assessment of researchprojects .Already in connection with approval of agiven project an overall assessment of the projectmust be undertaken and the extent of control mustbe decided against this background . Control taskswill lie with the regional committee that has appro-ved the project in question or which would becompetent to do so if the case did not concern anespecially complex area or for other reasons hadbeen put before the national committee . In orderto secure standardization of follow-up and controlthe national committee is required to establishguidelines covering this area .• In connection with control, the committeesystem now has access to patient records .Without obtaining a court order representativesfrom the committee system will now be able tocarry out control in business premises and hospitalsetc . the act provides that a research project maybe discontinued or injunctions may be issued . thenew provisions may be enforced through penalties .• Easing of terms regarding access to researchin acute situationsto the benefit of the involvedgroup of patients in projects that do not concernpharmaceuticals . this provision implements an ad-ditional protocol to the Council of Europe Conven-tion on Bioethics .• Majority decisions in the regional committees .Decisions must be taken by a qualified majority anda qualified minority is protected through access toputting cases before the national committee . More-over the chairmanship of a regional committee maynow decide in uncomplicated and routine cases .• Possibility of undertaking research into materialobtained from forensic autopsies .the report gives an overview of key figures in thearea, i .e . the number of projects notified, additionalprotocols, processing time etc . within the committeesystem . the number of notified projects is growing .there is a stagnation, however, in the number ofpharmaceutical trials, which account for one fifth ofthe overall number of projects . there is a drop in thenumber of pharmaceutical research projects initiatedby industry and an increase in the number of pharma-ceutical projects initiated by researchers . the numberof additional protocols has been going up in recentyears .
Årsberetning 2012
56
ENGL I S H S U M MAR y
the report also provides an insight into the researchethical issues that the committees handle . An impor-tant area is for instance the obtaining of informedconsent which was also on the agenda at the annualmeeting of the committees . Among other areastouched upon are bio banks, derogation from ruleson consent from trial subjects, research involvingextensive individual genome mapping (genomesequencing), involvement of children in researchas well as telemedicine . the annual meeting of theresearch ethics committees is mentioned . ProfessorErik Simonsen, PhD, dr .h .c ., senior consultant andchief researcher at Psychiatric Research Unit, RegionZealand was awarded the annual prize of honour .Generally follow-up control of projects by the com-mittees does not indicate any serious issues from asafety point of view . there is a need to highlight thatthe responsible researcher must submit a final reportand apply for prolongation when the project periodcomes to an end, consent forms must be filled in inaccordance with the rules and information for partici-pants must be updated .
Among the trends worth mentioning are regional ini-tiatives taken to increase the number of clinical trialsinvolving pharmaceuticals . this is done through pro-moting cooperation with industry . Based on practicalexperience guidelines have been established for theprocessing of trials that involve extensive mapping ofthe human genome . At European level a Regulationis being negotiated on notification of clinical trialsinvolving pharmaceuticals as well as a Regulation onthe processing of personal data .the committee system gathers inspiration fordevelopment of the area though participation inEuropean and Nordic fora and organisations . Ingeneral terms it is clear that ethical problems withinhealth research are fairly similar across nationalboundaries .
57
Den Videnskabsetiske Komitéfor Region NordjyllandNiels Bohrs Vej 309220 Aalborg østwww .vek .rn .dkDe Videnskabsetiske Komiteerfor Region MidtjyllandSundhedssekretariatetSkottenborg 26, 8800 Viborgwww .komite .rm .dk
Den Videnskabsetiske Komitéfor Region SyddanmarkDamhaven 127100 Vejlewww .regionsyddanmark .dk/komiteDen Videnskabsetiske Komitéfor Region SjællandAlléen 15, 4180 Sorøwww .regionsjaelland .dk/videnskabsetisk-komite
De Videnskabsetiske Komiteerfor Region HovedstadenKongens Vænge 23400 Hillerødwww .regionh .dk/vekDen Nationale Videnskabsetiske KomitéMinisteriet for Sundhed og ForebyggelseHolbergsgade 61057 København Kwww .dnvk .dk