Sundheds- og Forebyggelsesudvalget 2011-12
SUU Alm.del Bilag 63
Offentligt
Oversigtsnotat vedrørende SSRI20. september 2011 (opdateret 21.september og 21. oktober 2011).
Indhold2. Generelt om lægemidlers sikkerhed. .................................................................... 43. Behandling af gravide med depression ................................................................ 83.1 Risiko ved ikke at behandle depression hos gravide ...................................... 84. Forbrug af SSRI generelt og til gravide kvinder i Danmark ................................ 94.1 Forbrug af SSRI generelt................................................................................ 94.2 Gravides brug af SSRI og andre antidepressive lægemidler mod depression............................................................................................................................ 105. Produktinformation om bivirkninger ved brug af SSRI under graviditet ogamning .................................................................................................................... 115.1 Generelt om produktinformation og bivirkninger ........................................ 115.2 Graviditet ...................................................................................................... 125.3 Amning ......................................................................................................... 136. Videnskabelig dokumentation vedrørende brug af SSRI under graviditeten ..... 136.1 Hjertemisdannelser ....................................................................................... 146.2 SSRI behandling og øget tryk i lungekredsløbet hos nyfødte ...................... 196.3 Nyeste internationale konklusioner om SSRI og graviditet ......................... 196.4 Nye diskussioner af mulige risici ved SSRI i forbindelse med graviditet.... 207. SSRI og indberettede formodede bivirkninger ................................................... 217.1 Indberettede formodede bivirkninger generelt ............................................. 217.2 Indberettede formodede bivirkninger hos fostre og spædbørn efter moderensbrug af SSRI ....................................................................................................... 227.3 Samlet vurdering af de indberettede bivirkninger ........................................ 258. SSRI til børn og unge ......................................................................................... 278.1 Godkendelse og produktinformation om anvendelse til børn ...................... 278.2 Hvem udskriver recepterne til børn? ............................................................ 288.3 Hvilke præparater vælges til børn? .............................................................. 298.4 Nye tiltag i forhold til behandling af børn .................................................... 299. Effekten af SSRI ved behandling af depression ................................................. 3010. Andre nyligt diskuterede sikkerhedsaspekter af SSRI behandling................... 3210.1 Selvmordsrelateret adfærd .......................................................................... 3210.2 Risiko for knoglebrud ................................................................................. 3211. Information om SSRI og risiko for bivirkninger .............................................. 3311.1 Information i indlægssedler og produktresumeer ....................................... 3311.2 Information om SSRI på promedicin.dk og minmedicin.dk ...................... 3311.3 Information og advarsler om SSRI ved graviditet...................................... 3313. Konklusion ....................................................................................................... 35Bilag 1 ................................................................................................................ 39Bilag 2 ................................................................................................................ 41Bilag 3 ................................................................................................................ 44
Side 2
1. Indledning og resuméSelektive serotoningenoptagshæmmere (SSRI) er godkendt til behandling af mo-derate og svære depressioner samt visse angstlidelser.Der findes seks markedsførte lægemiddelstoffer (aktive stoffer) inden for klassenaf SSRI i Danmark. Det er citalopram, escitalopram, sertralin, fluoxetin, paroxetinog fluvoxamin.Lægemidlerne virker ved at øge funktionen af signalstoffet serotonin i hjernen.Dette opnås ved at hæmme genoptagelsen af stoffet fra nerveenderne. Der er gene-relt gode erfaringer med behandling med SSRI, der anses for at have færre gene-rende bivirkninger end ældre antidepressiva.I dette notat er der primært fokus på sikkerheden ved SSRI og risikoen for bivirk-ninger for fostre og nyfødte ved moderens brug af SSRI.Forbruget af SSRI er steget betydeligt de senere år – også hos gravide. I 2010 varknap 1.900 gravide kvinder i behandling med SSRI. Hvis SSRI anvendes til gravi-de, skal det ske efter lægens nøje afvejning af fordele og ulemper for moderen ogbarnet. Produktinformationen for samtlige SSRI-præparater indeholder advarsler irelation til anvendelse under graviditet og amning. Selvom ordlyden er forskellig,er det grundlæggende budskab, at disse lægemidler kun bør anvendes, hvis forde-lene for den gravide (og det ufødte eller diende barn) opvejer de potentielle utilsig-tede virkninger.Ifølge Sundhedsstyrelsens vejledning1bør mulighed for psykoterapeutisk behand-ling altid overvejes ved behandling af depression hos gravide. Medicinsk antide-pressiv behandling kan i nogle tilfælde være nødvendig og berettiget. Det kan foreksempel være ved en alvorlig depression eller ved stor risiko for tilbagefald afdepression, hvis en allerede iværksat medicinsk behandling ophører. I disse tilfæl-de bør behandlingen ifølge Sundhedsstyrelsens vejledning ske i samråd med enspeciallæge i psykiatri. Der skal foretages en konkret afvejning af behandlingensmulige gavnlige effekt og skadelige virkninger set i forhold til den risiko, som enutilstrækkeligt behandlet depression medfører for kvinden og det ufødte barn.En ubehandlet depression hos en gravid kan være farlig for den gravide og foste-ret. Depression kan være forbundet med øget alkoholindtagelse, øget tobaksfor-brug, usund kost og anden usund levevis. Disse faktorer kan være skadelige bådefor den gravide og fostret. Ubehandlet depression hos gravide har været sat i for-bindelse med øget risiko for abnorm blødning under graviditeten, spontan abort,for tidlig fødsel, fosterdød, svangerskabsforgiftning, andre fødselskomplikationersamt trivselsforstyrrelser hos barnet efter fødslen. Dårlig kontakt og pasning afbarnet efter fødslen er også faremomenter ved en ubehandlet depression hos ny-bagte mødre.Gravides brug af SSRI kan medføre alvorlige bivirkninger hos fostret og nyfødte.Der er risiko for misdannelser, herunder misdannelser i hjertekarsystemet, forhøjet
Side 3
tryk i lungekredsløbet og abstinenssymptomer hos barnet. I alle tre situationer erder tale om tilstande, der kan føre til dødsfald. Bivirkninger hos den gravide kanforekomme på linje med bivirkninger hos ikke gravide.Risikoen for bivirkninger hos den nyfødte i form af abstinenssymptomer har væretkendt siden 1990`erne. I de fleste tilfælde er abstinenssymptomerne ikke alvorlige.Men i nogle tilfælde opstår der alvorlige bivirkninger som kramper og åndedræts-besvær. De aktive indholdsstoffer udskilles i modermælken, og der er derfor risikofor, at der kan opstå bivirkninger hos det diende barn.Erfaringsgrundlaget vedrørende risiko for misdannelser for de forskellige typer afSSRI-præparater varierer. Risikoen for misdannelser i hjertekarsystemet blev før-ste gang beskrevet i litteraturen i 2005 for paroxetin og fra 2008 og frem for fluo-xetin. Erfaringerne er baseret på epidemiologiske undersøgelser (registerstudier).Der gennemføres af etiske årsager ikke kliniske forsøg med gravide. Undersøgelseaf sikkerhedsspørgsmål i forhold til denne gruppe gennemføres i stedet for somepidemiologiske undersøgelser efter markedsføring af præparaterne.Epidemiologiske undersøgelser har vist en let øget risiko for misdannelser i hjerte-karsystemet hos nyfødte, hvis mødre har taget paroxetin eller fluoxetin i starten afgraviditeten.Studierne viser, at ca. 2 ud af 100 nyfødte har sådanne misdannelser. Det skalsammenholdes med, at forekomsten af misdannelser i hjertekarsystemet blandt allenyfødte er ca. 1 ud af 100. Risikoen for hjertemisdannelser blev som nævnt kendtfor paroxetin i 2005, og oplysninger herom blev efterfølgende tilføjet i produktre-sumeerne efter anbefaling fra EU`s Bivirkningskomité. I 2010 blev det besluttet attilføje lignende oplysninger i produktresumeerne for fluoxetin. Det skete også efteranbefaling fra EU`s bivirkningskomité, der samme år havde foretaget en størregennemgang af resultaterne af en række epidemiologiske studier om anvendelse afantidepressiv medicin.Det kan ikke udelukkes, at gravides brug af andre typer SSRI kan medføre mis-dannelser, men der foreligger ikke tilstrækkelig dokumentation, der kan be- ellerafkræfte dette.Lægemiddelstyrelsen har iværksat et registerstudie med henblik på at undersøge,om andre SSRI end paroxetin og fluoxetin kan medføre misdannelser.En mulig risiko for forhøjet tryk i lungekredsløbet hos nyfødte børn af mødre, derhar været i behandling med SSRI-præparater under graviditeten, blev første gangbeskrevet i litteraturen i 2006, men evidensen for årsagssammenhæng var på da-værende tidspunkt meget sparsom. På grundlag af resultaterne af nye epidemiolo-giske studier, som i 2010 blev vurderet af EU`s bivirkningskomité, konkluderedeLægemiddelstyrelsen og lægemiddelmyndighederne i de andre EU-lande sammeår, at gravides brug af SSRI-præparater medfører en øget risiko for forhøjet tryk i
Side 4
lungekredsløbet hos nyfødte. Som følge af disse konklusioner blev det besluttet, atalle produktresumeer for SSRI skulle opdateres med oplysninger om denne risiko.Risikoen for forhøjet tryk i lungekredsløbet hos nyfødte, der har været eksponeretfor SSRI under graviditeten, anslås at være ca. 5 tilfælde pr. 1000 fødsler. Det skalsammenholdes med, at risikoen for forhøjet tryk i lungekredsløbet for alle nyfødtebørn er 1-2 tilfælde pr. 1000 fødsler.Siden de første SSRI-præparater blev markedsført i slutningen af 1980’erne ogfrem til medio juni 2011, har Lægemiddelstyrelsen modtaget 74 danske indberet-ninger om formodede bivirkninger hos børn eller fostre som følge af moderensbrug af SSRI. Fire af indberetningerne omhandler dødsfald hos spædbørn. Der erindberettet 14 tilfælde af fosterdød og abort. Endelig er der modtaget indberetnin-ger om 56 formodede alvorlige, men ikke dødelige, bivirkninger hos nyfødte. De74 indberetninger indeholder i alt 137 formodede bivirkninger, der er nærmerebeskrevet i afsnit 7 og bilag 2.En indberetning om en formodet bivirkning er ikke ensbetydende med, at der erpåvist en årsagssammenhæng mellem lægemidlet og den indtrådte skade.Produktresumeerne og indlægssedlerne indeholder information om kendte bivirk-ninger ved SSRI. Lægemiddelstyrelsen har iværksat et kontrolprojekt i forhold tilindlægssedlerne med henblik på at sikre, at de indeholder opdateret informationvedrørende risici for gravide, fostre og nyfødte. Enkelte markedsførte produktermangler oplysninger i indlægssedlen om risikoen for forhøjet tryk i lungekredslø-bet hos nyfødte, hvis moderen er blevet behandlet med SSRI. Tilsvarende manglerenkelte indlægssedler oplysninger om risiko for abstinenssymptomer hos det ny-fødte barn. Lægemiddelstyrelsen har rettet henvendelse til virksomhederne medhenblik på at sikre, at manglerne bliver afhjulpet.
2. Generelt om lægemidlers sikkerhed.Lægemidler skal godkendes af Lægemiddelstyrelsen eller Europa-Kommissionen, før de må bringes på markedet i Danmark.Det fremgår af lægemiddellovens § 7, at et lægemiddel kun må forhandles ellerudleveres her i landet, når der er udstedt en markedsføringstilladelse enten af Læ-gemiddelstyrelsen i medfør af denne lov eller af Europa-Kommissionen i medføraf EU-retlige regler om fastlæggelse af fællesskabsprocedurer for godkendelse ogovervågning af human- og veterinærmedicinske lægemidler m.v. (fællesskabsmar-kedsføringstilladelse), jf. dog §§ 11 og 29-32.Forudsætningen for, at et lægemiddel kan blive godkendt, er, at der er et gunstigtforhold mellem lægemidlets virkning og de risici, der er forbundet med at brugedet hos den gruppe patienter, som det har til formål at behandle.Det fremgår af lægemiddellovens § 8, at Lægemiddelstyrelsen efter ansøgningudsteder en markedsføringstilladelse, hvis forholdet mellem fordele og risici ved
Side 5
lægemidlet er gunstigt, og der i øvrigt ikke foreligger afslagsgrunde som nævnt i§§ 12 og 13.Afvejningen af fordele og risici ved lægemidlet er et helt centralt element i såvelgodkendelsen af nye lægemidler som overvågningen af de lægemidler, der er påmarkedet.Den, der ansøger om at få et lægemiddel godkendt, skal over for Lægemiddelsty-relsen dokumentere lægemidlets virkning, sikkerhed og kvalitet samt evt. miljøpå-virkning. Lægemiddelstyrelsen afvejer fordele over for risici med udgangspunkt idenne dokumentationDet fremgår af lægemiddellovens § 8, stk. 2, at:”Ved afvejning af forholdet mellem fordele og risici ved et lægemiddel vurdereslægemidlets positive terapeutiske virkninger i forhold til risici forbundet med læ-gemidlets kvalitet, sikkerhed og virkning og risici for uønsket påvirkning af miljø-et, jf. dog § 12, stk. 2.”Som led i godkendelsen af et lægemiddel godkender Lægemiddelstyrelsen også etproduktresumé (et resumé af lægemidlets egenskaber), der indeholder en rækkeoplysninger om lægemidlet, herunder den/de godkendte terapeutiske indikati-on(er), bivirkninger, dosering, advarsler, kontraindikationer og særlige forsigtig-hedsforanstaltninger).De nærmere krav til den dokumentation, virksomhederne skal tilvejebringe somled i ansøgningen om at få godkendt et lægemiddel, fremgår af bekendtgørelse nr.1239 af 12. december 2005 om markedsføringstilladelse til lægemidler m.m.
Dokumentation for lægemidlers sikkerhed og effekt er normalt baseret på re-sultater fra dyreforsøg og fra kliniske forsøg på mennesker. Disse gennemføresaf producenten forud for ansøgning til lægemiddelmyndighederne. Der kan dogogså være tale om generiske lægemidler, hvor ansøgeren ikke er forpligtet til atforelægge resultater af prækliniske og kliniske forsøg, hvis han kan godtgøre,at lægemidlet er en generisk udgave af et referencelægemiddel, der er eller harværet godkendt i mindst 8 år i Danmark eller et andet EU-/EØS-land.Dyreforsøgene har til formål at indhente viden om lægemidlets virkningsme-kanisme, omsætning i kroppen og ikke mindst mulige bivirkninger, herundervirkning på drægtige dyr, inden lægemidlet afprøves på mennesker.De kliniske forsøg på mennesker omfatter typisk 500-5.000 patienter afhængigtaf den pågældende sygdoms hyppighed, og forsøgene har som regel op til et årsvarighed. Patienterne er normalt nøje udvalgte, således at de har så veldefinereten sygdom som overhovedet muligt og ikke lider af konkurrerende sygdomme,der kan gøre det vanskeligt at vurdere effekten af forsøgslægemidlet.
Side 6
De fleste forsøg er såkaldte ”randomiserede forsøg” (lodtrækningsforsøg), hvordet er fuldstændigt tilfældigt, om patienten får behandling med forsøgslæge-midlet, et andet lægemiddel eller placebo (inaktiv behandling). Disse forsøggennemføres så vidt muligt også blindet, således at hverken patienten eller læ-gen ved, hvilken behandling patienten får. Herved tilstræbes det, at vurderin-gen af det nye lægemiddel (forsøgslægemidlet) bliver så objektiv som muligt.Nye lægemidler bliver af etiske årsager ikke undersøgt på gravide eller am-mende kvinder, og kvinder i den fertile alder indgår enten ikke i forsøget ellerkun, hvis de anvender mindst én sikker form for antikonception.Børn indgår af etiske årsager sjældent i de første forsøg med nye lægemidler,med mindre der er tale om forsøg vedrørende behandling af en sygdom, somkun findes eller helt overvejende findes hos børn. Kliniske forsøg med børnbliver normalt først gennemført efter, at man har lavet initiale forsøg medvoksne, og derved har fået en bedre viden om lægemidlets fordele og ulemper(bivirkninger).På tidspunktet for markedsføringen af et nyt lægemiddel har man derfor somudgangspunkt kun begrænset viden om lægemidlets virkninger hos gravide,ammende og børn. Dog har man kendskab til lægemidlets virkning under gra-viditeten hos mindst to forskellige dyrearter og ofte også kendskab til, om læ-gemidlet udskilles i dyrenes modermælk. På den baggrund vil produktinforma-tionen om nye lægemidler normalt indeholde en generel advarsel mod at brugeprodukterne til gravide og ammende. Produktresumeet vil være suppleret medoplysninger om effekten på drægtige forsøgsdyr.En systematisk indsamling af oplysninger om forløbet af graviditeter hos kvin-der, som er blevet behandlet med et lægemiddel, fx fordi der har været tvin-gende grunde til at anvende lægemidlet eller pga. manglende viden om, atkvinden var gravid, er vigtig i forhold til overvågningen af lægemidlets sikker-hed og vurdering af behov for ajourføring produktinformationen. Disse oplys-ninger kan indgå i epidemiologiske undersøgelser og være med til at sikre nyviden om lægemidlet.Den bedste mulighed for at skaffe mere viden om lægemidlernes sikkerhed iforhold til gravide, er en systematisk indsamling og overvågning af de bivirk-ninger, som optræder ved anvendelse efter markedsføringen. Dette kan være iform af registerstudier og vurdering af indberetninger om bivirkninger. Dergælder en skærpet indberetningspligt for alle nye lægemidler i de første to årefter markedsføring. Den skærpede indberetningspligt indebærer, at læger ogtandlæger skal indberette alle formodede bivirkninger ved et nyt lægemiddel idenne periode. Derefter skal lægerne indberette alle formodede alvorlige elleruventede bivirkninger, jf. § 4, stk. 3 i bekendtgørelse nr. 800 af 17. august 2009om indberetning af bivirkninger ved lægemidler m.m.
Side 7
Internationalt samarbejde er afgørende i denne sammenhæng, da dette samar-bejde giver adgang til at samle oplysninger om erfaringer fra så stort et antalbrugere af lægemidlet som muligt. Herved øges chancerne for, at man på ettidligere tidspunkt ved analyser af store mængder bivirkningsdata opdager sig-naler om sjældne bivirkninger, der måske ikke ville være blevet opdaget medbivirkningsdata fra mindre befolkningsgrupper som fx den danske før efterlængere tids brug. Ligeledes er det vigtigt at se på bivirkninger, der er indberet-tet om danske patienter, i forhold til de samlede internationale erfaringer. Derer normalt behov for et bredt erfaringsgrundlag og store mængder bivirknings-data, når man skal vurdere lægemidlers sikkerhed, herunder om der er nye ellerændrede risici.Indehaveren af markedsføringstilladelsen har også en forpligtelse til at overvå-ge sikkerheden ved sit lægemiddel og rapportere om bivirkninger til myndig-hederne.Indehaveren af en markedsføringstilladelse til et SSRI, der er godkendt af Læ-gemiddelstyrelsen, skal til styrelsen indberette alle formodede alvorlige bivirk-ninger set i Danmark, som virksomheden får oplysning om fra en sundhedsper-son, en patient eller en pårørende, eller som indehaveren af markedsføringstil-ladelsen med rimelighed må formodes at have kendskab til fra videnskabeliglitteratur eller sikkerhedsundersøgelser. Indberetning skal ske straks og underalle omstændigheder senest 15 dage efter modtagelsen af disse oplysninger.Indehaveren af markedsføringstilladelsen skal også til Lægemiddelstyrelsenindberette alle formodede alvorlige uventede bivirkninger set i et land uden forEU/EØS (tredjeland), som virksomheden får kendskab til fra en sundhedsper-son, en patient eller en pårørende. Indberetning skal ske straks og under alleomstændigheder senest 15 dage efter modtagelsen af oplysningerne.Hertil kommer, at indehaveren af markedsføringstilladelsen på nærmere fast-satte tidspunkter skal aflevere periodiske sikkerhedsopdateringer (PSUR) tilLægemiddelstyrelsen. En PSUR skal indeholde en fortegnelse over og gen-nemgang af alle formodede bivirkninger registreret i den aktuelle periode påverdensplan og en videnskabelig vurdering af fordele og ulemper ved lægemid-let i form af en evaluering af sikkerhedsdata for den aktuelle periode set i rela-tion til produktresumeet og en overordnet vurdering af lægemidlets sikker-hedsprofil. Rapporten skal også indeholde en konklusion med angivelse af sik-kerhedsdata, der ikke er i overensstemmelse med de hidtidige erfaringer, ogforslag til eventuelle nye sikkerhedsmæssige initiativer.Lægemiddelstyrelsen vurderer virksomhedens konklusioner og beslutter, omder skal iværksættes sikkerhedsmæssige initiativer. Denne kontrol kan fx føretil ændringer af informationen i produktresumeet og indlægssedlen.Ifølge lægemiddellovens § 14, stk. 1, kan Lægemiddelstyrelsen ændre, suspen-dere eller tilbagekalde en markedsføringstilladelse, hvis det viser, at forholdet
Side 8
mellem fordele og risici ikke er gunstigt. Vurderingen af, om en ændring afdette forhold skal have konsekvenser for markedsføringstilladelsen, foretagesstort set altid i et samarbejde mellem lægemiddelmyndighederne i EU-landeneog EMA samt eventuelt Kommissionen.Ovenstående gælder generelt for lægemidler, der er godkendt af Lægemiddel-styrelsen – og dermed også for SSRI. Vores viden om et lægemiddel vil af-hænge af, hvor længe det har været markedsført, og hvor mange personer, derhar været i behandling med lægemidlet gennem den tid.
3. Behandling af gravide med depression3.1 Risiko ved ikke at behandle depression hos gravideHistorisk set har man generelt ment, at graviditet, der af de fleste betragtes som enlykkelig omstændighed, beskyttede mod psykiatrisk sygdom. Sidstnævnte har dogikke kunnet underbygges.Derimod er det nu almindeligt anerkendt, at gravide har en større risiko for at fådepression end ikke-gravide. Omkring 10-15 % af alle gravide oplever en depres-sion under graviditeten. Risikoen for depression synes at være størst i de sidste totredjedele (2. og 3. trimester) af graviditeten2.Desuden har kvinder, som tidligere har haft en depression, en markant øget risikofor depression under en graviditet. Psykosociale og biologiske faktorer i forbindel-se med graviditeten spiller formentlig en rolle for depressionens opståen,menkliniskadskiller de depressive symptomer sig ikke væsentligt fra symptomernehos ikke-gravide.Kvinder har også en øget risiko for depression i barselsperioden efter fødslen (fød-selsdepression). En depression, der er indtrådt under graviditeten, kan fortsætteefter fødslen.Depression hos gravide udgør ikke kun en direkte risiko for kvinden, men også fordet ufødte barn. Ubehandlet depression hos gravide har været sat i forbindelse medøget risiko for abnorm blødning under graviditeten, spontan abort, for tidlig fødsel,fosterdød, svangerskabsforgiftning, andre fødselskomplikationer samt trivselsfor-styrrelser hos barnet efter fødslen. Sygdommen kan hos kvinden medføre dårligernæringstilstand, øget alkoholindtagelse, øget tobaksforbrug, anden usund leve-vis, selvmordsrelateret adfærd og regulære selvmordsforsøg3, 4, 5.Dette er faktorer, der i sig selv kan true fostrets normale udvikling. Men også ab-norme biologiske forhold (fx øget koncentration af binyrehormoner), som ses hosdepressive patienter, er under mistanke for at kunne skade fostret. En depression,der fortsætter efter fødslen, påvirker endvidere moderens evne til at passe sit barn.Det er vigtigt, at læger, jordmødre og andet sundhedspersonale er opmærksommepå eventuelle depressive symptomer hos gravide. Dette gælder særligt hos kvinder,
Side 9
der tidligere har haft depression. Ifølge Sundhedsstyrelsens vejledning6på områdetbør mulighederne for psykoterapeutisk behandling altid overvejes ved depressionhos gravide. Medicinsk antidepressiv behandling kan i nogle tilfælde være nød-vendig og berettiget. Det kan for eksempel være ved en alvorlig depression ellerved stor risiko for tilbagefald af depression, hvis en allerede iværksat medicinskbehandling ophører. Behandling bør ifølge Sundhedsstyrelsens vejledning ske isamråd med en speciallæge i psykiatri. Der skal foretages en konkret afvejning afbehandlingens mulige gavnlige effekt og skadelige virkninger set i forhold til denrisiko, som en utilstrækkeligt behandlet depression medfører for kvinden og detufødte barn.Behandling af gravide med antidepressiv medicin bør i øvrigt følge Sundhedssty-relsens vejledning på området.
4. Forbrug af SSRI generelt og til gravide kvinder iDanmarkI dette afsnit er der først givet en oversigt over det samlede forbrug af SSRI iDanmark for alle patientgrupper. Herefter er der foretaget en opgørelse af forbru-get for gravide.
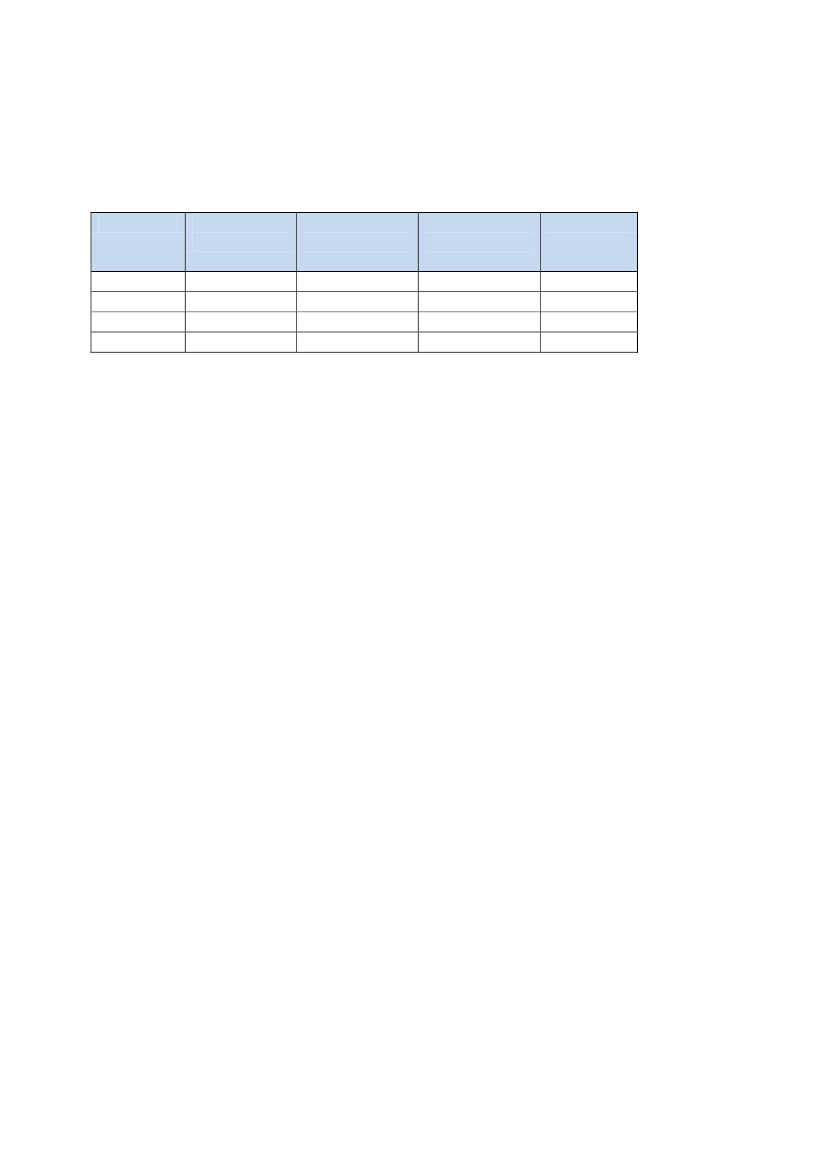
4.1 Forbrug af SSRI genereltForbruget af SSRI har siden medicinen blev introduceret i slutningen af1980’erne været stærkt stigende.Det første markedsførte SSRI i Danmark var Fevarin� med det aktive lægemid-delstof fluvoxamin. Det blev markedsført i 1987. De efterfølgende år blev flere afde andre lægemiddelstoffer markedsført, jf. tabel 1.Tabel 1.De første markedsførte præparater med deres aktive lægemiddelstof.Præparatnavne(M = markedsføringsår)Cipramil� (M:1989) m. fl.Cipralex� (M: 2002) m. fl.Fevarin� (M: 1987)Fontex� (M: 1988) m. fl.Seroxat� (M: 1993) m. fl.Zoloft� (M: 1994) m. fl.Aktive lægemiddelstofferCitalopramEscitalopramFluvoxaminFluoxetinParoxetinSertralin
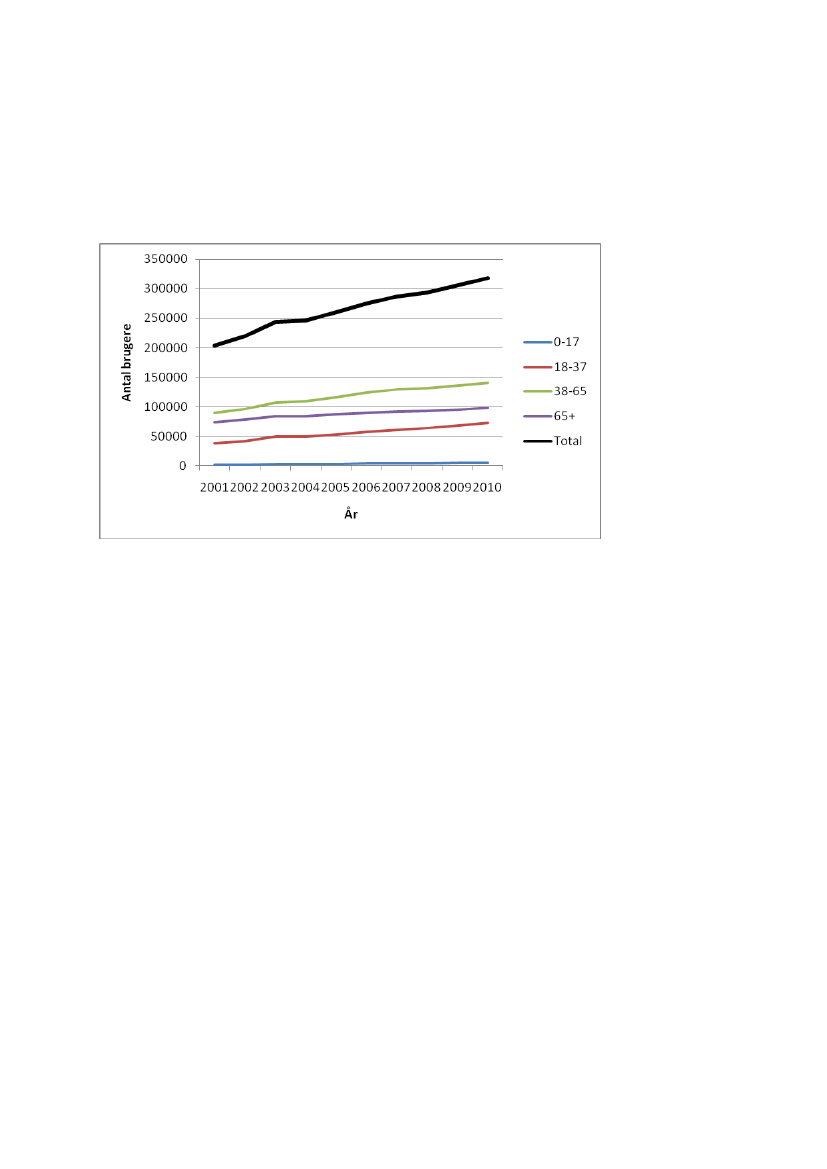
Siden 2001 er antallet af SSRI-brugere steget kraftigt fra ca. 200.000 til ca.320.000 i 2010, jf. figur 1. Der er tale om en stigning på ca. 56 %. Antallet af bru-gere er steget inden for alle aldersgrupper. Selvom børn og unge udgør den mind-ste andel, har stigningen været størst hos denne gruppe fra 1.731 brugere i 2001 til5.700 i 2010.
Side 10
Figur 1.Antal brugere, der har indløst mindst én recept på et SSRI lægemiddel, op-gjort per år for perioden 2001-2010
De seneste to år, fra 1. februar 2009 til 31. januar 2011, har 396.577 personerkøbt mindst ét SSRI præparat. Der er dobbelt så mange kvindelige som mand-lige brugere. Aldersfordelingen for de to køn er næsten den samme.Den aldersgruppe, hvor der er den største andel af SSRI-brugere, er kvinderover 65 år med 16,1 %.Forbruget hos børn og unge under 18 år udgør 0,8 % af alle piger og 0,4 % afalle drenge i Danmark.For unge kvinder i alderen 18-37 år har 9,2 % indløst mindst én recept på etSSRI-præparat.
4.2 Gravides brug af SSRI og andre antidepressive lægemidlermod depressionFor gruppen af gravide kvinder er forbruget af SSRI også steget. Antallet afgravide kvinder, der har købt SSRI og andre antidepressiva mindst én gang i løbetaf deres graviditet, fremgår af tabel 2 nedenfor.
Side 11
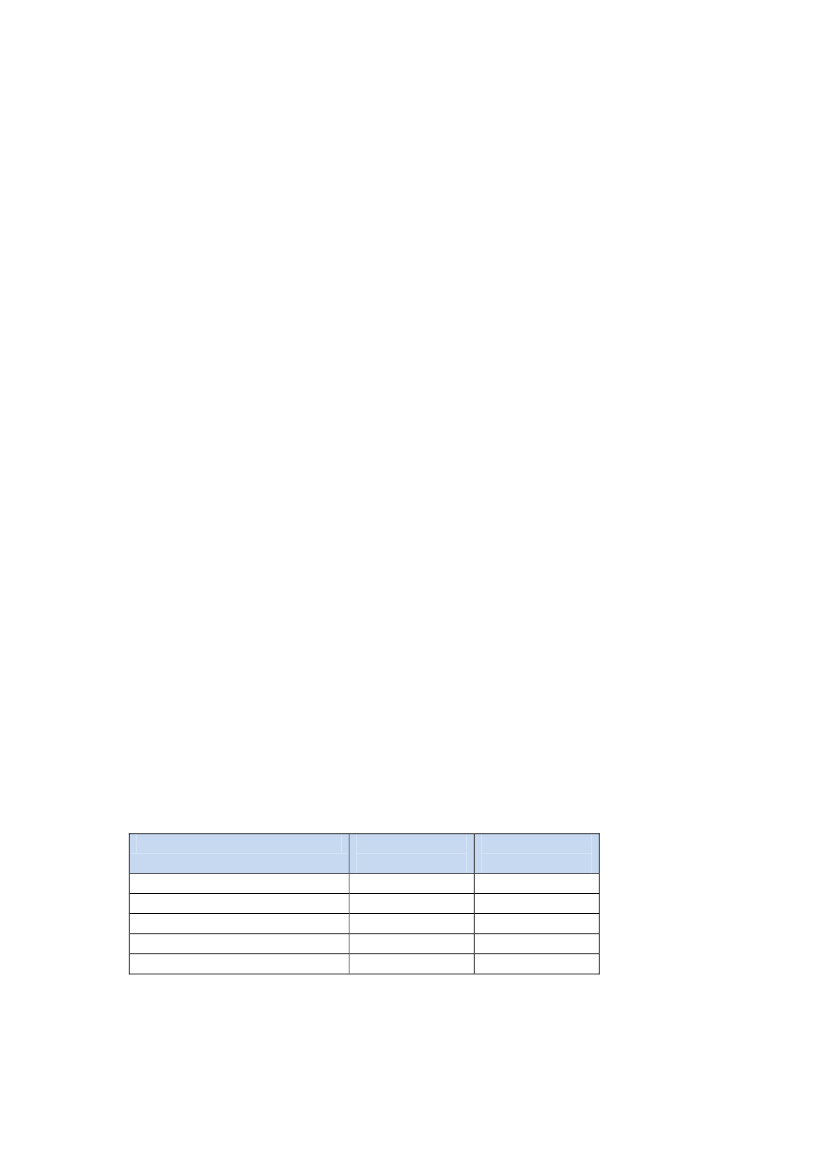
Tabel 2.Gravide kvinder, der har købt antidepressiva mindst én gang i løbet afderes svangerskabslængdeÅrKun SSRIAndre anti-Både SSRI ogTotaltpræparaterdepressiva endandre anti-SSRIdepressiva200713811991471727200815062241381868200916022891332024201018813801482409
Gravides brug af antidepressive lægemidler følger således samme generelt sti-gende tendens som i resten af befolkningen. Over de seneste 4 år er der sket enstigning i forbruget af SSRI hos gravide på ca. 36 %.Langt den største del af de gravide, der behandles med antidepressiva, behand-les med SSRI. I samme periode er der samtidig også set en stigning i forbrugetaf andre antidepressive lægemidler til samme patientgruppe på ca. 90 %. Detdrejer sig f.eks. om tricykliske antidepressiva (TCA), irreversible eller non-selektive monoaminooxidase (MAO) – hæmmere.Det totale forbrug af antidepressive lægemidler til gravide er steget med ca.39 % inden for de seneste 4 år.
5. Produktinformation om bivirkninger ved brug afSSRI under graviditet og amning5.1 Generelt om produktinformation og bivirkningerProduktinformationen omfatter det godkendte produktresume (Summary ofProduct Characteristics,SPC) og den tilhørende indlægsseddel (PackageLeaflet,PL).Produktresumeet godkendes sammen med lægemidlet på basis af den viden,der er fremlagt fra de kliniske og præ-kliniske studier af lægemidlet.Indehaveren af markedsføringstilladelsen er ansvarlig for udarbejdelse af indlægs-sedlen, og at denne indholdsmæssigt svarer til det godkendte produktresumé. Derhenvises til afsnit 11.1 nedenfor.
Som beskrevet i afsnit 2 indgår gravide kvinder af etiske årsager ikke i de kli-niske studier, og information i produktinformationen afhænger derfor i særliggrad af de erfaringer, der gøres fra bivirkningsindberetninger og epidemiologi-ske studier efter markedsføringen.Lægemiddelstyrelsen har foretaget en detaljeret gennemgang af alle produktre-sumeer for samtlige SSRI, som de ser ud per 20. juli 2011. I gennemgangen er
Side 12
der sondret mellem godkendte og markedsførte lægemidler, og de lægemidler,der er godkendte, men ikke er markedsførte. For sidstnævnte gruppe af læge-midler tillader Lægemiddelstyrelsen ikke markedsføring i Danmark, før even-tuelle mangler i produktresumé/indlægsseddel er afhjulpet, og produktinforma-tionen er bragt i overensstemmelse med de øvrige præparater med samme akti-ve indholdsstof.Ved gennemgang af produktinformationen har Lægemiddelstyrelsen konstate-ret, at flere produkters indlægssedler indeholder mangelfulde advarsler om gra-viditet, amning, anvendelse til børn og selvmordsrelateret adfærd. Enkeltemarkedsførte lægemidler mangler oplysninger i indlægssedlen om risikoen forforhøjet tryk i lungekredsløbet hos nyfødte, hvis mødre er blevet behandletmed SSRI. Tilsvarende mangler enkelte indlægssedler oplysninger om risikofor abstinenssymptomer hos det nyfødte barn. Lægemiddelstyrelsen har iværk-sat et kontrolprojekt med det formål at sikre, at producenterne bringer disseforhold vedrørende indlægssedlerne i orden.
5.2 GraviditetIngen af SSRI-produkterne anbefales uforbeholdent til behandling af depressi-on under graviditet. Produktinformationen for samtlige produkter indeholderadvarsler, som angiver, at disse lægemidler kun bør anvendes, hvis fordelenefor den gravide (og det ufødte barn) opvejer de potentielle utilsigtede virknin-ger (bivirkninger).Disse utilsigtede virkninger er herefter nærmere beskrevet og omhandler:•••risiko for hjertemisdannelser (kun for lægemidler indeholdende fluoxe-tin og paroxetin)risiko for vedvarende forhøjet blodtryk i lunge-kredsløbet hos det ny-fødtebarn (PersistentPulmonary Hypertension of the Newborn, PPHN)risiko for abstinenssymptomer hos det nyfødte barn, hvis SSRI er blevetgivet til moderen sent i graviditeten.
Som anført er det alene produkter indeholdende paroxetin (indført 2005) ogfluoxetin (indført juni 2010), der indeholder oplysninger om en øget risiko forhjertemisdannelser.For den øvrige medicin i gruppen af SSRI-præparater foreligger der ikke tilsva-rende entydige og valide resultater fra epidemiologiske studier vedrørende risi-koen for misdannelser. Det kan imidlertid ikke udelukkes, at de øvrige SSRI-præparater (sertralin, citalopram, escitalopram og fluvoxamin) også kan forår-sage hjertemisdannelser. Det er Lægemiddelstyrelsens vurdering, at den gene-relle advarsel om brugen under graviditeten er dækkende, indtil yderligere databliver tilgængelige. Der henvises i øvrigt til afsnit 6.
Side 13
For så vidt angår den konkrete vejledning til lægen i forhold til ordination afprodukterne til gravide er der en vis variation produkterne imellem som be-skrevet nedenfor.Lægemidler, der indeholder citalopram og escitalopram, frarådes generelt tilgravide pga. manglende erfaringer. For lægemidler, der indeholder paroxetin,er det anført, at produkterne kun bør anvendes på tvingende indikation, og lig-nende vejledning findes for lægemidler, der indeholder sertralin, idet der her eroplyst, at fordelene ved en evt. behandling skal veje tungere end eventuelleulemper. For fluvoxamin fremgår det af produktresumeet, at lægen skal udviseforsigtighed ved anvendelse hos gravide.For fluoxetin er produktresuméernes ordlyd lidt modstridende, idet de ovenforomtalte risici anføres efterfulgt af teksten: ”Fluoextin kan anvendes under gra-viditet, men det tilrådes at udvise forsigtighed sent i graviditeten…”. Det erLægemiddelstyrelsens vurdering at denne tekst kan misforstås som en anbefa-ling af fluoxetin-holdige lægemidler frem for andre SSRI, hvorfor Lægemid-delstyrelsen vil anmode EU’s bivirkningskomite vurdere, om teksten i alle pro-duktresumeer for lægemidler, der indeholder fluoxetin, bør revideres.
5.3 AmningSamtlige produktinformationer indeholder oplysning om, at lægemidlet kangenfindes i mindre mængder i modermælken.Enkelte produktinformationer indeholder endvidere oplysninger om konkretekoncentrationer af SSRI i modermælken, og om at en effekt (bivirkninger) hosdet diende barn er mindre sandsynlig. Efterfølgende tages på forskellig vis for-behold mod ukritisk anvendelse i ammeperioden, enten ved at opfordre til atdiskutere amningen med lægen eller ved, at det i produktinformationen næv-nes, at behandling af ammende kvinder kun bør finde sted, hvis lægen vurde-rer, at dette er absolut nødvendigt. Igen skal den ordinerende læge afveje forde-le ved behandling mod de potentielle risici.Lægemiddelstyrelsen har ved en gennemgang af produktresumeerne vedr. am-ning fundet, at vejledningen til lægen om anvendelse af lægemidler, der inde-holder citalopram, er noget varierende produkterne imellem. Da disse produk-ter er godkendt via fælles Europæiske procedurer, vil Lægemiddelstyrelsensøge informationen harmoniseret ved førstkommende fælles vurdering af peri-odiske sikkerhedsopdateringer for indholdsstoffet.
6. Videnskabelig dokumentation vedrørende brug afSSRI under graviditetenDen viden, der opbygges om brug af SSRI under graviditet, kommer fra analy-ser af forskellige datakilder.
Side 14
I videnskabelig sammenhæng giver metaanalyser, hvor data fra en række epi-demiologiske studier samles, den bedste videnskabelige evidens. Herefter føl-ger i rækkefølge: individuelle epidemiologiske studier (registerstudier, cohortstudier eller case-control studier) og endelig spontane bivirkningsindberetnin-ger.Risikoen for misdannelser er størst i den første tredjedel af graviditeten (førstetrimester), da det er i denne periode, at de fleste organer dannes, og fokus i defleste undersøgelser har derfor været på behandling i denne periode af gravidi-teten.
6.1 HjertemisdannelserFør 2005 forelå der ingen publicerede epidemiologiske studier med signifikan-te bivirkningsfund med hensyn til risikoen for hjertemisdannelser i forbindelsemed anvendelse af SSRI i 1. trimester af graviditeten.Fra 2005 og frem er der offentliggjort solide studier, der giver vigtige oplys-ninger om problemstillingen. Der er foretaget omfattende undersøgelser af datafor hhv. paroxetin og fluoxetin i EU’s bivirkningskomité, og disse er beskrevetherunder.
6.1.1 Hjertemisdannelser og paroxetin6.1.1.1 Epidemiologiske studierIndehaveren af markedsføringstilladelsen for paroxetin (GSK) har gennemførtflere retrospektive epidemiologiske studier af medfødte misdannelser hos børn,der var født af mødre, som havde taget antidepressive lægemidler i løbet afførste trimester af graviditeten.Den første analyse fra 2005 viste en lille, men signifikant øget risiko for hjer-temisdannelser hos børn, der var født af mødre, som havde fået for paroxetin iførste trimester af graviditeten, set i forhold til baggrundsforekomsten. Denneanalyse blev senere opdateret, og resultaterne viste fortsat en let øget risiko forhjertemisdannelser set i forhold til baggrundsforekomsten.For de øvrige SSRI var der rapporteret om tilfælde af misdannelser, men i in-gen af tilfældene var der tale om statistisk signifikante fund.Samtidig med vurderingen af ovenstående data forelå resultaterne fra et kon-trolleret studie, McElhatton et al7, som dækkede perioden 1995-2001 og inklu-derende 1962 gravide kvinder, som havde taget SSRI. Endvidere forelå resulta-terne fra et registerstudie, Malm et al8, som dækkede hele Finland i perioden
Side 15
1996-2001 og inkluderende 1782 gravide kvinder. Ingen af disse studier be-kræftede fundene fra den første analyse.I juli 2010 publicerede Malm opdaterede data fra den finske undersøgelse9, dernu omfattede alle finske børn født i perioden 1996 – 2006, inklusiv i alt 6.976børn født af kvinder, som havde fået recept på SSRI under graviditeten. Herblev det konkluderet, at alvorlige medfødte misdannelser ikke var signifikanthyppigere blandt børn eksponeret for SSRI under graviditeten, men at paroxe-tin og fluoxetin var associeret med øget risiko for hjertemisdannelser.Endvidere forelå resultaterne af et mindre multicenterstudie, Diav-Citrin et al200510, som indikerede, at der var en stigning i antallet af misdannelser eftermødres indtagelse af paroxetin og fluoxetin under graviditeten. Studiet er dogfor lille til, at der kan drages en sikker konklusion på baggrund af resultaterne.Endelig forelå resultatet af et svensk registerstudie, Källén et al11. I dette studievar det muligt at sondre mellem brug af SSRI i første trimester og i resten afgraviditeten. I studiet indgik alle svenske børn født i perioden fra juli 1995 tildecember 2003 (773.906 børn). Studiet inkluderede 5.123 kvinder, som havdetaget SSRI under graviditeten. Her fandt man en lille, men statistisk signifikantøget risiko for misdannelser, især hjertemisdannelser (ventrikel og atrium sep-tumdefekter) hos børn, hvis mødre havde taget paroxetin i 1. trimester af gravi-diteten. Man fandt i øvrigt ingen stigning i det totale antal misdannelser efterbrug af SSRI.6.1.1.2 MetaanalyserDer er i perioden 2007 – 2009 fremkommet flere opdaterede metaanalyser omrisikoen for fosterskader ved kvinders anvendelse af SSRI under graviditeten.Resultaterne af en analyse, der er udført i et samarbejde mellem indehaveren afmarkedsføringstilladelsen (GSK) og University of North Carolina, og som erindsendt til Det Europæiske Lægemiddelagentur, fremgår nedenfor.Formålet med metaanalysen var at indsamle og vurdere alle tilgængelige, rele-vante epidemiologiske data vedrørende anvendelse af paroxetin i første tri-mester af graviditeten og medfødte misdannelser (dataindsamlingen stoppede ioktober 2007).I denne undersøgelse konkluderede man, at der er en let øget forekomst af hjer-temisdannelser og andre misdannelser hos nyfødte efter moderens brug af pa-roxetin i første trimester.Den nyeste publicerede metaanalyse er fra 2010 (Udechuku et al12). Dennemetaanalyse inkluderede 25 studier (metanalyser, cohort, case-control) vedrø-rende SSRI-præparater og risiko for misdannelser.
Side 16
I metaanalysen indgår et dansk studie (Chambers13, Pedersen et al14), medenset andet dansk studie (Wogelius et al)15blev ekskluderet, fordi data ikke låindenfor den undersøgte tidsperiode.Der er delvist sammenfald mellem de studier, der er inkluderet i denne meta-analyse, og de studier, der er inkluderet i den ovenfor nævnte.I metaanalysen (Udechuku et al) konkluderede forfatterne følgende:”Alt i alt, med de studier, der indgår i denne undersøgelse, ser det ud til, at forantidepressiv medicin som gruppe og individuelt – bortset fra paroxetin – er detusandsynligt, at de er fosterskadende.”Som det fremgår af afsnit 6.1.2.3, blev data fra studier vedrørende fluoxetinvurderet anderledes af EU`s bivirkningskomité.6.1.1.3 Vurdering i EU´s Bivirkningskomité – paroxetinParoxetin og risiko for misdannelser har været behandlet i EU´s Bivirknings-komité siden september 2005.I december 2005 blev sagen behandlet indgående i komiteen, og der blev set påalle de tilgængelige data. Bivirkningskomiteen kom frem til følgende konklusi-oner:•Der er et signal med hensyn til hjertemisdannelser efter brug af paroxe-tin. Forskellige typer af epidemiologiske studier viser en stigning i an-tallet af hjertemisdannelser efter brug af paroxetin i første trimester.Stigningen er lille, og flere data er nødvendige før en endelig konklusi-on kan drages. Årsagssammenhæng er ukendt.Der er behov for et tilføje oplysninger om risikoen i produktresumeernefor paroxetin. Teksten, der blev indsat i produktresumeerne, indeholderoplysninger om, at nogle epidemiologiske studier tyder på en øget risi-ko for misdannelser, herunder hjertemisdannelser. Mekanismen hertil erukendt. Studiedata tyder på, at risikoen for hjertemisdannelser hos ny-fødte, hvis mødre har taget paroxetin under graviditeten, er mindre end2 ud af 100 fødsler set i forhold til en baggrundsforekomst af hjertemis-dannelser blandt nyfødte på ca. 1 ud af 100 fødsler i den almindeligebefolkning.Der er ikke tilstrækkeligt med data til at kunne sige noget sikkert om-kring eventuelle forskelle i risiko mellem de forskellige SSRI produk-ter. For fluoxetin er der en tendens i retning af øget risiko for hjertemis-dannelser i nogle studier, men der er ikke statistisk signifikans.
•
•
Side 17
6. 1.2 Hjertemisdannelser og fluoxetinFra 2005 og frem er der offentliggjort undersøgelser vedrørende fluoxetin ogrisiko for misdannelser ved anvendelse af lægemidlet i 1. trimester af gravidite-ten. Egentlige konklusive undersøgelser ses først i 2009 og fremefter.6.1.2.1 Epidemiologiske studierI januar 2009 diskuterede EU-bivirkningskomite resultaterne af en epidemiolo-gisk undersøgelse af SSRI og fluoxetin m.fl. (Diav-Citrin et al 2008)16Konklusionen i denne undersøgelse er bl.a., at der er en let øget risiko for med-fødte misdannelser efter brug af SSRI – og at det især er for fluoxetin, når detgælder alvorlige hjertemisdannelser. Forfatterne gør endvidere opmærksom på,at typen af hjertemisdannelser viser stor variation/diversitet, og at dette talerimod én fælles tilgrundliggende mekanisme, men at en sådan på den anden sideikke kan udelukkes.6.1.2.2 MetaanalyseEn af indehaverne af en markedsføringstilladelse for fluoxetin (Eli-Lilly) ind-sendte i 2009 en metaanalyse omfattende 8 epidemiologiske studier8, 10,17, 18, 19,20, 21, 22.Konklusionerne i denne undersøgelse var følgende:••Alle misdannelser: Kvinder eksponeret for fluoxetin i første trimesterhavde ikke en signifikant øget risiko for at føde børn med misdannelserHjertemisdannelser: Kvinder eksponeret for fluoxetin i første trimesterhavde en signifikant øget risiko for at føde børn med misdannelser.
6.1.2.3 Vurdering i EU´s Bivirkningskomité – fluoxetinFluoxetin og risiko for misdannelser har været behandlet i EU´s Bivirknings-komité i 2005 i forbindelse med vurderingen af samme problemstilling for pa-roxetin, i det omfang studierne også indeholdt data vedrørende fluoxetin. Deter dog først i 2010, at der forelå tilstrækkelige data fra studier, der indikerer, atder er en signifikant let øget risiko for misdannelser ved brug af fluoxetin, og atdenne risiko ligger på niveau med risikoen for paroxetin.I januar 2010 var der i bivirkningskomiteen enighed om, at produktinformatio-nen for fluoxetin skulle indeholde oplysninger om den observerede forøgederisiko for hjertemisdannelser. Der var enighed om, at der i produktresumeernefor fluoxetin skulle tilføjes information om en risiko for misdannelser svarende
Side 18
til den information, der tidligere var tilføjet i produktresumeerne for paroxetin,jf. afsnit 6.1.1.3.
6. 1.3 Hjertemisdannelser og andre SSRI’erFor den øvrige medicin i gruppen af SSRI-præparater foreligger der ikke tilsva-rende entydige og valide resultater fra epidemiologiske studier vedrørende risi-koen for misdannelser. Det kan imidlertid ikke udelukkes, at de øvrige SSRI-præparater (sertralin, citalopram, escitalopram og fluvoxamin) også kan forår-sage hjertemisdannelser.Lægemiddelstyrelsen har modtaget enkelte indberetninger om hjertemisdannel-ser også ved behandling med citalopram og sertralin. For nærmere detaljer omdisse indberetninger henvises til afsnit 7.Der findes to danske studier på området, Pedersen et al23og Wogelius et al24.Førstnævnte er et dansk registerstudie fra Aarhus Universitet, hvor der indgik496.881børn født mellem 1996 – 2003. Endvidere indgik data fra receptregi-stret og fødselsregistret samt udskrivningsdiagnoser.Studiet viste, at børn født af kvinder, der havde taget et SSRI tidligt i gravidite-ten, havde en lille, men signifikant øget risiko for at blive født med hjertefejl(hjerteseptum-defekter).Risikoen var forskellig for de forskellige typer SSRI:Til forskel fra andre studier var det i denne undersøgelse primært citalopram ogsertralin, der var forbundet med en øget risiko for hjertemisdannelser. Studietviste også, at børn født af mødre, der havde fået udskrevet mere end en typeSSRI under graviditeten, havde en fire gange øget risiko for hjertefejl (hjerte-septum-defekter).I absolutte tal var risikoen dog stadig lav: Forekomsten af hjertefejl (hjertesep-tum-defekter) var 0,5 % blandt ikke-eksponerede børn, 0,9 % blandt ekspone-rede børn og 2,1 % blandt børn, hvis mødre havde fået udskrevet mere end étSSRI.Forskerne fandt ingen statistisk signifikant øget risiko for andre typer af mis-dannelser ved anvendelse af SSRI under graviditeten.Konklusionen i denne undersøgelse var, at det især er citalopram og sertralin,der synes at være forbundet med risiko for misdannelser. Denne undersøgelseadskiller sig altså fra de andre undersøgelser og det samlede risikobillede. Ana-lysen indgår i metaanalysen nævnt ovenfor. Forfatterne konkluderede, at demodstridende fund i forskellige studier måske kan forklares med forskelle i
Side 19
inklusionskriterier og i anvendte doser, samt at der er behov for studier medstørre populationer.Studiet Wogelius et al. er et dansk registerstudie, der omfattede 150.000 gravi-de kvinder, hvoraf 1051 havde indløst recept på SSRI i perioden 30 dage førgraviditet til slutningen af første trimester. Fem ud af 100 børn født af dissekvinder blev født med misdannelser, medens 4 ud af 100 børn født af kvinder ikontrolgruppen (der ikke blev behandlet med SSRI) blev født med misdannel-ser.Forfatterne konkluderede, at der er en øget risiko for misdannelser generelt,men ikke for specifikke misdannelser, hos nyfødte, hvis mødre har taget SSRI istarten af graviditeten, men at det er uklart, hvorvidt der er en kausal sammen-hæng, eller om forskellen skyldes faktorer forbundet med selve sygdommen(depression).Lægemiddelstyrelsen har iværksat en undersøgelse med henblik på yderligereat belyse sammenhængen mellem anvendelsen af SSRI under graviditet ogrisikoen for misdannelser af fostret. Undersøgelsen er tilrettelagt som en danskregisterundersøgelse, hvor der vil ske en samkøring af data fra Landspatientre-gisteret og Lægemiddelstatistikregisteret. Denne undersøgelse vil inkluderegravide frem til 2010 og således tage højde for det øgede forbrug af SSRI i desenere år.
6.2 SSRI behandling og øget tryk i lungekredsløbet hos nyfødteDen mulige risiko for forhøjet tryk i lungekredsløbet hos nyfødte børn af mødre,som har været i behandling med SSRI-præparater under graviditeten, blev førstegang beskrevet i litteraturen i 200625, men evidensen for årsagssammenhæng varpå daværende tidspunkt meget sparsom.På grundlag af nye epidemiologiske studier26, 27, 28, som i 2010 blev vurderet afEU’s Bivirkningskomité, konkluderede komiteen, at gravides brug af SSRI-præparater medfører en øget risiko for forhøjet tryk i lungekredsløbet hos nyfødte,og komitéen besluttede, at der skulle indarbejdes en advarsel om denne risiko i alleproduktresumeerne.Risikoen for forhøjet tryk i lungekredsløbet efter brug af SSRI-præparater anslås atvære ca. 5 tilfælde pr. 1000 fødsler. Det skal sammenholdes med, at risikoen forforhøjet tryk i lungekredsløbet for alle nyfødte børn er 1-2 tilfælde pr.1000 fødsler.
6.3 Nyeste internationale konklusioner om SSRI og graviditetEn litteratursøgning udført den 7. juli 2011 i PubMed databasen viste 10 rele-vante reviewartikler fra 2009 og fremefter vedrørende risici ved brug af SSRIunder graviditet29, 30, 31, 32, 33, 34, 35, 36, 37 og38.
Side 20
I de gennemgåede artikler konkluderes det generelt, at der ikke er afgørendebeviser for øget risiko for misdannelser hos fostre efter moderens brug af SSRI,men at anvendelse af paroxetin – og muligvis fluoxetin – tidligt i graviditetenkan være forbundet med en lille forøget risiko for kardiovaskulære misdannel-ser.Det konkluderes også, at perinatale (tiden umiddelbart efter fødslen) bivirknin-ger ved SSRI, herunder åndedrætsbesvær og neonatale tilpasningsproblemer, eralmindeligt forekommende hos udsatte spædbørn, og at en øget risiko for persi-sterende pulmonal hypertension (PPHN, forhøjet tryk i lungekredsløbet) hosnyfødte er blevet observeret.Den mistænkte øgede risiko for præmatur fødsel, lav fødselsvægt eller for lavgestationsalder er ikke blevet bekræftet i studierne, og det er ikke klart i hvilketomfang de bivirkninger, der er set i nogle undersøgelser, kan henføres til læ-gemidlet eller er relateret til moderens underliggende sygdom og andre muligeårsager, herunder livsstilsrelaterede årsager.Endelig understreger flere forfattere, at de potentielle risici ved at anvendeSSRI til behandling af depression hos gravide skal afvejes i forhold til de risici,der er ved ubehandlede depressioner.Disse artikler bekræfter megen af den viden, som vi har om SSRI og graviditetpå nuværende tidspunkt.
6.4 Nye diskussioner af mulige risici ved SSRI i forbindelse medgraviditet6. 4.1 AutismeEn nylig undersøgelse, der er offentliggjort i Archives of General Psychiatry ijuli 201139, har rejst mistanke om en øget risiko for autisme hos barnet eftermoderens brug af SSRI under graviditeten.Det kan ikke på baggrund af studiet konkluderes, hvorvidt der er tale om enreel sammenhæng med medicinen. Dette kræver yderligere dokumentation frastørre studier at underbygge data. Lægemiddelstyrelsen følger nøje denne pro-blemstilling.
6. 4.2 Nedsat sædkvalitet hos mændPå baggrund af enkelte publikationer har det på det seneste været diskuteret, hvor-vidt brug af SSRI hos mænd kan forårsage nedsat sædkvalitet. Firmaet, der mar-kedsfører Seroxat (paroxetin), tog initiativ til at få tilføjet en tekst herom i deresproduktinformation. Det medførte, at der i produktresumeets afsnit 4.6 er indsatinformation om, at kliniske studier har vist, at SSRI´er (herunder paroxetin) mu-
Side 21
ligvis kan påvirke sædkvaliteten, og at denne påvirkning synes at være reversibelved seponering af behandlingen. Det fremgår også af produktresumeet, at påvirk-ning af fertilitet ikke er undersøgt i disse studier, men hos nogle mænd kan æn-dringer i sædkvaliteten påvirke fertiliteten.Efterfølgende er det blevet diskuteret, hvorvidt der er belæg for at tilføje dette somen generel klasseeffekt ved SSRI behandling. Konklusionerne fra de seneste dis-kussioner i EU’s bivirkningskomite har været, at de kliniske data ikke peger på ensammenhæng mellem SSRI og nedsat fertilitet hos mænd.
7. SSRI og indberettede formodede bivirkninger7.1 Indberettede formodede bivirkninger generelt
Rejsningsbesvær og manglende seksuallyst er velkendte bivirkninger ved behand-ling med SSRI.
Lægemiddelstyrelsen har siden SSRI’erne blev markedsført i Danmark modta-get indberetninger om formodede bivirkninger. Dette afsnit indeholder en kortgennemgang vedrørende modtagne i indberetninger frem til den 13. juni 2011.
Lægemiddelstyrelsen har modtaget 1767 danske indberetninger om formodedebivirkninger fra alle patientgrupper. 564 af disse indberetninger er kategoriseretsom alvorlige.Ved en alvorlig bivirkning forstås en bivirkning fremkaldt at et lægemiddel tilmennesker, som er dødelig, livstruende, kræver hospitalsindlæggelse eller for-længelse af hidtidig hospitalsindlæggelse, eller som resulterer i vedvarendeeller betydelig invaliditet eller uarbejdsdygtighed, eller som er en medfødtanomali eller fødselsskade, jf. § 3, stk. 3, i bekendtgørelse nr. 800 af 17. august2009 om indberetning af bivirkninger ved lægemidler m.m. og § 2, stk. 3, ibekendtgørelse nr. 1238 af 12. december 2005 om bivirkningsovervågning aflægemidler.En indberetning kan indeholde oplysninger om flere formodede, herunder al-vorlige, bivirkninger. En oversigt over alle indberettede formodede bivirknin-ger kan ses i bilag 1.En indberetning om en formodet bivirkning ved et lægemiddel er ikke ensbety-dende med, at der er påvist en årsagssammenhæng mellem lægemidlet og denindtrådte skade.De hyppigst indberettede bivirkninger vedrørende SSRI er primært symptomerfra nervesystemet, herunder hovedpine, svimmelhed, føleforstyrrelser ogkramper, og psykiske symptomer som angst, konfusion, rastløshed og selv-mordstanker. Symptomer fra mavetarmkanalen som diaré, kvalme og opkast-
Side 22
ning, generelle symptomer og reaktioner som træthed og utilpashed samtsymptomer fra huden som udslæt, kløe og øget svedproduktion er også hyppigeformodede bivirkninger, der er indberettet til Lægemiddelstyrelsen. Disse bi-virkninger er velkendte og beskrevet i produktresumeerne.Lægemiddelstyrelsen har modtaget 42 indberetninger om dødsfald hos patien-ter, som var i behandling med SSRI. Indberetningerne er modtaget i perioden1988 til 2011.Fire af indberetningerne omhandler spædbørn, hvor moderen har været i be-handling med SSRI under graviditeten. Disse indberetninger er nærmere be-skrevet i afsnit 7.2.1.I 5 af indberetningerne er det beskrevet, at patienterne begik selvmord, og i 6indberetninger er der tale om forgiftning eller overdosering. Problemstillingenvedrørende selvmord er beskrevet i afsnit 10.1.Lægemiddelstyrelsen har modtaget 4 indberetninger, hvor det er oplyst, at pati-enterne er døde af en blodprop i hjertet. Blodprop i hjertet er ikke en kendt bi-virkning ved SSRI. I 3 af de 4 tilfælde er der tale om patienter med andre risi-kofaktorer i form af forhøjet blodtryk, tidligere bypass-operation og diabetes.De øvrige indberetninger indeholder generelt begrænset information om årsa-gen til patienternes dødsfald. I nogle tilfælde er der oplysninger om andre mu-lige årsager. Det drejer sig om tilfælde, hvor der er faktorer som anden medi-cin, høj alder, overvægt eller alkoholmisbrug, der kan have været medvirkendedødsårsag. I et par tilfælde har lægen indberettet, at patienterne er faldet ogdøde heraf. Der var tale om ældre patienter, som var i behandling med SSRI.I den forbindelse skal det nævnes, at mange års indtagelse af forskellige typermedicin, interaktioner og svækket helbred som følge af alder og livsstil kanhave været medvirkende årsag til dødsfald.
7.2 Indberettede formodede bivirkninger hos fostre og spædbørnefter moderens brug af SSRILægemiddelstyrelsen har modtaget 74 danske indberetninger om formodede bi-virkninger om dødsfald eller alvorlige bivirkninger hos fostre og spædbørn eftermoderens brug af SSRI.De 74 indberetninger indeholder 137 formodede bi-virkninger, der er nærmere beskrevet bilag 2.
Af de 74 indberetninger er der 4 indberetninger om dødsfald hos spædbørn, 56indberetninger om andre alvorlige bivirkninger hos børn og 14 indberetningerom aborter eller fosterdød.
7.2.1 Indberetninger om dødsfald hos spædbørn
Side 23
Der er som nævnt indberettet fire tilfælde af spædbarnsdød, hvor moderen un-der graviditeten har været i behandling med SSRI.To af dødsfaldene er set i forbindelse med moderens behandling med fluoxetin.I det ene tilfælde, som er indberettet til Lægemiddelstyrelsen i 2006, døde bar-net ti timer efter fødslen. Ifølge obduktionserklæringen skyldtes dødsfaldethjertelungesvigt med lungeødem og blødning. Der var ingen misdannelser,men der var mistanke om forhøjet tryk i lungekredsløbet (persisterende pulmo-nal hypertension, PPHN).I det andet tilfælde, som blev indberettet til Lægemiddelstyrelsen 2009, dødebarnet 11 dage efter fødslen. Barnet var i øvrigt født for tidligt. Det fremgår afsygehistorien, at der var mistanke om, at barnet havde abstinenser som følge afmoderens brug af fluoxetin. Ifølge obduktionserklæringen var den formodededødsårsag forstyrrelse i hjernefunktionen eller kredsløb som følge af påvirk-ning med fluoxetin hos barnet, hvis hjerne endnu ikke var fuldt modnet oghavde mindre følger efter iltmangel på grund af den for tidlige fødsel.Herudover er der indberettet to tilfælde af dødsfald hos nyfødte, hvor moderenunder graviditeten har været i behandling med henholdsvis paroxetin og cita-lopram. I det ene tilfælde, der blev indberettet i 2003, er der tale om et dødsfaldhos et ikke levedygtigt barn født med en særlig type dværgvækst (thanatofordysplasi), og i det andet tilfælde, som blev indberettet i 1998, er der tale omspædbarnsdød på grund af hjertemisdannelse.
7.2.2 Indberetninger om formodede alvorlige bivirkninger hosbørnDer er indberettet 56 tilfælde af formodede alvorlige bivirkninger, herundermisdannelser, hos børn, hvis mødre har været i behandling med SSRI.Den hyppigst indberettede medfødte misdannelse er hjertemisdannelse. Læge-middelstyrelsen har modtaget 11 danske indberetninger, hvor et barn eller fo-ster havde en hjertemisdannelse. Der er nærmere redegjort herfor i afsnit 7.2.4.Enkelte kromosomdefekter samt symptomer fra nervesystemet som kramper ogrystelser hos den nyfødte og forøget eller for lav muskelspænding er ligeledesbeskrevet i nogle af indberetningerne.Lægemiddelstyrelsen har derudover modtaget indberetninger om seponerings-syndrom og abstinenssymptomer hos nyfødte.Der er også modtaget nogle få indberetninger om symptomer hos ældre børnmed formodet relation til moderens indtagelse af SSRI under graviditet. Her erbeskrevet et tilfælde af forsinket motorisk udvikling og koncentrationsbesværog tre tilfælde af forsinket psykomotorisk udvikling. Herudover er der modta-
Side 24
get indberetninger om et tilfælde af epilepsi samt et tilfælde af autisme. Derforeligger på nuværende tidspunkt imidlertid ikke videnskabelig dokumentati-on for en sammenhæng mellem moderens brug af SSRI og udviklingsmæssigeforstyrrelser hos ældre børn.
7.2.3 Indberetninger om fosterdød eller abortLægemiddelstyrelsen har modtaget i alt 14 danske indberetninger om fosterdødeller abort. Størstedelen af indberetningerne omhandler spontane aborter i gra-viditetens første trimester.I fire tilfælde er der tale om misdannelser hos fosteret (et tilfælde af rygmarvs-brok, et tilfælde af manglende kranie, et tilfælde af hjerne-/hjertemisdannelseog et tilfælde af en tumor hos fosteret), mens der i de øvrige registrerede tilfæl-de af abort/fosterdød ikke er oplysninger om misdannelser hos fosteret.
7.2.4 Indberetninger om hjertemisdannelserLægemiddelstyrelsen har modtaget 11 danske indberetninger, hvor det er be-skrevet, at barnet eller fostret havde en hjertemisdannelse. Tabel 5 indeholderoplysninger om præparatnavne og hjertefejl. Septumdefekter er de hjertemis-dannelser, der er indberettet hyppigst.
Side 25
Tabel 5.Beskrivelse af hjertemisdannelser hos fostre og børn, som er indberet-tet som formodede bivirkning ved gravides brug af SSRI fra produkterne ermarkedsført til den 13.juni 2011.Indholds-stofCitalopram
Modtaget år
Beskrivelse af misdannelsen
199820032004200720092010*2010*2010*
2010*20112011
2011
Barnet døde indenfor den første måned(neonatalt) og havde en hjertemisdannelse. Hjer-temisdannelsen er ikke beskrevet nærmere.Barnet havde en medfødt hjertemisdannelse.SertralinHjertemisdannelsen er ikke beskrevet nærmere.Barnet havde et hul i skillevæggen mellem pum-Citaloprampekamrene (ventrikel septumdefekt).Barnet havde et hul i skillevæggen mellem højreEscitalopramog venstre forkamre (atrium septumdefekt).Barnet havde en valvulær pulmonal stenose (For-Fluoxetinsnævring af hjertets lungeklap) og en atrium sep-tumdefekt på 6-7 mm.Sagen beskrevet i en artikel – se *. Barnet havdeFluoxetinen septumdefekt i hjertet.Sagen er beskrevet i en artikel – se *. Barnet hav-Fluoxetinde en septumdefekt i hjertet.Sagen er beskrevet i en artikel – se *. Barnet hav-Fluoxetinde en hjertemisdannelse. Hjertemisdannelsen erikke beskrevet nærmere.Sagen er beskrevet i en artikel – se *. Barnet hav-Fluoxetinde en hjertemisdannelse. Hjertemisdannelsen erikke beskrevet nærmere.Barnet havde en atrium septumdefekt på 6-7 mmSertralini diameter.Barnet havde en hjertemisdannelse, EbsteinsCitalopramanomaly.Moderen fik en foretaget en provokeret abort iuge 15 efter en scanning viste holoprosencephali(abnorm fusion imellem frontallapper) over midt-Sertralinlinien samt ansigtsmisdannelser. Der er stadigtvivl om, hvorvidt fosteret havde hjertemisdan-nelser. LMS afventer obduktionsrapporten.
•
Litteraturrapport, hvor cases har indgået i det tidligere beskrevne danske kohorte studie af Pedersen et al.23
7.3 Samlet vurdering af de indberettede bivirkninger
Side 26
7.3.1 Hvordan vurderes indberettede bivirkninger?Enkeltindberetninger om formodede bivirkninger kan bruges til at identificerenye signaler om mulige sikkerhedsproblemer, men de kan normalt ikke brugestil at konkludere, om der er nye eller ændrede risici forbundet med anvendelsenaf et konkret lægemiddel.De observerede formodede bivirkninger kan skyldes et tilfældigt sammentræf,dvs. symptomer, der tilfældigvis falder tidsmæssigt sammen med indtagelse afet lægemiddel. Symptomerne kan skyldes bivirkninger fra andre lægemidler,andre sygdomme, forhold i det omgivende miljø eller noget helt fjerde.Derfor skal man være varsom med at drage konklusioner om årsagssammen-hæng på baggrund af bivirkningsindberetninger, før disse har været underkastetyderligere undersøgelser. Disse kan f.eks. være epidemiologiske studier.Enkeltindberetninger siger i almindelighed heller ikke noget om hyppighedenaf en bivirkning, idet der generelt er en velkendt underrapportering, og der inogle tilfælde kan være en stimuleret rapportering, f.eks. som følge af massivmedieomtale. Hyppigheden af en bivirkning kan fastlægges i kliniske forsøgeller i kontrollerede registerstudier, hvor man kender det totale antal inkludere-de patienter og kan opgøre den andel af disse patienter, som har fået bivirknin-ger.Indberetningernes vigtigste funktion er derfor at danne grundlag for opstillingaf hypoteser om, hvorvidt der er en årsagssammenhæng mellem anvendelse afet bestemt lægemiddel og en indtrådt skade, samt hvordan det i givet fald kanforklares. Hypoteserne skal normalt herefter afprøves i videnskabelige under-søgelser.
7.3.2 Vurdering af indberettede formodede bivirkninger vedSSRI og graviditet.Samlet set er det Lægemiddelstyrelsens vurdering, at de danske indberetningerom formodede bivirkninger vedrørende SSRI-præparater viser, at der er godoverensstemmelse med produktinformationen.I forbindelse med graviditet og amning bør indberetninger om abstinenssymp-tomer hos nyfødte, bivirkninger hos det diende barn, aborter, hjertemisdannel-ser og forhøjet tryk i lungerne hos nyfødte særligt fremhæves. Disse bivirknin-ger kommenteres særskilt nedenfor.Risikoen for bivirkninger hos nyfødte i form af abstinenssymptomer (sepone-ringssyndrom og serotonin syndrom) har været kendt siden 1990`erne. I defleste tilfælde er abstinenssymptomerne ikke alvorlige. Det kan fx være irrita-bilitet, grådlabilitet, problemer med at sutte og søvnproblemer. I nogle tilfældeopstår der alvorlige bivirkninger som kramper eller åndedrætsbesvær. De akti-
Side 27
ve indholdsstoffer i SSRI-præparater udskilles i modermælken, og der er der-for også risiko for, at der kan opstå bivirkninger hos det diende barn. Dissebivirkninger er beskrevet i produktresumeerne og indlægssedlerne.Formodede bivirkninger i form af spontane aborter, hjertemisdannelser og for-højet tryk i lungerne kan være et resultat af moderens behandling med SSRImen kan også skyldes andre årsager. Det er således skader, der også kan fore-komme ved graviditet hos raske kvinder, som ikke er behandlet med SSRI elleranden medicin.Baggrundsrisikoen for spontane aborter, hjertemisdannelser og forhøjet tryk ilungerne skal tages i betragtning, når man skal vurdere forekomsten af indbe-rettede formodede bivirkninger.Baggrundsrisikoen for spontane aborter er generelt høj og afhænger af mangefaktorer, bl.a. kvindens alder og livsstil. Det er estimeret, at omkring 20 % afalle graviditeter resulterer i spontan abort, men estimaterne varierer meget.Forekomsten af misdannelser i hjertekarsystemet blandt alle nyfødte er somnævnt anslået til ca. 1 ud af 100. Ifølge Landspatientregistret blev der i 2010født 704 børn med hjertemisdannelser i Danmark. Lægemiddelstyrelsen harsiden de første SSRI-præparater blev markedsført i slutningen 1980`erne mod-taget 11 indberetninger, hvor det er beskrevet, at barnet eller fostret havde enhjertemisdannelse.Forekomsten af forhøjet tryk i lungekredsløbet blandt alle nyfødte er somnævnt anslået til ca. 1-2 tilfælde pr. 1000 fødsler. Ifølge Landspatientregistretblev der i 2010 født 129 børn med forhøjet tryk i lungekredsløbet. Lægemid-delstyrelsen har siden de første SSRI-præparater blev markedsført modtaget 4indberetninger om forhøjet tryk i lungekredsløbet hos nyfødte, hvis mødre haranvendt SSRI under graviditeten.
8. SSRI til børn og unge
8.1 Godkendelse og produktinformation om anvendelse til børnLægemidler, der indeholder fluoxetin, fluvoxamin og sertralin, er godkendt tilbehandling af børn.Alle produktresumeerne for de øvrige SSRI-præparater indeholder oplysningerom, at produktet ikke er undersøgt til børn og/eller ikke bør anvendes til perso-ner under 18 år. Der er tale om oplysninger i produktinformationens afsnit 4.2(Dosering og administration) og ikke en kontraindikation.Fluoxetin er godkendt til behandling af moderat til svær depression hos børnover 8 år og unge.
Side 28
Fluvoxamin er godkendt til behandling af OCD (obsessiv-kompulsiv sygdom)hos børn over 8 år, mens sertralin er godkendt til behandling af OCD hos børnover 6 år.Produktinformationen for samtlige SSRI-produkter (uanset om de er godkendttil børn) indeholder særlige advarsler om øget risiko for selvmordsrelateretadfærd (selvmordstanker og selvmordshandlinger) samt fjendtlig adfærd (ag-gression, vrede m.m.).For produkter, der indeholder fluoxetin og paroxetin, indeholder produktresu-meerne tillige et underafsnit til bivirkningsafsnittet, hvor bivirkninger hos børnbeskrives særskilt.
8.2 Hvem udskriver recepterne til børn?I Sundhedsstyrelsens vejledning nr. 10.332 af 10. december 2007 om medika-mentel behandling af børn og unge med psykiske lidelser, er det beskrevet, atakut medicinsk behandling af depression, vedligeholdelsesbehandling samtforebyggende behandling med antidepressiva skal iværksættes af en speciallæ-ge i børne- og ungdomspsykiatri. I tilfælde af somatisk komorbitet (anden, ik-ke-psykiatrisk sygdom) kan behandling med antidepressiva dog iværksættes afen pædiater (børnelæge) efter tværfaglig vurdering og efter aftale med en spe-ciallæge på børne - og undgdomspsykiatrisk specialafdeling.I dette afsnit er der foretaget en opgørelse over, hvem der udskriver recepterne,og hvilke produkter der udskrives.På baggrund af oplysninger i Lægemiddelstatistikregistret er det undersøgt,hvilke typer læger, der har udskrevet den første recept til nye brugere af SSRItil børn og unge i aldersgruppen 0 – 17 år. Oplysningerne fremgår af tabel 6.Tabel 6.Oversigt over, hvilken type læge der i 2010 udskrev første recept tilbørn og unge i aldersgruppen 0 – 17 år.LægetypeAlmene lægerSpeciallægerHospitals-og afdelingslægerAndreTotalAldersgruppe0-12 år49 (18 %)73 (26 %)125 (45 %)29 (11 %)276 (100 %)Aldersgruppe13-17 år1596 (63 %)204 (8 %)631 (25 %)95 (4 %)2526 (100 %)
I 2010 blev 2802 børn og unge sat i behandling med SSRI for første gang.Tallene viser ikke, om en alment praktiserende læge har konsulteret en børne-og ungdomspsykiatrisk speciallæge, inden vedkommende udskrev recepten.
Side 29
8.3 Hvilke præparater vælges til børn?Nedenfor ses en oversigt over salget af SSRI-præparater til børn og unge for-delt på de enkelte præparater uanset hvilken sygdom, lægemidlerne er anvendttil. En bruger kan have indløst recept på flere forskellige lægemidler.
Tabel 7.Salg af SSRI-præparater i 2010 til børn og unge i Danmark opgjortefter antallet af patienter.SSRI-præparatAlleFluoxetinCitalopramParoxetinSertralinFluvoxaminEscitalopramAldersgruppe0-12 år13-17 år0-12 år13-17 år0-12 år13-17 år0-12 år13-17 år0-12 år13-17 år0-12 år13-17 år0-12 år13-17 årAntal personer5705.107757581281.795101063462.1361124609
Det fremgår af tabellen, at salget af sertralin er størst. Sertralin er som nævntgodkendt til behandling af børn over 6 år med OCD. Det kan dog også konsta-teres, at der er et betydeligt salg af SSRI-præparater (citalopram, paroxetin ogescitalopram), der ikke er godkendt til børn og unge.
8.4 Nye tiltag i forhold til behandling af børnI forhold til behandling af børn med SSRI har Sundhedsstyrelsen iværksat enrække tiltag med henblik på at sikre korrekt behandling af denne patientgruppeog udbrede kendskabet til behandlingsvejledningen på området. Sundhedssty-relsen har i den anledning iværksat følgende initiativer:••Sundhedsstyrelsen har udsendt en præcisering af, hvordan de praktise-rende læger skal forholde sig ved behandling af børn.Sundhedsstyrelsen har understreget behovet for mere kapacitet på detbørne- og ungepsykiatriske område overfor Danske Regioner (DR) oghenstillet til DR, at der organiseres en rådgivningsfunktion i alle regio-ner.
Side 30
•
Sundhedsstyrelsen vil tage kontakt til Kommunernes Landsforening forat drøfte, hvorledes psykologhjælp til børn og unge med depression kangøres mere tilgængelig for brugerne.Sundhedsstyrelsen har præciseret afsnittet om præparatvalg i styrelsensvejledning om medikamentel behandling af børn og unge med psykiskelidelser.
•
Lægemiddelstyrelsen vil følge udviklingen i lægernes udskrivning af recepterpå SSRI til børn, og styrelsen vil holde Sundhedsstyrelsen orienteret herom.
9. Effekten af SSRI ved behandling af depression
I kliniske forsøg, der danner grundlag for udstedelse af markedsføringstilladel-se for antidepressiva, anvendes såkaldte ”rating scales”. Disse er standardisere-de spørgeskemaer, som lægerne anvender til at vurdere depressionens svær-hedsgrad.De mest kendte er Hamilton Rating Scale for Depression (HRSD) og Montgo-mery-Åsberg Depression Rating Scale (MADRS). Spørgeskemaerne handlerom depressionssygdommens karakteristiske symptomer, fx nedtrykthed, selv-bebrejdelser, søvnforstyrrelser og selvmordstanker. Når lægen har vurderetpatientens besvarelse af spørgsmålene, udregner lægen en score i form af et talmed henblik på at måle effekten af behandlingen.Patienter, som deltager i de kliniske forsøg, får vurderet depressionens svær-hedsgrad før forsøgets start samt flere gange i løbet af undersøgelsesperioden,der typisk strækker sig over flere uger. Dermed bliver det muligt at observere,om patientens tilstand bedres under behandlingen.Effekten af det antidepressive lægemiddel vurderes ved at sammenligne effek-ten hos de patienter, der får det pågældende lægemiddel med effekten hos pati-enter, der får placebo (uden aktivt lægemiddelstof) eller et andet lægemiddel.Man kan opgøre effekten af antidepressiva på mange forskellige måder. I anti-depressiva-undersøgelser fokuserer man typisk primært på ændringer i scorenberegnet ud fra de omtalte spørgeskemaer hos patienter, som er behandlet meddet aktive lægemiddelstof sammenlignet med patienter, som har fået placebo.En anden, hyppigt anvendt metode til at opgøre effekten af en behandling er ensåkaldt ”responder-analyse”.Patienter, som har haft god effekt af behandlingen (såkaldterespondere),defi-neres som patienter, hvor scoren er faldet med 50 % eller mere, eller hvor sco-ren er reduceret til et tal under en vis, foruddefineret tærskelværdi (remitters).
Side 31
Resultaterne for SSRI kan variere meget fra forsøg til forsøg. Typisk vil denaktive medicinske behandling have effekt på omkring 60 % af patienterne moden forbedring hos ca. 40 % af patienterne, som har fået placebo. De fleste pati-enter vil således få det bedre under behandling med SSRI. Men for en betydeligdel skyldes bedringen ikke den farmakologiske effekt af lægemidlet. Dette kal-des ofte for ”placebo-effekten” og omfatter i virkeligheden flere forskelligefaktorer, bl.a. det forhold at depressionssygdommen ofte bedres spontant.Man skal behandle ca. 5 og i nogle undersøgelser op til 10 depressive patienter,før man har en patient, som er markant bedret som en følge af den biologiskeaktivitet af SSRI. Dette tal, der kaldes forNumber Needed to Treat (NNT),skalideelt set være så tæt på 1 som muligt.Effekten af SSRI er dårligst ved de letteste depressioner, hvor placebo-effektener størst. Ved moderate og svære depressioner er effekten veldokumenteret ogregnes af de fleste psykiatere for at være klinisk betydningsfuld. Jo sværeredepressionen er, jo vigtigere bliver de biologiske behandlingsformer, herunderfarmakologisk behandling.I forhold til godkendelsen af et SSRI er lægemidlet underlagt de samme kravsom andre lægemidler. Lægemidlet skal have en dokumenteret effekt mod denrelevante sygdom, og bivirkningerne skal stå i et rimeligt forhold til den gavn,patienterne får af behandlingen. Forholdet mellem fordele og risici ved læge-skal være gunstig for, at der kan udstedes en markedsføringstilladelse. I dennevurdering indgår behandlingsmuligheder, der allerede eksisterer for den pågæl-dende sygdom.Der er dog et forhold, som adskiller antidepressiva fra de fleste andre lægemid-ler. I omkring halvdelen af de forsøg, hvor man sammenligner antidepressivamed placebo, vil man ikke kunne se nogen sikker forskel mellem behandlingenmed lægemidlet og placebo. Årsagen hertil har været debatteret intensivt. Manhar bl.a. tilskrevet fænomenet den store placebo-effekt i depressionsforsøg. Detbetyder, at mange patienter får det bedre af andre grunde end det aktive læge-middel. Som nævnt er det en del af depressionssygdommens naturlige forløb,at den kan ”gå over af sig selv”.Desuden kan omstændigheder ved forsøget, fx mere opmærksomhed og støttefra behandlingspersonalet og bevidstheden hos patienten om at få et nyt, måskeeffektivt lægemiddel, bidrage til en stor placebo-effekt. Fænomenet har væretkendt i mange år og ser oven i købet ud til at være mere udtalt nu end for 30 årsiden. Det har voldt hovedbrud hos både forskere og lægemiddelfirmaer, fordidet gør det sværere og dyrere at udvikle nye antidepressiva, og hos myndighe-derne, fordi det er vanskeligere at vurdere effekten, når der er en indbygget”fejlrate” i forsøgene på ca. 50 %.Selv om undersøgelsesinstrumentet for afprøvning af antidepressiva såledesikke er optimalt, er det vigtigt, at der fortsat udvikles nye, mere effektive anti-
Side 32
depressiva med færre bivirkninger, da de nuværende behandlingsmulighederlevner plads til betydelig forbedringer. Mange patienter får ikke behandlet de-res depressionssygdom tilstrækkelig effektivt, og en del patienter oplever uac-ceptable bivirkninger.
10. Andre nyligt diskuterede sikkerhedsaspekter af SSRIbehandling10.1 Selvmordsrelateret adfærdForøget risiko for selvmordsrelaterede tanker og adfærd ved behandling medSSRI har været diskuteret i EU siden begyndelsen af 1990’erne på baggrund afbivirkningsindberetninger og et stigende antal publikationer om emnet. Diskus-sionen er kompliceret, idet selvmordtanker og – adfærd er en velkendt del afsygdomsbilledet for depression, og det derfor er svært at vurdere, om der er ensammenhæng med lægemidlet eller sygdommen.Produktinformationen for samtlige SSRI-produkter indeholder oplysninger om,at depression er forbundet med risiko for selvdestruktiv adfærd, inkl. selv-mordstanker og – handlinger.Endvidere oplyses det i produktinformationen, at denne risiko vedbliver at væ-re til stede, selvom den medicinske behandling begynder at virke, samt at risi-koen erfaringsmæssigt er større i starten af behandlingen.Endelig indeholder produktinformationen oplysninger om, at risikoen er størrehos personer med tidligere selvdestruktiv adfærd samt hos yngre voksne (under25 år). Produktresumeerne indeholder en opfordring til at informere patienterneog ikke mindst deres pårørende om denne risiko, ligesom behovet for at holdepatienten under opsyn angives.Produktresumeernes bivirkningsafsnit indeholder desuden specifikke oplysnin-ger om hyppigheden af selvmordstanker og – adfærd.Lægemiddelstyrelsen har modtaget 5 indberetninger om selvmord hos voksne,som var i behandling med SSRI, samt 1 indberetning om et selvmordsforsøghos et barn, som var i behandling med SSRI. Styrelsen har ikke modtaget ind-beretninger om selvmord hos børn eller unge i Danmark efter indtagelse afSSRI.
10.2 Risiko for knoglebrudPå baggrund af et nyt epidemiologisk studie, hvor man observerede en øget risikofor knoglebrud hos ældre kvinder i SSRI behandling40, blev denne risiko diskutereti EU’s bivirkningskomite første gang i 2007.
Side 33
Studierne på området er primært hos ældre patienter og den mulige mekanisme erstadig ukendt. På baggrund af yderligere studier blev det i 2010 besluttet at tilføjeinformation om knoglebrud til produktinformationen for SSRI samt andre anti-depressiva.
11. Information om SSRI og risiko for bivirkninger11.1 Information i indlægssedler og produktresumeer
Oplysninger om bivirkninger ved godkendte SSRI-præparater og om anvendel-se under graviditet og amning fremgår af lægemidlernes produktresumé(www.produktresume.dk) og af indlægssedlen (www.indlægssedler.dk).Indehaveren af markedsføringstilladelsen er ansvarlig for udarbejdelse af ind-lægssedlen. Kravene til indholdet af indlægssedlen fremgår af bekendtgørelsenr. 869 af 21. juli 2011 om mærkning m.m. af lægemidler.Den, der bringer et lægemiddel på markedet i Danmark, skal indsende den tilenhver tid gældende indlægsseddel til Lægemiddelstyrelsen, jf. lægemiddello-vens § 59, stk. 1. Lægemiddelstyrelsen gør indlægssedlen offentligt tilgængeligpå internettet (www.indlaegsseddel.dk). Det er indehaveren af markedsførings-tilladelsen, der har ansvaret for at udarbejde og opdatere indlægssedlen, så dentil enhver tid indholdsmæssigt svarer til det godkendte produktresumé. Læge-middelstyrelsen foretager stikprøvekontrol af, at virksomhederne overholderkravene til indlægssedler, herunder at indlægssedlerne er opdaterede.Der henvises i øvrigt til indholdet af indlægssedlerne om SSRI i afsnit 5.
11.2 Information om SSRI på promedicin.dk og minmedicin.dkPromedicin.dk og minmedicin.dk indeholder også oplysninger om bivirkningerved SSRI til sundhedspersoner og patienter. Det har imidlertid vist sig, at op-lysningerne på hjemmesiderne ikke stemmer helt overens med oplysningernevedrørende graviditet og amning i produktresumeerne for SSRI-produkterne.Det er uheldigt, da rigtig mange læger benytter promedicin.dk som hovedop-slagsværk, når de søger oplysninger om medicin.Den faglige redaktion for pro.medicin.dk og minmedicin.dk, der udgives afDansk Lægemiddel Information A/S, har oplyst, at man vil gennemgå alle tek-sterne på siderne om SSRI-præparaterne, således at det sikres, at disse teksterbedst muligt afspejler den aktuelle viden om præparaternes anvendelse til gra-vide og ammende og samtidig er i så god overensstemmelse med produktresu-mé og indlægsseddel som muligt.
11.3 Information og advarsler om SSRI ved graviditet
Side 34
Lægemiddelstyrelsen har løbende informeret om risici ved anvendelse af SSRIunder graviditet. Denne information har primært været baseret på resultater afepidemiologiske studier og konklusioner i EU´s bivirkningskomité.Lægemiddelstyrelsen informerede på sin hjemmeside i november 2005 omresultaterne af et epidemiologisk studie, der havde vist en øget risiko for hjer-temisdannelser hos nyfødte ved gravides anvendelse af paroxetin i starten afgraviditeten. I studiet blev der konstateret hjertemisdannelser hos knap 2 % afde nyfødte. Forekomsten af hjertemisdannelser blandt alle nyfødte børn var ca.1%. Styrelsen oplyste i den forbindelse, at resultaterne af studiet understreger,at anvendelse af paroxetin i den tidlige graviditet så vidt muligt bør undgås, ogat behandling med paroxetin bør genovervejes, hvis en kvinde bliver gravid,mens hun er i behandling med lægemidlet.Lægemiddelstyrelsen informerede endvidere i september 2005 om et andetepidemiologisk studie. Det vedrørte paroxetin og hjertemisdannelser. Institutfor Rationel Farmakoterapi orienterede om risikoen for fostermisdannelser vedbrugen af SSRI i sit månedsblad i juli 2006. Månedsbladet sendes til alle lægersammen med Ugeskrift for Læger, og bladet er tillige tilgængeligt via Institut-tets hjemmeside.Herudover har Lægemiddelstyrelsen i sit elektroniske nyhedsbrev Nyt om Bi-virkninger den 15. april 2010 informeret om risikoen for forhøjet tryk i lunge-kredsløbet hos nyfødte børn af mødre, der har været behandlet med serotonergantidepressiv medicin, herunder SSRI-præparater. Det fremgår af artiklen, atrisikoen for forhøjet tryk i lungekredsløbet hos nyfødte eksponeret for seroto-nerge (dvs. som virker via signalstoffet serotonin) antidepressiva er ca. 5 til-fælde pr. 1000 fødsler. Forekomsten af forhøjet tryk i lungekredsløbet blandtalle nyfødte børn er 1-2 ud af 1000 fødsler.Styrelsen oplyste i den forbindelse, at læger og jordemødre bør være opmærk-somme på fald i iltmætningen forårsaget af forhøjet tryk i lungekredsløbet hosnyfødte af mødre, som har været i behandling med SSRI-præparater, og at mansom læge bør informere gravide patienter i behandling med SSRI-præparaterom straks at kontakte hospitalet, hvis der opstår symptomer på forhøjet tryk ilungekredsløbet hos deres nyfødte barn – fx hurtigere vejrtrækning og blåfarv-ning af huden.I samme nummer af Nyt Om Bivirkninger har styrelsen informeret om en letforøget risiko for medfødte hjertemisdannelser ved brug af fluoxetin i gravidi-tetens første trimester. Det fremgår af artiklen, at data fra studier indikerer, atrisikoen for misdannelser i hjertekarsystemet hos nyfødte er fordoblet fra ca. 1til ca. 2 ud af 100 nyfødte, hvor moderen har indtaget fluoxetin i første tri-mester.Begge artikler i Nyt Om Bivirkninger er baseret på konklusioner fra EU`s Bi-virkningskomité, der har foretaget en større gennemgang af resultaterne af en
Side 35
række studier vedrørende anvendelse af antidepressiv medicin. Der var i øvrigtindføjet links i artiklerne til supplerende information på Det Europæiske Læ-gemiddelagenturs hjemmeside.Informationen i Nyt om Bivirkninger sendes til abonnenterne og er desudentilgængelig på Lægemiddelstyrelsens hjemmeside.Lægemiddelstyrelsen har den 28. februar og 11. marts 2011 på sin hjemmesideudsendt supplerende information vedrørende dødsfald, risiko for hjertemisdan-nelser, forhøjet tryk i lungekredsløbet og abstinenssymptomer ved SSRI-præparater, samt information om hvordan lægen bør forholde sig ved behand-ling af gravide. Den konkrete anledning var, at styrelsen vurderede, at der varbehov for at give supplerende oplysninger i forbindelse med medieomtale aftilfælde af alvorlige bivirkninger hos nyfødte, hvis mødre havde været i be-handling med fluoxetin.Lægemiddelstyrelsen har den 4. marts 2011 sendt et link til meddelelsen af 28.februar 2011 til Praktiserende Lægers Organisation og Dansk Psykiatrisk Sel-skab med henblik på videreformidling af information til deres medlemmer.Informationen er den 7. marts 2011 blevet offentliggjort på Lægeforeningenshjemmeside, og Dansk Psykiatrisk Selskab har den 14. marts 2011 meddeltLægemiddelstyrelsen, at selskabet vil lægge et link til informationen på dereshjemmeside.Endelig har Lægemiddelstyrelsen i meddelelserne af 28. februar 2011 og 11.marts 2011 linket til information udsendt af Institut for Rationel Farmakoterapiom anvendelse af depressionsmedicin under graviditet og risiko for bivirknin-ger hos nyfødte. Informationen er offentliggjort af Institut for Rationel Farma-koterapi på www.medicinmedfornuft.dk.Lægemiddelstyrelsen offentliggør ikke rutinemæssigt indberetninger om formode-de alvorlige bivirkninger i anonymiseret form. Det skyldes bl.a., at en indberetningom en formodet bivirkning ikke er ensbetydende med, at der er påvist en årsags-sammenhæng mellem lægemidlet og den skadelige virkning. Styrelsen har somnævnt ovenfor løbende offentliggjort dokumenterede oplysninger vedrørende sik-kerheden ved SSRI-præparater.
13. Konklusion
Behandling af depression under graviditet er kompliceret. Ubehandlet depressionhos den gravide og efter fødslen er i sig selv forbundet med en række risikofakto-rer for såvel det ufødte og det fødte barn.Ifølge Sundhedsstyrelsens vejledning på området bør mulighederne for psykotera-peutisk behandling altid overvejes ved depression hos gravide. Medicinsk behand-ling, herunder med SSRI, kan være nødvendig i nogle tilfælde. Det kan fx væreved svær depression eller ved stor risiko for tilbagefald af depression, hvis alleredeiværksat medicinsk behandling ophører. Behandling bør ifølge Sundhedsstyrelsens
Side 36
vejledning ske i samråd med en speciallæge i psykiatri. Der skal foretages en kon-kret afvejning af behandlingens mulige gavnlige effekt og skadelige virkninger seti forhold til den risiko, som en utilstrækkeligt behandlet depression medfører forsåvel kvinden som det ufødte barn.Den afvejning, som lægen ved ordinationen i samråd med patienten skal foretage,er ganske vanskelig. På den ene side er de risici, der er ved en ubehandlet depres-sion, velkendte. På den anden side er risikoen for bivirkninger, der i nogle tilfældeer dokumenterede.På nuværende tidspunkt ved vi, at gravides brug af SSRI-præparater kan medførealvorlige bivirkninger hos fostret og nyfødte. Der er risiko for misdannelser, her-under især misdannelser af hjertekarsystemet, forhøjet tryk i lungekredsløbet ogabstinenssymptomer hos barnet. I alle tre situationer er der tale om tilstande, derkan føre til dødsfald. Men vi ved også fra omfattende videnskabelige studier, atrisikoen er lav.Risiko for bivirkninger hos den nyfødte i form af seponeringssyndrom med absti-nenssymptomer har været kendt siden 1990’erne. I de fleste tilfælde er abstinens-symptomerne ikke alvorlige. Det kan fx være irritabilitet, grådlabilitet, problemermed at sutte og søvnproblemer. I nogle tilfælde opstår der alvorlige bivirkningersom kramper eller åndedrætsbesvær.De aktive indholdsstoffer i SSRI-præparater udskilles i modermælken, og der erderfor risiko for, at der kan opstå bivirkninger hos det diende barn. Det fremgår afproduktresumeerne for SSRI-præparaterne, at der er risiko for abstinenssymptomerhos nyfødte, samt at der kan opstå bivirkninger hos det diende barn. Men også herer risikoen lav.Epidemiologiske studier har vist en let forøget risiko for misdannelser i hjertekar-systemet hos nyfødte, hvis mødre har været i behandling med paroxetin og fluoxe-tin i starten af graviditeten (første trimester). Studierne indikerer, at ca. 2 ud af 100nyfødte af mødre, der har været i behandling med paroxetin eller fluoxetin, hardenne type misdannelser. Det skal sammenholdes med, at forekomsten af misdan-nelser i hjertekarsystemet blandt alle nyfødte er ca. 1 ud af 100.Risikoen for hjertemisdannelser blev først kendt for paroxetin i 2005, og det blevefterfølgende besluttet at indarbejde oplysninger herom i produktresumeerne efteranbefaling fra EU’s Bivirkningkomité. I 2010 blev det besluttet at tilføje tilsvaren-de oplysninger i produktresumeerne for fluoxetin. Det skete også efter anbefalingfra EU’s Bivirkningskomité, der samme år havde foretaget en større gennemgangaf resultaterne af en række epidemiologiske studier om anvendelse af antidepressivmedicin.For den øvrige medicin i gruppen af SSRI-præparater foreligger der ikke tilsva-rende entydige og valide resultater fra epidemiologiske studier af risikoen for mis-dannelser, men det kan med vores nuværende viden ikke udelukkes, at de øvrige
Side 37
SSRI-præparater (sertralin, citalopram escitalopram og fluvoxamin) også kan for-årsage hjertemisdannelser.Lægemiddelstyrelsen har iværksat en registerundersøgelse af, om gravides brug afandre SSRI-præparater kan medføre risiko for misdannelser. Baggrunden er, atLægemiddelstyrelsen har modtaget enkelte indberetninger om hjertemisdannelserhos nyfødte efter, at mødrene er blevet behandlet med citalopram og sertralin un-der graviditeten. Undersøgelsen tilrettelægges som en registerundersøgelse, hvorder vil ske en samkøring af Landspatientregisteret og Lægemiddelstatistikregiste-ret.Epidemiologiske studier har vist, at der er øget risiko for forhøjet tryk i lunge-kredsløbet hos nyfødte børn af mødre, der har været i behandling med SSRI. Risi-koen for forhøjet tryk i lungekredsløbet hos nyfødte eksponeret for serotonergeantidepressiva anslås at være ca. 5 tilfælde pr. 1000 fødsler. Det skal sammenhol-des med, at risikoen for forhøjet tryk i lungekredsløbet for alle nyfødte børn er 1-2tilfælde pr. 1000 fødsler.På grundlag af epidemiologiske studier, som i 2010 blev vurderet af EU’s Bivirk-ningskomité, konkluderede Lægemiddelstyrelsen og lægemiddelmyndighederne ide andre EU-lande samme år, at gravides brug af SSRI-præparater medfører enøget risiko for forhøjet tryk i lungekredsløbet hos nyfødte. Som følge af disse kon-klusioner blev det besluttet at opdatere produktresumeerne for al antidepressivmedicin med serotonerg effekt med oplysninger om denne risiko.En undersøgelse offentliggjort i tidsskriftet ”Archives of General Psychiatry” i juli2011 har rejst en mistanke om en øget risiko for autisme hos barnet efter moderensbrug af SSRI under graviditeten.
Det kan ikke på baggrund af studiet konkluderes, hvorvidt der er tale om enreel sammenhæng med medicinen. Dette kræver yderligere dokumentation frastørre studier at underbygge data. Lægemiddelstyrelsen følger nøje denne pro-blemstilling.Lægemiddelstyrelsen har modtaget én bivirkningsindberetning vedrørende autis-me. Der henvises i øvrigt til afsnit 6.4.1 samt afsnit 7.Lægemiddelstyrelsen har gennemgået produktresumeer og indlægssedler for samt-lige SSRI-præparater. Produktresumeerne indeholder advarsler i relation til gravi-ditet og amning. Selvom ordlyden er forskellig, er det grundlæggende budskab, atdisse lægemidler kun bør anvendes, hvis fordelene for den gravide (og det ufødteeller diende barn) opvejer de potentielle utilsigtede bivirkninger. Enkelte markeds-førte lægemidler mangler oplysninger i indlægssedlen om risiko for forhøjet tryk ilungekredsløbet hos nyfødte, hvis mødre er blevet behandlet med SSRI. Tilsvaren-de mangler enkelte indlægssedler oplysninger om risiko for abstinenssymptomerhos det nyfødte barn. Indehaveren af markedsføringstilladelsen er ansvarlig forudarbejdelse af indlægssedlen, og at den svarer til indholdet af det godkendte pro-duktresumé. Lægemiddelstyrelsen har iværksat et kontrolprojekt med det formål at
Side 38
sikre, at indehaverne af markedsføringstilladelserne får bragt forholdene vedrøren-de indlægssedlerne i orden.Lægemiddelstyrelsen vil løbende informere om eventuel ny viden vedrørende gra-vides brug af SSRI.
Side 39
Bilag 1Oversigt over alle formodede bivirkninger indberettet ved brug af SSRI. Oversigten omfatter perio-den fra den første markedsføring af SSRI og frem til den 13. juni 2011.Bivirkningerne er inddelt efter organklasse, og i alvorlige/ikke-alvorlige formodede bivirkninger.OrganklasseSymptomer fra blod og det lymfatiske system, fx blodpla-demangelSymptomer fra hjertet, fx hjertebanken, rytmeforstyrrelser,blodprop i hjertet (6)Medfødte familiære og genetiske fejl, fx hjertefejlSymptomer fra øret, lydoverfølsomhed, øresusen, svim-melhed (vertigo)Symptomer fra det endokrine (hormon) systemet, fx ud-skillelse af store mængder ufortyndet urin (diabetes insipi-dus)Symptomer fra øjet, fx svækket syn og lysoverfølsomhedSymptomer fra mave-tarm-kanalen, fx diare, kvalme ogopkastGenerelle symptomer og reaktioner, fx træthed, utilpashed,samt indberettede hændelser vedrørende manglende ellernedsat virkning af medicinen samt uventet virkning vedpræparat substitutionSymptomer fra leveren, hepatitis og toksisk påvirkning afleverenSymptomer fra immunsystemet, fx overfølsomheds reakti-onerInfektioner, fx pustulart udslætSkader og forgiftninger, fx overdosering og medicin eks-ponering under graviditetÆndring i laboratoriesvar, fx vægtøgning eller tabStofskifte og ernæringsbetingede symptomer, fx nedsatniveau er natrium i blodet og nedsat appetitSymptomer fra muskler og led, fx muskel og ledsmerter,stivhed, kramperGod og ondartede tumorer, fx brystkræftSymptomer fra nervesystemet, fx hovedpine, svimmelhed,føleforstyrrelser og kramperSymptomer knyttet til graviditeten, fx aborter og for tidligfødselPsykiske symptomer, fx angst, konfusion, rastløshed,selvmordstankerSymptomer fra urinvejene, hyppig og ringe vandladningog ufrivillig vandladningSymptomer fra forplantningssystemet og bryster, fx rejs-ning problemer (erektil dysfunktion) og mandlig brystdan-Alvorlige9463296Ikke-alvorlige12468301
21136140
52352236
2921258586646427832225168
1158215039561421113192360
Side 40
nelse.Symptomer fra respirationsvejene, fx kortåndethed og næ-seblod og hoste.Symptomer fra huden, fx øget svedproduktion, udslæt ogkløeSociale forhold, fx svækkelse af daglige aktiviteterKirurgiske og medicinske procedurer, fx brug af præpara-tet på ikke godkendte indikationerSymptomer fra karsystemet, fx for lavt eller for højt blod-trykTotal
465112171350
3828711312120
Side 41
Bilag 2Oversigt over indberettede formodede bivirkninger hos fostre og børn, hvis mødre har været i be-handling med SSRI. Oversigten omfatter perioden fra den første markedsføring af SSRI og frem tilden 13. juni 2011. Bivirkningerne er inddelt efter organklasse.OrganklasseHjertesygdomNeonatal bradykardiHjerte - lunge svigtKardiovaskulær lidelseCyanoseLungeklap stenoseMedfødte, familiære og genetiske lidelserAtrium septumdefektHjernemisdannelseCarcinogen påvirkningHjerte septumdefektCerebral pareseMedfødt manglende kranie hvælvingMedfødt anomaliMedfødt hjerneskadeMedfødt arthrogryposis MultiplexDysmorfismeEbstein’s anomaliMedfødt hjertesygdomHoloprosencephaliKlintefelters syndromFod deformitetPersisterende ductus arteriosusPersisterende føtal cirkulationSpina bifidaKlumpfodTrisomi 21Ventrikel septumdefektSygdomme i øret og labyrintenNeurosensorisk døvhedGenerelle symptomer og reaktionerAsteniNeonatal dødNeonatal seponeringssyndromHypertermiIrritabilitetInfektioner og infestationerDacrocystitis ( stenose i trårekanalen)Antal61112133321211411115111121111111511111131
Side 42
Neonatal conjunktivitisOral candidiasisUndersøgelser og laboratoriesvarHjertefrekvens nedsatStofskifte og ernæringsbetingede symptomerAcidoseNeonatal spiseforstyrrelseHypocalciæmiSymptomer fra muskel og skeletFod deformitetNeonatal hypertoniNeonatal hypotoniFod deformitetMuskelspasmerMuskeltrækningerMaligne og benigne neoplasmerHæmangiomSymptomer fra nervesystemetAutismeCerebral lidelseNeonatale krampeanfaldKoncentrationsbesværNeonatal encefalopatiNeonatal dyskinesiHypertoniHypotoniLennox-Gastaut syndromForsinket motorisk udviklingMyoklonusSerotonin syndromNeonatal stærk sovetrangTremorNeonatal tremorHændelser knyttet til graviditetenAbortMissed abortSpontan abortFøtalt distress syndromFøtal væksthæmningIntrauterin dødMekonium i amnionvæskenNeonatal lidelsePrematurt barnPrematur labourSmall for datesPsykiatriske lidelser
1111513181211211120113111111112131204221131121210
Side 43
AgitationNeonatal agitationInitial søvnløshedForsinket psykomotorisk udviklingRastløshedSkrigSymptomer fra respirationsvejeneApnøNeonatal asfyksiNeonatal respirationssvigtBlødning i lungerneForøget tryk i lungekredsløbetNeonatal lungeødemUnormal respirationNeonatal respirationsforstyrrelseRespiratorisk distressRespirationssvigtSymptomer fra karsystemetCirkulatorisk kollapsBleghedTotalt
121312121211111112211137
Side 44
Bilag 3Referencer:1
Sundhedsstyrelsen. Referenceprogram for unipolar depression hos voksne 2007.
2
Bennett HA et al. Prevalence of depression during pregnancy: systematic review, Obstet Gynecol. 2004Apr;103(4):698-709.Bennett HA et al. Depression during Pregnancy: Overview of Clinical Factors, Clin Drug Investig. 2004;24(3):157-79.Bonari L et al. Perinatal risks of untreated depression during pregnancy. Can J Psychiatry. 2004 Nov;49(11):726-35.
3
4
Nancy K. et al. A Meta-analysis of Depression During Pregnancy and the Risk of Preterm Birth, Low Birth Weight,and Intrauterine Growth Restriction. Archives of General Psychiatry, 2010;67(10):1012-1024.6
5
Sundhedsstyrelsen. Referenceprogram for unipolar depression hos voksne 2007.
7
McElhatton PR et. al. The outcome of pregnancy in 689 women exposed to therapeutic doses of antidepressants. Acollaborative study of the European Network of Teratology Information Services (ENTIS). Reprod Toxicol. 1996 Jul-Aug;10(4):285-94.Malm et. al. Risks associated with selective serotonin reuptake inhibitors (SSRIs) in Pregnancy, poster at the ENTISmeeting Haarlem, 3-5 september 2005. Abstract in Reproductive Toxicology 20 (2005) 453-491.
8
Malm et. al. Selective serotonin reuptake inhibitors and risk for major congenital anomalies.Obstet Gynecol. 2011 Jul;118(1):111-20.Diav-Citrin O, Schlechtman S, Weinbaum D, Arnon J, Di Gianantonio E, Clementi C, Ornoy A. Paroxetine and fluo-xetine in pregnancy: a muliticenter, prospective, controlled study. Reprod Toxicol 2005; 20:459.Källén BA, Otterblad Olausson P. Maternal use of selective serotonin re-uptake inhibitors in early pregnancy andinfant congenital malformations. Birth Defects Res A Clin Mol Teratol. 2007 Apr;79(4):301-8.Udechuku A et. al. Antidepressants in pregnancy: a systematic review.Aust N Z J Psychiatry. 2010 Nov;44(11):978-96. Review..13121110
9
Chambers C. Selective serotonin reuptake inhibitors and congenital malformations. BMJ. 2009 Sep 23;339:b3525.
Pedersen LH, Henriksen TB, Vestergaard M, Olsen J, Bech BH. Selective serotonin reuptake inhibitors in pregnancyand congenital malformations: population based cohort study. BMJ. 2009 Sep 23;339:b3569.15
14
Wogelius P et. al. Maternal use of selective serotonin reuptake inhibitors and risk of congenital malformations. Epi-demiology. 2006 Nov;17(6):701-4.Diav-Citrin O et. al. Paroxetine and fluoxetine in pregnancy: a prospective, multicentre, controlled, observationalstudy. Br J Clin Pharmacol. 2008 Nov;66(5):695-705. Epub 2008 Jul 11.
16
Einarson A et. Al. Incidence of major malformations in infants following antidepressant exposure in pregnancy: re-sults of a large prospective cohort study. Can J Psychiatry. 2009 Apr;54(4):242-6.18
17
Chambers CD et .al. Birth outcomes in pregnant women taking fluoxetine . N Engl J Med 1996; 335:1010–5.
19
Pastuszak A et.al. Pregnancy outcome following first-trimester exposure to fluoxetine (Prozac) . JAMA 1993;269:2246–8.
Side 45
Oberlander TF et. al. Effects of timing and duration of gestational exposure to serotonin reuptake inhibitor antide-pressants: population-based study . Br JPsychiatry 2008; 192:338–43.Alwan S et al. Use of selective serotonin-reuptake inhibitors in pregnancy and the risk of birth defects . N Engl J Med2007; 356:2684–92.Louik C et. al. First-trimester use of selective serotonin-reuptake inhibitors and the risk of birth defects . N Engl JMed 2007; 356:2675–83.Pedersen LH, Henriksen TB, Vestergaard M, Olsen J, Bech BH. Selective serotonin reuptake inhibitors in pregnancyand congenital malformations: population based cohort study. BMJ. 2009 Sep 23;339:b3569.24232221
20
Wogelius P et. al. Maternal use of selective serotonin reuptake inhibitors and risk of congenital malformations. Epi-demiology. 2006 Nov;17(6):701-4.
Chambers CD et. al. Selective serotonin-reuptake inhibitors and risk of persistent pulmonary hypertension of thenewborn. New Engl J Med. 2006; 354:579-587.26
25
Kallen B, Olausson PO. Maternal use of selective serotonin re-uptake inhibitors and persistent pulmonary hyperten-sion of the newborn. Pharmacoepidemiol Drug Safety. 2008 ; 17:801-806.
Andrade et .al. Antidepressant medication use and risk of persistent pulmonary hypertension of the newborn. Phar-macoepidemiol Drug Safety. 2009; 18: 246-252.Fornaro E, Pan J, Belik J. Prenatal exposure to fluoxetine induces fetal pulmonary hypertension in the rat. Am J Res-pir Crit Care Med. 2007; 176: 1035-1040.Soufia M, Aoun J, Gorsane MA, Krebs MO. SSRIs and pregnancy: a review of the literature]. Encephale. 2010Dec;36(6):513-6. Epub 2010 Apr 3. Review. French.302928
27
Tuccori M, Montagnani S, Testi A, Ruggiero E, Mantarro S, Scollo C, Pergola A, Fornai M, Antonioli L, Colucci R,Corona T, Blandizzi C. Use of selective serotonin reuptake inhibitors during pregnancy and risk of major and cardi-ovascular malformations: an update. Postgrad Med. 2010 Jul;122(4):49-65. Review.
Favrelière S, Nourrisson A, Jaafari N, Pérault Pochat MC. [Treatment of depressed pregnant women by selectiveserotonin reup-take inhibitors: risk for the foetus and the newborn]. Encephale. 2010 Jun;36 Suppl 2:D133-8. Epub2009 Sep 19. Review. French.Ellfolk M, Malm H. Risks associated with in utero and lactation exposure to selective serotonin reuptake inhibitors(SSRIs). Re-prod Toxicol. 2010 Sep;30(2):249-60. Epub 2010 May 4. Review.3332
31
Field T. Prenatal depression and selective serotonin reuptake inhibitors. Int J Neurosci. 2010 Mar;120(3):163-7. Re-view.
Alwan S, Friedman JM. Safety of selective serotonin reuptake inhibitors in pregnancy. CNS Drugs. 2009;23(6):493-509. Review.Cantor Sackett J, Weller RA, Weller EB. Selective serotonin reuptake inhibitor use during pregnancy and possibleneonatal complications. Curr Psychiatry Rep. 2009 Jun;11(3):253-7. Review.3635
34
Gentile S, Bellantuono C. Selective serotonin reuptake inhibitor exposure during early pregnancy and the risk of fetalmajor mal-formations: focus on paroxetine. J Clin Psychiatry. 2009 Mar;70(3):414-22. Epub 2009 Feb 24. Review.
Koren G, Boucher N. Adverse effects in neonates exposed to SSRIs and SNRI in late gestation--Motherisk Update2008. Can J Clin Pharmacol. 2009 Winter;16(1):e66-7. Epub 2009 Jan 22. Review.
37
Side 46
Lund N, Pedersen LH, Henriksen TB. Selective serotonin reuptake inhibitor exposure in utero and pregnancy out-comes. Arch Pediatr Adolesc Med. 2009 Oct;163(10):949-54.39
38
Croen LA et. al. Antidepressant Use During Pregnancy and Childhood Autism Spectrum Disorders. Arch Gen Psy-chiatry. 2011 Jul 4 [Epub ahead of print].Diem SJ, et al. Use of antidepressants and rates of hip bone loss in older women: the study of osteoporotic fractures.Arch Intern Med. 2007; 167: 1240-1245.
40