Sundheds- og Forebyggelsesudvalget 2011-12
SUU Alm.del Bilag 172
Offentligt
Kontinuerlig Glukose Monitorering
En rapportudarbejdet af en arbejdsgruppe underDansk Endokrinologisk SelskabogDansk Pædiatrisk Selskab
IndholdIndledningBaggrundKommissoriumTeknologiUdbredelseEffekt og evidensPeriodisk CGMVedvarende CGMBørn og unge med diabetesVoksne med type 1 diabetesGraviditet med diabetesType 2 diabetesBivirkningerØkonomi og organiseringØkonomi ved CGMOrganiseringKonklusion og rekommandationReferenceliste3467881010111213141414161718
2
Indledning
Kontinuerlig glukosemonitorering (continuous glucose monitoring (CGM)) er en relativt nyteknologisk tilgang til glukosemåling ved diabetes. I Danmark lanceredes det førstekommercielt tilgængelige CGM system til klinisk brug i 2002. På dette tidspunkt kunnedata ikke ses og bruges af patienterne, idet de først blev tilgængelige efter downloading idiabetesklinikkerne. I 2005 tilkom CGM med ”real-time” værdier, som umiddelbart kunneaflæses og bruges af patienterne i dagligdagen. I Danmark er aktuelt (august 2010)markedsført ét CGM system, og yderligere to godkendte systemer forventes introduceret inærmeste fremtid. Teknologien gennemgår i disse år en rivende udvikling, og CGM udgøri dag et lovende supplement til eksisterende monitoreringsmuligheder. Der hersker dognogen usikkerhed om teknologiens plads i klinisk praksis. I fremtiden forventes CGM atindgå som en integreret del i feedback baserede systemer til nærfysiologiskinsulinbehandling - såkaldte closed-loop systemer.Konventionelt vurderes glukosekontrol ved diabetes ved hjælp af en blodprøve – HbA1c –ud fra hvilken det gennemsnitlige glukoseniveau i den forudgående tremåneders periodekan estimeres. Denne prøve giver dog ingen information om glukosevariationen ihverdagen. Punktmålinger af kapillærglukosekoncentrationen foretaget af patienterne selv(self-monitored blood glucose (SMBG)) i hverdagen har tidligere været den enestemulighed for at få indblik i daglige glukoseudsving. Imidlertid kan det være vanskeligt atopnå overblik selv hos patienter som måler ofte (4-7 gange dagligt), og flertallet afpatienter måler væsentlig sjældnere. En mindre gruppe patienter med type 1 diabetes oghypoglycaemia unawareness (mistet evne til at erkende hypoglykæmi) benytter SMBG optil 10-15 gange dagligt for at opdage blodsukkerfald, som hos disse patienter ubehandletkan føre til svær hypoglykæmi, evt. med bevidstløshed (insulinshock). SMBG foretageskun særdeles sparsomt om natten. Hyppig SMBG er forbundet med bedre diabeteskontrol.I forhold til SMBG giver CGM mulighed for løbende vurdering af glukoseniveauet ogkræver kun enkelte daglige kalibreringer med SMBG. Teknologien giver endvideremulighed for overvågning af det natlige glukoseniveau uden at søvnen afbrydes. Endeligkan der tilknyttes alarmfunktioner, som kan gøre patienten opmærksom på hændelserf.eks. for højt eller lavt glukoseniveau eller optræk til dette.Som al anden ny teknologi har CGM været gennem en fase omfattet af skepsis ogusikkerhed, bl.a. fordi de eksisterende metoder baseres på måling af glukose i subkutis ogaltså ikke - som traditionelt - i blodet. Endvidere har de første generationer været behæftetmed betydelig måleusikkerhed især i det lave område, hvor præcisionen er mest kritisk.Som tidligere anført sker der en hastig udvikling på området og mange afbegyndervanskelighederne er nu overvundet.
3
Teknologien er aktuelt indført i nogle danske diabetesklinikker, men tiden er nu moden tilmere organiseret implementering i klinisk praksis. På baggrund af dette har DanskEndokrinologisk Selskab taget initiativ til at nedsætte en arbejdsgruppe med henblik på atvurdere kontinuerlig glukosemonitorering. Arbejdsgruppen har haft flg. kommissorium:a. At beskrive de teknologiske løsninger, der foreligger i øjeblikket.b. At beskrive udbredelsen af kontinuerlig glukosemonitorering i Europa og/ellerSkandinavien og belyse de økonomiske forhold, der er gældende i forhold til etablering(indkøb af apparatur og utensilier) og fortsættelse af anvendelsen.c. På baggrund af den videnskabelige litteratur at vurdere effekten og evt. bivirkningerved kontinuerlig glukosemonitorering hos patienter med type 1 og type 2 diabetes iforhold til hjemmeblodglukosemåling.d. At udarbejde forslag til ensartede indikationer for anvendelsen og organisering samtkvalitetskontrol af kontinuerlig glukosemonitorering.e. At gennemføre en mini MTV vedrørende kontinuerlig glukosemonitorering.I forhold til dette kommissorium har arbejdsgruppen følgende bemærkninger:1. På grund af den hastige teknologiske udvikling på området samt det store antaligangværende studier er det vigtigt at understrege, at rapporten tegner etøjebliksbillede. Dette gælder særlig evidensniveauerne, som kan forventes at ændresbetydeligt indenfor få år. Rapporten anbefales derfor revideret indenfor tre til fem år.2. Arbejdsgruppen har ikke fundet, at der på nuværende tidspunkt foreligger data, somkan danne basis for en egentlig MTV, og har derfor begrænset sig til at beskrive deøkonomiske forhold omkring brugen.
Udarbejdelsen af rapporten er sket i perioden december 2009 - august 2010. Rapporten erefterfølgende revideret efter høringssvar fra medlemmerne i Dansk EndokrinologiskSelskab samt Endokrinologiudvalget i Dansk Pædiatrisk Selskab.
Arbejdsgruppen har haft flg. sammensætning:Henrik Ullits Andersen,overlæge dr.med., Steno Diabetes CenterJens Sandahl Christiansen,professor, overlæge dr.med., Aarhus UniversitetshospitalSøren Gregersen,afdelingslæge PhD, Aarhus UniversitetshospitalPeter Gustenhoff,overlæge, Aalborg UniversitetshospitalClaus Juhl,overlæge, PhD., Sydvestjysk Sygehus EsbjergElisabeth Mathiesen,professor, overlæge dr.med., RigshospitaletKirsten Nørgaard,overlæge dr.med., Hvidovre HospitalBirthe Olsen, overlæge, Glostrup HospitalUlrik Pedersen-Bjergaard,overlæge dr.med., Hillerød Hospital (formand)
4
Interessekonflikter:Henrik Ullits Andersen: Modtaget støtte til forskning i form af udlån af CGM-monitorer fra Medtronic iperioden 2009-2011.Jens Sandahl Christiansen: På vegne af European Society of Endocrinology medlem af EndocrineSociety´s task force til udarbejdelse af CGM guidelines.Søren Gregersen: IngenPeter Gustenhoff: IngenClaus Juhl: Deltidsansat i Hyposafe A/SElisabeth Mathiesen: Modtaget støtte til forskning i form af udlån af CGM-monitorer fra Medtronic iperioden 2009-2011.Kirsten Nørgaard: Medlem af Advisory Board for Education (Medtronic), medlem af styrekomitéen for eteuropæisk studie initieret af Medtronic, modtaget støtte fra Medtronic til forskningsstudie (2007-2009).Birthe Olsen: investigator i et internationalt studie initieret af Medtronic..Ulrik Pedersen-Bjergaard: Modtaget støtte til forskning i form af CGM-udstyr leveret af MiniMed (senereMedtronic) i perioden 2000-2002.
5
Teknologi
Egenmåling af glukose (SMBG) har siden introduktionen i 1970erne vundet stigendeudbredelse i store dele af verden. SMBG er i dag en integreret del af egenomsorgen veddiabetes og tjener følgende hovedformål: 1) akut vurdering af glukoseniveauet medhenblik på evt. korrektion; 2) dataindsamling med henblik på vurdering af dengrundliggende diabetesbehandling. Indførelsen af SMBG har medvirket til genereltforbedret diabetesregulation og øget den enkelte patients mulighed for at undgå episodermed hypo- og hyperglykæmi. Høj frekvens af SMBG er forbundet med goddiabetesregulation.Metodengiverimidlertidblotetøjebliksbilledeafblodglukosekoncentrationen, og en stor andel af patienterne måler i praksis så sjældent, atkun et mindretal af de hypo- eller hyperglykæmiske episoder registreres.Siden slutningen af 1960´erne har man arbejdet på at udvikle pålidelige apparater tilkontinuerlig glukosemonitorering (CGM) ud fra en antagelse om, at de ville kunne bidragetil en bedre gennemsnitlig glukoseregulation og reducere risikoen for hypo- oghyperglykæmi (1,2). De kommercielt tilgængelige CGM systemer bestemmer alle glukose iinterstiel væske (interstitial fluid (ISF)) ved hjælp af en sensor i subkutis. ISF glukose kanbestemmes ved en række forskellige metoder (3). Amperometriske enzymelektroder, somf.eks. glukoseoksidase elektroder måler ISF glukosekoncentrationen omkring elektrodenog genererer et elektrisk signal, som transmitteres til en modtagerenhed. Mikrodialyse erbaseret på udhentning af et dialysat gennem et subkutant mikrodialysekateter, som sikrerligevægt med ISF glukose. Selve glukosemålingen foregår ekstrakorporalt.Brugen af ISF glukose som surrogatmål for blodglukose forudsætter ligevægt mellemglukosekoncentrationerne i de to kompartments. Glukose bevæger sig da også frit fra blodtil ISF, dog med en forsinkelse på 5-10 minutter (4), som også er beskrevet for andrekompartments som muskler og hjerne (5). Denne forsinkelse har betydning for real-timebrug af CGM, idet der ved dynamiske ændringer i blodglukose kan opstå betydeligegradienter i forhold til ISF. Dette var væsentligt i de første generationer af CGM, hvor deobserverede forskelle var kilde til skepsis overfor ISF baseret CGM. Måleusikkerheden varaf særlig stor klinisk betydning i det hypoglykæmiske område (6). Udviklingen af meresofistikerede algoritmer har nu i nogen grad reduceret dette problem.De første CGM systemer tillod kun retrospektiv analyse af data, og glukosemålingerne varderfor blindede for patienten under brugen og først tilgængelige efter downloading idiabetesklinikken. Flere systemer var endvidere behæftede med betydeligt besvær forpatienten i klinisk praksis. Anvendeligheden var derfor begrænset. Udviklingen er sidengået i retning af real-time CGM teknologi, som giver patienten løbende adgang til aktuelledata.Der findes for tiden tre FDA godkendte apparater til real-time CGM fra firmaerne Medtronic(MiniMed Guardian RT/Paradigm REAL-time�), Abbott (Freestyle Navigator �) ogDexCom (Seven Plus �). Alle tre systemer er baseret på en variant af glukoseoksidase
6
elektroden og består af en sensor, en sender og en modtager. De aktuelle glukose-målinger vises på et display, som opdateres med få minutters interval og data lagresendvidere til senere analyse. Apparaterne er valideret i flere studier (7). Kun Medtronicssystem findes aktuelt på det danske marked. De to øvrige systemer forventes markedsførther i landet i nærmeste fremtid. Et simpelt apparat (iPro) fra Medtronic til retrospektiv CGMblev markedsført i Danmark i efteråret 2010.Systemerne kræver alle kalibrering med en SMBG-værdi, typisk målt hver 12. time.Fabrikantens oplysning om sensorens levetid er for alle systemer 6 til 7 dage. DexComsapparat kan både anvendes til real-time og blindet monitorering.Nøjagtigheden af de enkelte apparater bedres løbende og er f.eks. udtrykt i mean absolutedifference (MAD) på målinger udført på CGM sammenlignet med SMBG (8). For voksne erMAD således for DexComs 7 dages sensor 15.7 %, for Navigator Freestyle 14.4 % og forMedtronic RT 15.2 %. De nævnte CGM systemer indeholder alarmfunktioner, trend-pile ogevent markører, og tilbyder alle software til downloading og brugervenlig visualisering afglukosedata.For nærværende anbefales det at alle glukoseværdier, der kræver handling (for lave ellerfor høje), bekræftes ved SMBG. I praksis anvender de fleste patienter alligevel ofteværdierne til handling.Medtronic har integreret real-time CGM teknologien i deres nyeste insulinpumperParadigm 522/722 og Paradigm Veo. Disse pumper kan fungere som modtager for entilhørende CGM sender og løbende vise glukosedata i pumpens display. I tilfælde af CGMdetekteret hypoglykæmi kan afgives en alarm. Paradigm Veo pumpen har yderligeremulighed for automatisk pausering af insulininfusionen i tilfælde af, at en hypoglykæmi-alarm ignoreres af patienten.
Udbredelse
Retrospektiv, blindet CGM har siden introduktionen i Danmark primært været brugt tilforskning. Real-time CGM har overvejende været anvendt i klinisk praksis hos udvalgtepatienter. Anvendelsen har været stigende på en række danske diabetescentre.
7
Periodisk CGM (f.eks. af 6 dages varighed) tilbydes af en række diabetescentre som etmiddel til sammen med patienten at afdække problemer i relation til glukoseregulationen,primært ved type 1 diabetes. Der foreligger ingen data vedr. omfanget af anvendelse afCGM til dette formål.Vedvarende CGM benyttes ved flere danske diabetesklinikker sammen med insulinpumpeeller penbehandling med henblik på at opnå eller bibeholde god glukosekontrol og/ellerforebygge tilfælde med svær hypoglykæmi. Eksakte data vedr. omfanget af denne brugforefindes heller ikke, men det anslås, at der i Danmark aktuelt er omkring 90 patientersom vedvarende bruger CGM i kombination med insulinpumpe. Dette svarer til ca. 6 % afpatienter i behandling med insulinpumpe. Disse er hovedsageligt voksne og størstedelenbehandles på Hvidovre Hospital (ca. 45) og Steno Diabetes Center (15-20). Øvrige centreformodes hver at have under 5 insulinpumpe behandlede patienter med kontinuerlig CGM.Hertil kommer anslået 20 patienter i flergangs-penterapi som anvender vedvarende CGM.Det er forventeligt at udbredelsen og brugen af CGM i Danmark vil øges i de kommende åri takt med at erfaringen øges og teknikken forbedres.
Effekt og evidens
Periodisk CGM
Rekommandation:- Periodisk CGM bør kunne tilbydes patienter med type 1 diabetes med henblik på
at identificere problemer i relation til glukoseregulationen og herved søge at
bedre den glykæmiske kontrol. Hvorvidt der vælges blindet eller real-time CGM
må afhænge af problematik og præference. Periodisk CGM rekommanderes ikke
til type 2 diabetes.
8
BaggrundCGM kan anvendes periodisk (ad hoc) som et værktøj til indsamling af data vedrørendeglukoseudsving. Disse data vil kunne bidrage til et rationelt grundlag for forslag tilændringer i insulinregime og doser samt ændringer i adfærdsmønster for patienten f.eks.omkring kost og motion.De fleste behandlere som har benyttet CGM har erfaring for, at der ofte kan identificeresproblemer i diabetesregulationen, som ikke har kunnet påvises ved SMBG. Således erCGM SMBG overlegen i udredningen af en række specifikke tilstande som f.eks. natlighypo- eller hyperglykæmi, postprandial hyperglykæmi og hypoglycaemia unawareness (6).Denne erfaring underbygges af en del ukontrollerede studier. Hos voksne med type 1diabetes foreligger et randomiseret studie, der belyser denne brug af CGM sammenlignetmed SMBG. I studiet kunne ikke påvises forskel i HbA1c 3 måneder efter interventionbaseret på 3 dages (d.v.s. meget kortvarig) blindet CGM ved indgang, hvorimod tiden ihypoglykæmi ved opfølgende CGM efter 3 måneder var signifikant kortere i CGM gruppenend i SMBG gruppen (ca. 50 vs. 80 minutter per episode) (9). I et andet studie blev enbred population af dårligt regulerede børn (ældre end 8 år) og voksne randomiseret til ikkeat anvende CGM eller til at anvende ublindet CGM enten vedvarende eller periodisk 3dage hver anden uge en 3 måneders periode. I gruppen der anvendte periodisk CGM såsen ikke-signifikant reduktion på 0,7 % i HbA1c sammenlignet med kontrolgruppen, mensder var signifikant reduktion i gruppen der anvendte CGM vedvarende – se senere (10).Hos børn og unge med type 1 diabetes har mindre ikke-randomiserede studier peget på,at periodisk brug af ublindet CGM kan medføre faldende HbA1c sv.t. 0,2-0,4 % ogjusteringer i diabetesbehandlingen, der på længere sigt medfører en forbedret metaboliskkontrol (11,12,13). Der foreligger ikke randomiserede CGM studier omhandlende småbørn. Begrænsede data fra ikke-randomiserede studier peger yderligere på at CGM medfordel kan benyttes i denne aldersgruppe til afdækning af natlig hypoglykæmi ogpostprandial hyperglykæmi (14,15).Ved type 2 diabetes foreligger ét studie baseret på real-time CGM (16), hvor man fandt etfald i HbA1c på 1,1 % i gruppen, der anvendte real-time CGM intermitterende og 0,4 % ikontrolgruppen efter 3 måneder, men flere længere og større studier må afventes indenanbefalinger kan gives.Såvel blindet CGM som real-time CGM kan bruges periodisk. En fordel ved blindet CGMkan være at dataindsamlingen kan foregå med et minimum af samtidig intervention, hvilketkan lette diagnosen af glykæmiske problemer i nogle tilfælde. Omvendt tillader real-timeCGM umiddelbar intervention, hvilket mange vil foretrække i klinisk praksis. Samlet set erevidensen aktuelt stærkest for brug af blindet CGM til periodisk intervention, men dette måforventes at ændre sig i nærmeste fremtid. Der foreligger ingen studier, der direktesammenligner effekten af blindet og real-time baseret periodisk CGM intervention.
9
Vedvarende real-time CGM
Børn og unge med diabetes
Rekommandation:- Vedvarende real-time CGM bør kunne tilbydes udvalgte børn og unge med type
1 diabetes i behandling med basal-bolus regime eller insulinpumpe. Det gælder
patienter med tendens til svær hypoglykæmi og/eller med utilfredsstillende
glykæmisk kontrol d.v.s. med HbA1c over det fastsatte individuelle mål. Det er en
forudsætning, at patienten skønnes reelt interesseret i og motiveret for
konsekvent og vedvarende anvendelse af CGM.
BaggrundSMBG er et vigtigt redskab, der kan hjælpe børn med diabetes og deres forældre med attage relevante beslutninger i forhold til mad, motion, insulin og andre ofte uforudsigeligevariable. Gennem de seneste 10-15 år er der sket en signifikant stigning i antallet afdaglige SMBG blandt danske børn og unge med type 1 diabetes. Dette er korreleret til etsignifikant fald i HbA1c i samme periode, men på trods af dette er den metaboliske kontrolstadig ikke tilfredsstillende (17). Almindelig SMBG afspejler et øjebliksbillede, og det er vistat både høje og lave værdier overses. Dette forekommer specielt hyppigt om natten, hvorbørn i relativt lange perioder kan have lavt blodsukker, uden at dette opdages (14,18).I 2008 kom resultaterne fra Juvenile Diabetes Research Foundation (JDRF) CGM Studiet,hvor 322 voksne og børn med type 1 diabetes og intensiv diabetes behandling blevrandomiseret til vedvarende real-time CGM eller SMBG i 6 måneder (19). Patienterne blevinddelt i aldersgrupper: 8-14 år, 15-24 år og > 25 år. I modsætning til den voksne gruppesom anvendte CGM 83 % af tiden, var der i de to yngste aldersgrupper efter 6 månederikke signifikant forskel i HbA1c mellem interventions- og kontrolgruppe, men beggegrupper brugte CGM signifikant mindre end de voksne: i aldersgrupperne 8-14 år og 15-24år henholdsvis: 50 % og 30 %. Post hoc analyser af data fra studiet har da også vist atbørn og unge, der benyttede CGM 6-7 dage om ugen, havde en signifikant reduktion iHbA1c på 0,7 % efter 6 måneder, og at reduktionen var signifikant større end hos børn,der benyttede CGM mindre end 6 dage om ugen (20). I gruppen af børn og unge med godmetabolisk kontrol (HbA1c under 7 %) reduceredes den daglige tid i hypoglykæmisignifikant med 37 minutter pr. dag, mens der ikke sås nogen reduktion i kontrolgruppen.Der var i undersøgelsen ikke forskel i forekomsten af svær hypoglykæmi.
10
Flere mindre randomiserede studier har tidligere ligeledes vist, at HbA1c kan reducereshos intensivt behandlede børn og unge med type 1 diabetes, hvis CGM benyttes efterforskrifterne (10,21,22).Det kan være vanskeligt at implementere længerevarende CGM hos børn og unge medtype 1 diabetes (19,23). En årsag kan være, at børn har færre muligheder for at ændresensor placering og ofte har hudproblemer i forbindelse med insertionsstedet (24). Posthoc analyserne viser også, at prædiktorer for succesfuld langvarig brug af CGM er højerealder og hyppig SMBG før starten af studiet (22).
Voksne med type 1 diabetes
Rekommandation:- Vedvarende real-time CGM bør kunne tilbydes udvalgte voksne type 1 diabetes
patienter i behandling med basal-bolus regime eller insulinpumpe. Det gælder
patienter med tendens til svær hypoglykæmi og/eller med utilfredsstillende
glykæmisk kontrol d.v.s. med HbA1c over det fastsatte individuelle mål. Det er en
forudsætning, at patienten skønnes reelt interesseret i og motiveret for
konsekvent og vedvarende anvendelse af CGM.
BaggrundFor voksne patienter med type 1 diabetes som ikke har opnået god glukosekontrol (HbA1c> 7.0 %) har flere studier vist en større reduktion i HbA1c med CGM-baseret interventionend ved hyppig SMBG (10,19,25). I JDRF CGM Studiet fandtes en forskel i HbA1c på 0,53% mellem grupperne efter 6 måneder (19). Forbedringen i HbA1c observeret efter 6måneder var bibeholdt i en 6-måneders forlængelse af studiet trods reduktion i antalambulatoriebesøg til et niveau som ved almindelig rutine kontrol (26). Reduktionen iHbA1c baseret på CGM intervention blev opnået uden øgning i forekomsten afhypoglykæmi, som det ellers ses ved intensivering af glykæmisk kontrol baseret på SMBG(10,18). Incidensen af svær hypoglykæmi faldt således fra 20.5 episoder per 100 patient-år i de første 6 måneder til 12.1 episoder per 100 patient-år i det opfølgende halve år. Forganske nylig har man fra JDRF CGM studiet rapporteret resultater af CGM anvendelse iden oprindelige kontrolgruppe (27). I denne gruppe har man implementeret CGM i et rutineambulant set-up med minimal tid til træning og opfølgning og kun 4 ambulante besøg på 6måneder. Man observerede at voksengruppen reducerede HbA1c signifikant med 0,4 %,og tiden der blev tilbragt i både hypo- og hyperglykæmi blev reduceret signifikant.Endvidere sås en tendens til færre svære hypoglykæmi tilfælde (15 vs. 28 episoder/100
11
patient-år, p=0.08). Et enkelt studie har vist, at ved opstart af insulinpumpe reduceresHbA1c signifikant mere (1.23 % vs. 0.55 %) ved samtidig opstart med CGM sammenlignetmed SMBG (28). En helt nyligt publiceret undersøgelse viste samstemmende hermed en0,6 % lavere HbA1c efter ét år i en gruppe behandlet med insulinpumpe og vedvarendeCGM sammenlignet med multiple dose behandling (29).Patienter med HbA1c 7.0 % eller lavere har i sagens natur ikke noget stort potentiale medhensyn til forbedring af HbA1c men har ligeledes vist sig at have gavn af CGM. I JDRFstudiet viste disse patienter sig således at have et signifikant fald i biokemisk hypoglykæmitrods uændret lav HbA1c (30). Incidensen af svær hypoglykæmi i denne kohorte var 23.6episoder per 100 patient-år i de første 6 måneder og 0 i de opfølgende 6 måneder efterdet randomiserede studie. I gruppen med HbA1c under 7 % ved baseline sås efter 6måneder at signifikant flere i CGM gruppen formåede at bibeholde den lave HbA1c end ikontrolgruppen (59 % vs. 38 %).Også hos voksne er effekten af CGM betinget af konsekvent brug. Flere undersøgelserviser at effekten af CGM er associeret med høj compliance, således at patienterudelukkende har effekt på HbA1c, hvis CGM anvendes mere end 4 dage om ugen (22,29).
Gravide med diabetes
Rekommandation:- Vedvarende real-time CGM bør kunne tilbydes udvalgte kvinder med type 1
diabetes patienter før og under graviditet. Det gælder patienter med tendens til
svær hypoglykæmi og/eller med utilfredsstillende glykæmisk kontrol d.v.s. med
HbA1c over det fastsatte individuelle mål. Det er en forudsætning for CGM, at
patienten skønnes reelt interesseret i og motiveret for konsekvent og vedvarende
anvendelse før og under graviditeten.
BaggrundDiabetiske graviditeter er forbundet med en forhøjet incidens af maternelle, føtale ogneonatale komplikationer, som kan minimeres ved intensiv glykæmisk kontrol før og undergraviditeten. Optimal glykæmisk kontrol i perioden op til graviditeten er således yderstvigtig for at undgå kongenitte misdannelser. Under graviditeten er stram glukosekontrolvigtig af hensyn til at sikre normal fostertilvækst og undgå maternelle komplikationer. I
12
første trimester er optimal kontrol en særlig vanskelig udfordring pga. en stærkt forøgetrisiko for svær hypoglykæmi.Der foreligger ingen randomiserede studier af real-time CGM hos gravide kvinder medtype 1 eller 2 diabetes. Evidensen for at real-time CGM forbedrer en forhøjet HbA1c ogreducerer perioder med for høje eller – især - for lave glukoseværdier hos voksne medtype 1 diabetes er imidlertid robust og der er ingen umiddelbar grund til at det samme ikkeskulle være tilfældet under graviditet.Der findes dog en del kortvarige studier (31) som finder, at CGM er anvendelig til gravidemed diabetes. Et randomiseret studie omfattende 71 gravide kvinder med type 1 eller type2 diabetes har endvidere påvist, at gruppen der påbegyndte intermitterende CGM igraviditeten opnåede et lavere niveau af HbA1c svarende til 0,6 % i slutningen afgraviditeten og færre nyfødte, der var for store ved fødslen (large for gestational age) iforhold til kontrolgruppen (odds ratio 0.36) (32).CGM kan ikke anbefales til gravide med type 2 diabetes på grund af utilstrækkeligevidens.
Type 2 diabetes
Rekommandation:Vedvarende real-time CGM anbefales ikke ved type 2 diabetes.
BaggrundVedvarende real-time CGM har været anvendt som middel til optimering af HbA1c i etobservationelt studie omfattende 109 patienter med type 1 diabetes og 31 med type 2diabetes (33). Syv patienter var tabletbehandlede, resten fik insulin. HbA1c faldt signifikanthos patienterne med type 2 diabetes sv.t. 0,6 % efter 3 måneder, men flere længere ogstørre studier må afventes inden anbefalinger kan gives for denne type patienter.
13
Bivirkninger
Kutane bivirkninger i form af infektion i sensor-indstikskanalen er beskrevet og ses også iklinisk praksis (24). Ligeledes kan plaster-reaktioner forekomme (24). Herudover synesegentlige bivirkninger ikke at være rapporteret i litteraturen.
Økonomi og organisering
Rekommandation:Finansieringen af CGM bør afklares nationalt.
Alle centre, der behandler patienter med type 1 diabetes, bør kunne tilbyde CGM
evt. i form af samarbejdsaftale med CGM center. Alle centre, der forestår
insulinpumpebehandling bør kunne udføre CGM.
ØkonomiOmkostninger ved anvendelse af CGMDette afsnit sigter på at afklare de økonomiske aspekter i anvendelsen af CGM. Deforeliggende randomiserede kliniske studier tillader ikke beregning af eventuelle afledteøkonomiske konsekvenser som f.eks. en mulig reduktion i forekomsten af sendiabetiskekomplikationer eller svær hypoglykæmi, eller en evt. øget anvendelse afinsulinpumpebehandling som følge af diagnosticering af fluktuerende glukoseværdier.Beregningerne er foretaget ud fra listepriser, og der er således ikke medregnet mulighedfor rabatordninger. Der foretages separate beregninger for periodisk anvendelse af CGM iforbindelse med afklaring af glukoseprofiler og for vedvarende anvendelse af real-timeCGM.
14
Følgende variable er medregnetIndkøb af CGM-apparatIndkøb af engangsutensilier
Der er antaget en uændret anvendelse af SMBG. Den tid der anvendes i ambulatoriet tilmontering, instruktion, aflæsning og afledte aktiviteter er ikke medregnet, men der månaturligvis påregnes et tidsforbrug. Der er ikke medregnet spild, batteriforbrug,renseservietter, anvendelse af inserter (instrument til indføring af sensor). Holdbarheden afGuardian RT er fire år og Minilink et år. Sensoren kan anvendes i 6 dage. Priserne erangivet i kr. (april 2011).Periodisk CGM i forbindelse med afklaring af glukose-profilerForudsætning: Der foretages én måling svarende til en sensors funktionsvarighed, somforudsættes at være 6 døgn. Prisen angives per 6-døgns måling. Apparatet forventesanvendt 20 gange årligt og afskrives retlinjet fra indkøbspris til 0 kr. i løbet af den angivneholdbarhed. Prisen er således beregnet ud fra 80 målinger over 4 år.
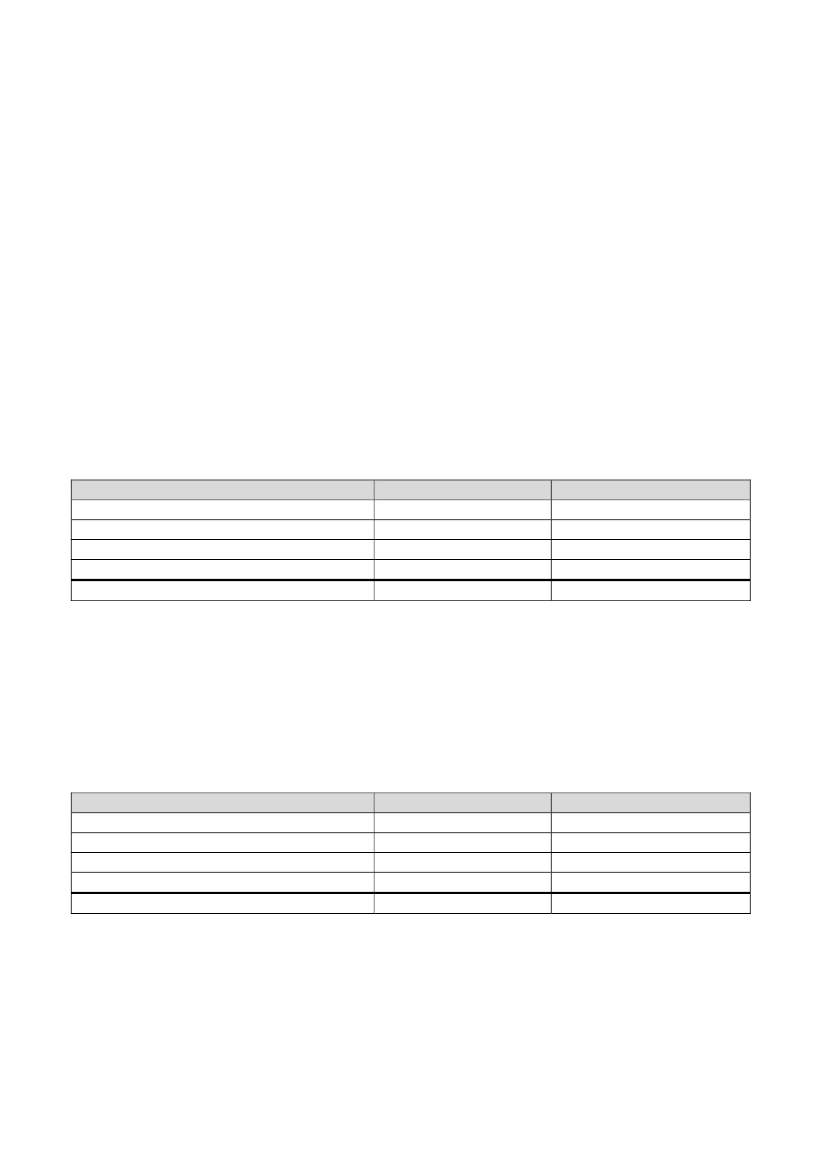
ProduktGuardian RT monitor incl 1 stk minilinkMinilink 3 stkSensor 80 stkTotalTotal per måling
Pris15.1353.995325
Ialt15.13511.98526.00053.120664
Vedvarende anvendelse af real-time CGMForudsætning: CGM anvendes 24 timer i døgnet. Sensoren anvendes i 6 dage. Apparatetafskrives retlinet over 4 år til 0 kr.
Model 1: Vedvarende anvendelse af Guardian RealtimeProduktGuardian RT monitor incl 1 stk minilinkMinilink 3 stkSensorer 244 stkTotalTotal per årPris15.1353.995325Pris for 4 år15.13511.98579.300106.42026.605
Model 2: Anvendelse af CGM sammen med Medtronic Paradigm-Realtime�/Veo� insulin-pumpe. Det er antaget at insulinpumpens holdbarhed er uændret ved anvendelse af CGMdelen.
15
ProduktMinilinkSensorerTotal per år
Pris3.995325
Pris per år3.99519.77023.765
I alle beregninger gælder, at der kan opnås en besparelse hos patienter der hyppigt målerblodglukose med SMBG. Besparelsen afhænger naturligvis af antal målinger før og underanvendelse af CGM og kan anslås til 8 kr. per måling svarende til 2880 kr. per år perdaglig sparet SMBG. En nylig cost-benefit analyse antyder at anvendelse af CGM ved type1 diabetes kan være omkostningseffektivt. Analysen er dog omfattet af betydeligusikkerhed og resultatet bør tages med forbehold (34).
TilskudSundhedsstyrelsen har meldt ud, at vedvarende real-time CGM må anses for etbehandlingsredskab, hvilket betyder, at alle udgifter i forbindelse hermed skal varetages afregionen. Da SMBG betales af kommunerne kan der herved foreligge en teoretisk risikofor interessekonflikt i forbindelse med behandling af tilskudsansøgning. Der foreligger i dagingen fast praksis på området og nogle patienter har fået bevilget tilskud til vedvarendereal-time CGM fra regionen, mens andre har opnået kommunalt tilskud. Der er et stortbehov for afklaring af området.
OrganiseringAlle patienter med type 1 diabetes bør have mulighed for CGM. Det betyder at alle centre,der behandler patienter med type 1 diabetes, bør kunne tilbyde CGM, evt. i form af ensamarbejdsaftale med et CGM-center. CGM er i lighed med insulinpumper et komplekstteknologisk hjælpemiddel i diabetesbehandlingen og teknologierne stiller på mangeområder de samme kompetencemæssige krav til behandlerteamet. Det vil derfor værehensigtsmæssigt at centre, der udfører insulinpumpebehandling, også kan udføre CGM.
16
Konklusion og rekommandation
CGM-teknologien udvikles hastigt og er på nuværende tidspunkt udviklet i en grad, somgør den anvendelig i klinisk praksis. CGM udgør sammen med insulinpumpen grundlagetfor udvikling af fremtidens closed-loop insulinbehandlingssystemer. I det følgende erhovedkonklusionerne i denne rapport summeret.1.Periodisk CGMhar dokumenteret effekt på hyppigheden af hypoglykæmi ved type1 diabetes.2.Periodisk CGMbør kunne tilbydes alle patienter med type 1 diabetes med henblikpå at identificere problemer i relation til glukoseregulationen og herved søge atbedre den glykæmiske kontrol. Hvorvidt der vælges blindet eller real-time CGM måafhænge af problematik og præference.3.Periodisk CGMrekommanderes ikke til type 2 diabetes.4. Ved type 1 diabetes er effekten afvedvarende real-time CGMen sænkning afHbA1c af størrelsesordenen 0,6 % uden omkostninger i form af hypoglykæmi. HvisHbA1c i forvejen er < 7 % kan opnås en reduktion af forekomsten af hypoglykæmi.5.Vedvarende real-time CGMbør kunne tilbydes udvalgte børn, unge og voksne,herunder gravide kvinder, med type 1 diabetes i behandling med basal-bolusregime eller insulinpumpe. Det gælder patienter med tendens til svær hypoglykæmiog/eller med utilfredsstillende glykæmisk kontrol d.v.s. med HbA1c over detfastsatte individuelle mål. Det er en forudsætning at patienten skønnes reeltinteresseret i og motiveret for konsekvent og vedvarende anvendelse af CGM.6.Vedvarende real-time CGManbefales ikke til voksne med type 2 diabetes.7.Finansieringenaf CGM bør afklares nationalt.8. Alle centre, der behandler patienter med type 1 diabetes, bør kunne tilbyde CGMevt. i form af samarbejdsaftale med CGM center. Alle centre, der forestårinsulinpumpebehandling bør kunne udføre CGM.9. Patienter der anvender vedvarende real-time CGM bør have præcist defineredeindividuelle behandlingsmål. Det bør således defineres om CGM anvendes medhenblik på optimering af den glykæmiske kontrol, en reduktion af hyppigheden afhypoglykæmi eller en anden konkret defineret effekt. Det bør årligt vurderes ompatienterne stadig opfylder kriterierne for anvendelse af CGM. Herunder bør detvurderes om patienterne anvender CGM tilstrækkeligt hyppigt til at opnå denønskede effekt.
17
Referenceliste1. Skyler JS. Continuous glucose monitoring: an overview of its development. Diabetes TechnolTher 2009;11 Suppl 1:S5-10.2. Oliver NS, Toumazou C, Cass AE, Johnston DG. Glucose sensors: a review of current andemerging technology. Diabet Med 2009;26:197-210.3. McGarraugh G. The chemistry of commercial continuous glucose monitors. Diabetes TechnolTher 2009;11 Suppl 1:S17-23.4. Cengiz E, Tamborlane WV. A tale of two compartments: interstitial versus blood glucosemonitoring. Diabetes Technol Ther 2009;11 Suppl 1: S11-16.5. Nielsen JK, Djurhuus CB, Gravholt CH, Carus AC, Granild-Jensen J, Orskov H, ChristiansenJS. Continuous glucose monitoring in interstitial subcutaneous adipose tissue and skeletalmuscle reflects excursions in cerebral cortex. Diabetes 2005;54:1635-1639.6. Høi-Hansen T, Pedersen-Bjergaard U, Thorsteinsson B. Reproducibility and reliability ofhypoglycaemic episodes recorded with Continuous Glucose Monitoring System (CGMS) indaily life. Diabet Med 2005;22:858-862.7. Sachedina N, Pickup JC. Performance assessment of the Medtronic-MiniMed ContinuousGlucose Monitoring System and its use for measurement of glycaemic control in Type 1diabetic subjects. Diabet Med 2003;20:1012-1015.8. Kovatchev B, Anderson S, Heinemann L, Clarke W. Comparison of the numerical and clinicalaccuracy of four continuous glucose monitors. Diabetes Care 2008;31:1160-1164.9. Tanenberg R, Bode B, Lane W, Levetan C, Mestman J, Harmel AP, Tobian J, Gross T,Mastrototaro J. Use of glucose monitoring system to guide therapy in patients with insulin-treated diabetes: A randomized controlled study. Mayo Clinic Proc 2004;79:1521-1526.10. Deiss D, Bolinder J, Riveline JP, Battelino T, Bosi E, Tubiana-Rufi N, Kerr D, Phillip M.Improved glycemic control in poorly controlled patients with type 1 diabetes using real-timecontinuous glucose monitoring. Diabetes Care 2006;29:2730-2732.11. Jeha SJ, Karaviti LP, Anderson B, Smith EO, Donaldson S, McGirk TS, Haymond MW.Continuous Glucose Monitoring and the reality of metabolic control in preschool children withtype 1 diabetes. Diabetes Care 2004;27:2881-2886.12. Ludvigson J, Hanas R. Continuous Glucose Monitoring improved metabolic control in pediatricpatients with type 1 diabetes: a controlled crossover study. Pediatrics 2003;111:933-938.13. Chase HP, Roberts MD, Wightman C, Klingensmith G, Garg SK, Van Wyhe M, Desai S,Harper W, Lopatin M, Bartkowiak M, Tamada J, Eastman RC. Use of the Gluco WatchBiographer in children with type 1 diabetes. Pediatrics 2003;111:790-794.
18
14. Gandrud LM, Xing D, Kollman C, Block JM, Kunselman B, Wilson DM, Buckingham BA. TheMedtronic MiniMed Gold Continuous Glucose Monitoring System: An effective means todiscover hypo- and hyperglycemia in children under 7 years of age. Diabetes Technol Ther2007;9:307-316.15. Kaufman FR, Gibson LC, Halvorson M, Carpenter S, Fisher LK, Pitukcheewanont P. A pilotstudy of the continuous glucose monitoring system: clinical decisions and glycemic control afterits use in pediatric type 1 diabetic subjects. Diabetes Care 2001;24:2030-2034.16. Yoo HJ, An HG, Park SY, Ryu OH, Kim HY, Seo JA, Hong EG, Shin DH, Kim YH, Kim SG,Choi KM, Park IB, Yu JM, Baik SH. Use of a real time continuous glucose monitoring systemas a motivational device for poorly controlled type 2 diabetes. Diabetes Res Clin Pract2008;82:73-79.17. Svensson J, Johannesen J, Mortensen HB, Nordly S; The Danish Childhood DiabetesRegistry. Improved metabolic outcome in a Danish diabetic paediatric population aged 0–18 yr:results from a nationwide continuous registration. Pediatr Diabetes 2009;10:461-467.18. Boland, Elizabeth, Monsod T, Delucia M, Brandt CA, Fernando S, Tamborlane WV. Limitationsof conventional methods of self-monitoring of blood glucose: Lessons learned from 3 days ofcontinuous glucose sensing in pediatric patients with type 1 diabetes. Diabetes Care2001;24:1858-1862.19. The Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group.Continuous glucose monitoring and intensive treatment of type 1 diabetes. N Engl J Med2008;359:1464-1476.20. The Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group.Factors predictive of use and of benefit from continuous glucose monitoring in type 1 diabetes.Diabetes Care 2009;32:1947–1953.21. Lagarde WH et al. Continuous subcutaneous glucose monitoring in children with type 1diabetes mellitus: a single-blind, randomized, controlled trial. Pediatric Diabetes 2006;7:159–164.22. Hirsch IB, Abelseth J, Bode BW, Fischer JS, Kaufman FR, Mastrototaro J, Parkin CG, WolpertHA, Buckingham BA. Sensor-augmented insulin pump therapy: Results of the first randomizedtreat-to-target study. Diabetes Technol Ther 2008;10:377-383.23. Chase HP, Beck R, Tamborlane W, Buckingham B, Mauras N, Tsalikian E, Wysocki T,Weinzimer S, Kollman C, Ruedy K, Xing D. A randomized multicenter trial comparing the GlucoWatch Biographer with standard glucose monitoring in children with type 1 diabetes. DiabetesCare 2005;28:1101-1106.24. Conwell LS, Pope E, Artiles AM, Mohanta A, Daneman A, Daneman D. Dermatologicalcomplications of continuous subcutaneous insulin infusion in children and adolescents. JPediatrics 2008;152:622-628.
19
25. O'Connell MA, Donath S, O'Neal DN, Colman PG, Ambler GR, Jones TW, DavisEA, CameronFJ. Glycaemic impact of patient-led use of sensor-guided pump therapy in type 1 diabetes: arandomised controlled trial. Diabetologia 2009;52:1250-1257.26. Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group.Sustained benefit of continuous glucose monitoring on A1c, glucose profiles, and hypoglycemiain adults with type 1 diabetes. Diabetes Care 2009;32;2047-2049.27. Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group.Effectiveness of continuous glucose monitoring in a clinical care environment. Diabetes Care2010;33:17-22.28. Raccah D, Sulmont V, Reznik Y, Guerci B, Renard E, Hanaire H, Jeandidier N, Nicolino M.Incremental value of CGM when starting pump therapy in poorly controlled patients with type 1diabetes; the Realtrend study. Diabetes Care 2009;32;2245-2250.29. Bergenstal RM, Tamborlane WV, Ahmann A, Buse JB, Dailey G, Davis SN, Joyce C, PeoplesT, Perkins BA, Welsh JB, Willi SM, Wood MA; STAR 3 Study Group. Effectiveness of sensor-augmented insulin-pump therapy in type 1 diabetes. N Engl J Med 2010;363:311-320.30. Juvenile Diabetes Research Foundation Continuous Glucose Monitoring Study Group. Theeffect of continuous glucose monitoring in well-controlled type 1 diabetes. Diabetes Care2009;32:1378–1383.31. Kerssen A, de Valk HW, Visser GH. Forty-eight-hour first-trimester glucose profiles in womenwiht type 1 diabetes mellitus: a report of three cases of congenital malformation. PrenatalDiagnosis 2006;26:123-127.32. Murphy HR, Rayman G, Lewis K, Kelly S, Johal B, Duffield K, Fowler D, Campbell PJ, TempleRC. Effectiveness of continuous glucose monitoring in pregnant women with diabetes:randomised clinical trial. BMJ 2008;337:a168033. Bailey TS, Zisser HC, Garg SK. Reduction in hemoglobin A1c with real-time continuousglucose monitoring: results from a 12-week observational study. Diabetes Technol Ther2007;9:203-210.34. Huang ES, O'Grady M, Basu A, Winn A, John P, Lee J, Meltzer D, Kollman C, Laffel L,Tamborlane W, Weinzimer S, Wysocki T; Juvenile Diabetes Research Foundation ContinuousGlucose Monitoring Study Group. The cost-effectiveness of continuous glucose monitoring intype 1 diabetes. Diabetes Care 2010;33:1269-1274.
20