Udvalget for Videnskab og Teknologi 2010-11 (1. samling)
UVT Alm.del Bilag 197
Offentligt
Rapport fra granskningskommisjonoppnevnt avRikshospitalet – Radiumhospitalet HF ogUniversitetet i Oslo 18. januar 2006Avgitt 30. juni 2006
Til Rikshospitalet Radiumhospitalet Helseforetak og Universitetet i OsloGranskningskommisjonen oppnevnt 18. januar 2006 legger med dette frem sin rapport.Rapporten er enstemmig.
Oslo, 30. juni 2006
Anders EkbomLederGro E M HelgesenAage TverdalTore LundeStein Emil Vollset-----Sigmund SimonsenSekretær
2
InnholdSammendrag............................................................................................................................51.1Oppnevning .....................................................................................................................51.2Granskningen ..................................................................................................................51.3Funn.................................................................................................................................51.4Kritikk, mulige forklaringer og forebyggende tiltak.......................................................71.5Kommisjonens rapport – en oversikt ..............................................................................82Kommisjonens oppnevning, mandat og arbeidsmåte............................................................102.1Oppnevning av granskningskommisjonen ....................................................................102.2Kommisjonens sammensetning.....................................................................................102.3Kommisjonens mandat..................................................................................................102.4Kommisjonens rettslige status, rettslige rammer, sakshandlingsregler og prinsipper igranskningsprosessen ................................................................................................................112.4.1Kommisjonens rettslige status...............................................................................112.4.2Habilitet og uavhengighet .....................................................................................122.4.3Rettslige virkemidler .............................................................................................132.4.4Utredningsprinsippet og forsvarlighetsprinsippet .................................................132.4.5Kontradiksjon ........................................................................................................132.4.6Beviskrav og terskler for kritikk ...........................................................................142.4.7Uskyldspresumsjonen............................................................................................152.4.8Offentlighet ...........................................................................................................152.5Kommisjonens forhold til mandatet..............................................................................162.6Nærmere om kommisjonens arbeidsmåte .....................................................................172.6.1.Generelt .................................................................................................................172.6.2Møtevirksomhet ....................................................................................................172.6.3Informasjonsinnhenting.........................................................................................172.6.4God vitenskapelig praksis, normavvik og uredelighet ..........................................193Regulering av medisinsk forskning.......................................................................................213.1Oversikt over gjeldende regelverk ................................................................................213.2Ulike grader av normavvik, skyld og kritikkverdighet .................................................243.3Personlig ansvar og overordnet systemansvar ..............................................................253.4Reglenes virkning i tid ..................................................................................................273.5Særlig om forfatterskap.................................................................................................283.5.1Noen utgangspunkter.............................................................................................283.5.2Vancouver-reglene for medisinsk publisering ......................................................293.5.3Medisinsk forsknings forhold til Vancouver-reglene............................................333.5.4Forfatteransvaret....................................................................................................353.6Tilbaketrekking av ikke-valide publikasjoner (Retraction) ..........................................353.7Nærmere om forskerutdanning/forskeropplæring og veilederrollen.............................363.8Oppbevaringsplikt og -rett for forskningsmateriale ......................................................403.8.1Problemstilling ......................................................................................................403.8.2Oppbevaringsplikten .............................................................................................403.8.3Oppbevarings- og disposisjonsrett ........................................................................424Klargjøring av fakta ..............................................................................................................434.1 Foranledningen – Lancet-artikkelen....................................................................................434.2 Doktorgradsprosjektet om munnhulekreft ..........................................................................454.2.1Opptakt ..................................................................................................................454.2.2Doktorgradsprosjekts tema....................................................................................4531
5
67
8
4.2.3Organiseringen av doktorgradsprosjektet..............................................................464.2.4Forhåndsvurdering av doktorgradsprosjektet........................................................494.2.5Rapportering og publikasjon av doktorgradsarbeidet ...........................................544.2.6Pasientmaterialet – en oversikt..............................................................................554.2.7Fremstillingen av grunnlagsmaterialet i publikasjonene.......................................584.2.8Andre feil og mangler ...........................................................................................824.2.9Oppsummering ......................................................................................................864.2.10Hovedkonklusjon ..................................................................................................884.3Etter disputasen .............................................................................................................894.4Øvrige publikasjoner .....................................................................................................91Mulige forklaringer ...............................................................................................................965.1Innledning......................................................................................................................965.2Doktorgradsprosjektet og videre forskning...................................................................965.3Særlig om NCI-søknaden og Lancet-artikkelen..........................................................1005.4Spørsmål reises rundt ploiditetsklassifikasjonene.......................................................1045.5Eksterne forhold ..........................................................................................................1055.6Mangler i regelverk og lignende formelle kontrollformer ..........................................106Mulige konsekvenser...........................................................................................................1086.1Betraktninger om konsekvenser for forskningen ........................................................1086.2Mulige skadelige konsekvenser for pasientbehandling mv.........................................109Kritikkverdige forhold.........................................................................................................1107.1Innledende bemerkninger............................................................................................1107.2Kritikk av enkeltpersoner ............................................................................................1117.2.1Jon Sudbø ............................................................................................................1117.2.2Albrecht Reith .....................................................................................................1137.3Kritikk av institusjoner................................................................................................1147.3.1Rikshospitalet - Radiumhospitalet HF ................................................................1147.3.2Universitetet i Oslo – Odontologen.....................................................................1167.3.3Universitetet i Bergen – Gades institutt ..............................................................1167.3.4Kreftregisteret......................................................................................................1167.4Generelle bemerkninger ..............................................................................................117Anbefalinger........................................................................................................................1198.1Institusjonene ..............................................................................................................1198.2Tidsskriftene................................................................................................................1208.3Kommisjonens avsluttende merknad ..........................................................................121
Vedlegg .......................................................................................................................................122Vedlegg 1: Jon Sudbøs publikasjonsliste ....................................................................................123Vedlegg 2: Utviklingen av forfatterskapskriteriene ....................................................................126Vedlegg 3: Filer og lister som Kommisjonen har benyttet i granskningen av artiklene i NewEngland Journal of Medicine i 2001 og 2004 .............................................................................131Vedlegg 4: Tabell ........................................................................................................................133Vedlegg 5: Uredelighetsutvalgets veileder .................................................................................137Medisinske ord og uttrykk...........................................................................................................139Lover og forskrifter brukt i rapporten .........................................................................................142Litteraturliste ...............................................................................................................................143
4
11.1
SammendragOppnevning
Den 18. januar 2006 nedsatte Rikshospitalet – Radiumhospitalet Helseforetak (RR HF) ogUniversitetet i Oslo (UiO) i fellesskap en egen kommisjon til å forestå en granskning i tråd medet nærmere fastlagt mandat.Bakgrunnen for granskningen var at en ansatt forsker ved disse institusjonene, Jon Sudbø,hadde innrømmet fabrikasjon av datagrunnlaget som lå til grunn for en vitenskapelig artikkelpublisert i det anerkjente medisinske tidsskriftet The Lancet i oktober 2005.
1.2
Granskningen
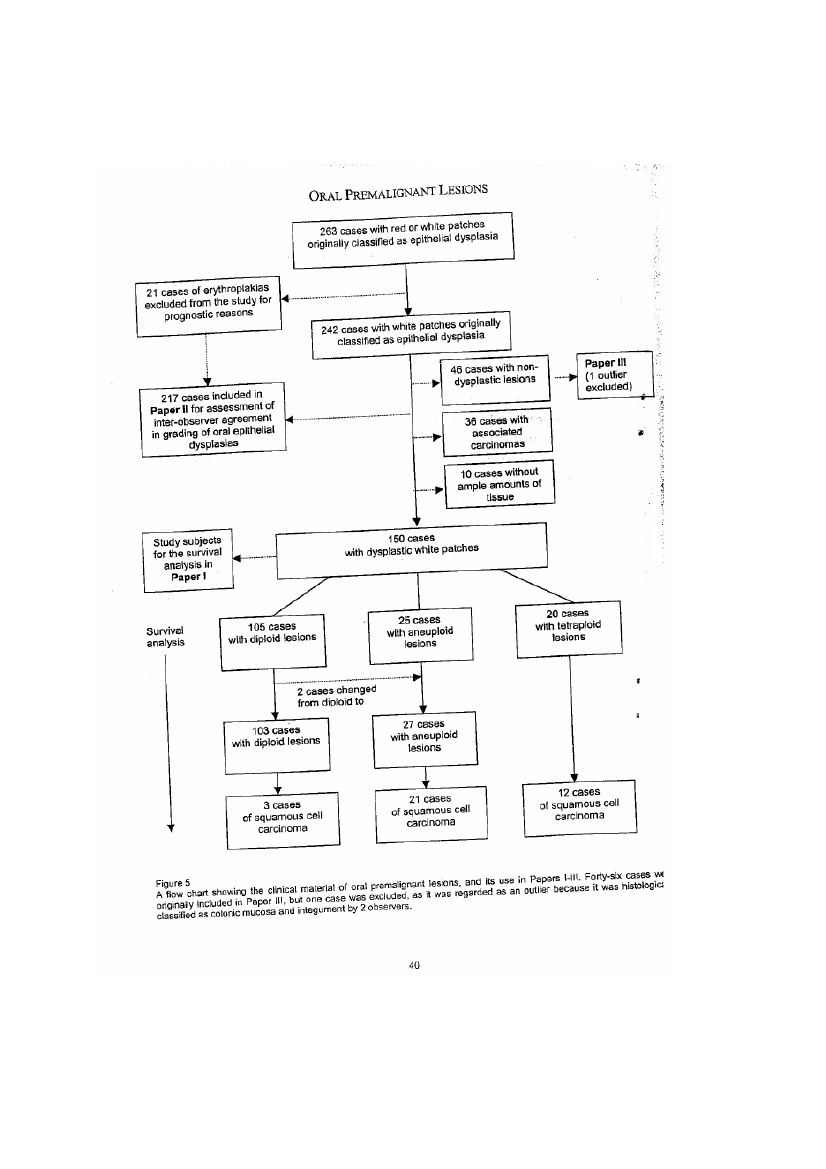
Det var tidlig klart at hele Sudbøs vitenskapelige virksomhet fra 1993-2006 (minst 38publikasjoner) måtte granskes, og at medforfatterne (totalt 60) i realiteten også måtte undergisgranskning. Samtlige forfattere ble tilskrevet og oppfordret til å avgi en skriftlig forklaringfrivillig, noe alle har gjort. I tillegg er det innhentet informasjon fra aktuelle institusjoner ogandre aktuelle samarbeidspartnere. Her nevnes spesielt resultater av Kreftregisterets egnegrundige undersøkelser. Kommisjonen har også hatt møter med personer og institusjoner,herunder Jon Sudbø. I tillegg har kommisjonen innhentet dokumenter og annen informasjon fraflere hold. Tilgjengelige datalister mv. og publiserte forskningsresultater har vært koblet ogsammenlignet med hverandre. På den måten har kommisjonen i stor grad kunnet si noe om og ihvilken grad det grunnlagsmaterialet som publikasjonene bygget på er reelt. Kommisjonen harsom hovedprinsipp funnet det riktig å anvende et beviskrav omkvalifisertsannsynlighetsovervekt som vilkår for å legge et nærmere beskrevet faktum til grunn forrapporten.
1.3
FunnDoktorgradsprosjektet består av to atskilte deler. Den ene delen gjaldt teoretiske og
Jon Sudbø startet på sitt doktorgradsprosjekt i 1993 med Albrecht Reith som veileder.anvendte arbeider om vevsarkitektur i kreftsvulster og normalt vev. Kommisjonen har ikkefunnet holdepunkter for at det hefter feil ved disse arbeidene.Hoveddelen av doktorgradsprosjektet gjaldt, i likhet med senere forskning, karakteristikaved forstadier til munnhulekreft. Spørsmålet var om, og i tilfelle i hvilken grad, forskjellige typerklassifisering av hvite flekker i munnhulen kunne forutsi munnhulekreft. Idoktorgradsavhandlingen og tilhørende publikasjoner besvares dette spørsmålet bekreftende ved
5
at en type klassifikasjon basert på DNA innhold med stor sikkerhet kan forutsi senerekreftutvikling.Dette oppsiktsvekkende funnet som først ble publisert i anerkjente New England Journalof Medicine i 2001 er basert på DNA analyser av 150 pasienter med leukoplakier (dvs. ”hviteflekker” som kan være forstadier til munnhulekreft) i munnhulen. I 2004 ble artikkel nummer toi New England Journal of Medicine publisert, basert på ytterligere undersøkelser av de samme150 pasientene. Basert på egne og Kreftregisterets undersøkelser legger Kommisjonen til grunnat det hefter flere alvorlige feil ved dette sentrale pasientmaterialet. For eksempel forekommersamme pasient flere ganger. Så langt kommisjonen kan se, dreier det seg om maksimalt 141forskjellige pasienter, fordi flere pasienter er representer med flere vevsprøver som til sammengir tallet 150. Videre har kommisjonen lagt til grunn at 69 av de 141 pasientene som bleinkludert i studien, skulle vært ekskludert fordi de hadde hatt munnhulekreft før eller samtidigmed at leukoplaki-diagnosen ble stilt. Hos disse pasientene kunne man ikke studere fremtidigkreftutvikling, siden de allerede hadde kreft. Denne feilen alene er så grov at den gjør resultateneog konklusjonen ugyldige. Kommisjonen har videre avdekket flere andre feil. For eksempelstemmer ikke aldersfordelingen på analysefiler med grunnlagsmaterialet. Kommisjonen leggervidere til grunn at de rapporterte 150 DNA analyser til dels er gjentagelser på et langt mindreantall pasienter. Rapporteringen av hvordan DNA analyser og klassifikasjon av leukoplakier bleutført av flere observatører er også feilaktig og misvisende.Kommisjonen er etter dette kommet til at det datagrunnlaget som ligger til grunn for delerav doktorgradsprosjektet, og flere andre publikasjoner, ikke stemmer i noen rimelig grad med defaktiske forhold som kommisjonen har funnet grunnlag for å legge til grunn. Kreftregisteretsinterne granskning har frembrakt samme konklusjon.Kommisjonen har lagt til grunn at de feil og mangler som er avdekket er for mange, forstore og for åpenbare til at de kan tilskrives tilfeldige feil, inkompetanse eller lignende, og atdatagrunnlaget derfor fremstår som manipulert og fabrikkert, og tilpasset de funn man har ønsketå finne fram til.Konsekvensen av dette er at doktorgradsavhandlingen og tre tilknyttede originalartiklermå trekkes tilbake. I tillegg må senere publikasjoner trekkes tilbake hvor de bygger på detsamme grunnlagsmaterialet, noe de fleste gjør. Kommisjonen har med samme begrunnelse sattspørsmålstegn ved ytterligere en originalartikkel. Videre har kommisjonen stilt spørsmålstegnved en originalartikkel publisert i Journal of Clinical Oncology 2005, blant annet på bakgrunn avforhold som delvis er erkjent av Sudbø. Den siste originalartikkelen publisert i The Lancet i2005, er trukket tilbake, da den i sin helhet bygger på et fabrikkerte grunnlagsdata. Det forholdeter erkjent av Jon Sudbø.6
Dette innebærer at det vesentlige av Jon Sudbøs vitenskapelige produksjon fremstår somugyldig på grunn av manipulasjon og fabrikasjon av grunnlagsdata.
1.4
Kritikk, mulige forklaringer og forebyggende tiltak
Den avdekkede manipulasjon og fabrikasjon av forskningsdata gir grunn til å rette kritikk motJon Sudbø. De kommentarer som Sudbø har gitt til kommisjonen i møte og etter å ha lest torapportutkast med vedlagt dokumentasjon, har ikke gitt kommisjonen grunnlag for å foretavesentlige endringer i de foreløpige konklusjoner som man hadde trukket underveis igranskningen.I tråd med mandatet har kommisjonen stilt spørsmål om hvordan disse – i ettertid –åpenbare og grove forholdene kunne finne sted over så vidt lang tid i samarbeid med en rekkevelkvalifiserte medforfattere/-forskere og forskningsinstitusjoner.Kommisjonen påpeker at det alltid vil være visse muligheter for en uredelig forsker å lureog bedra andre. Et annet forhold er at Jon Sudbø har operert relativt selvstendig både somstipendiat, og senere som forsker. Han har hele tiden vært alene om å ha full kontroll over selvegrunnlagsmaterialet. Kommisjonen har i den forbindelse funnet grunn til å rette kritikk mot hansveileder for manglende aktsomhet og veiledning i stipendiatperioden. Denne saken har ogsåavdekket det som fremstår som systemsvikt ved Radiumhospitalet i form av for eksempelmanglende ledelse, opplæring og kontroll. Et annet forhold er at det heller ikke foreligger noensom helst formell tillatelse eller godkjenning av prosjektet fra eksterne organer, uten at noen harsett det som sin oppgave å besørge eller kontrollere det. Herunder bemerkes det at deinstitusjonene som bidro med pasientmateriale heller ikke har avkrevd bekreftelse på nødvendigetillatelser, som for eksempel dispensasjon fra lovpålagt taushetsplikt.Kommisjonen har ikke funnet holdepunkter for at andre, herunder noen avmedforfatterne, har vært med på manipulasjon og fabrikasjon av forskningsdata eller på annenmåte gjort seg skyldig i vitenskapelig uredelighet. Kommisjonen har imidlertid ut frarimelighetshensyn og kost/nytte-betraktninger ikke ansett det som sin oppgave å granske mindrealvorlige former for normavvik. Medforfatterne kan i det alt vesentlige inndeles i to grupper: 1)som underleverandører, og 2) som overordnede garantister (seniorforskere), som alle i liten gradhar bidratt til eller hatt kjennskap til det underliggende datamaterialet. Det vesentlige avkommunikasjon har skjedd via Jon Sudbø. Dermed har medforfatterne hatt liten mulighet, ogogså liten grunn, til å føre kontroll med grunnlagsmaterialet og hverandres bidrag. En slikarbeidsfordeling er imidlertid ikke et uvanlig fenomen ved medisinske publikasjoner, somnødvendigvis må bygge på samarbeid mellom forskere med til dels ulik fagbakgrunn ogoppgaver og dermed nødvendig tillit dem i mellom.7
På en annen side har kommisjonen pekt på enkelte forhold som flere burde ha reagert på,det være seg medforfattere, veiledere, overordnede, opponenter, kolleger eller andre. Siden dether har vært tale om en rekke mindre grove feil begått av flere som må ses i sammenheng(kollektive og kumulative feil), har kommisjonen funnet grunnlag for å se på dette somsystemsvikt, hvor ansvaret faller på institusjonene.På denne bakgrunn har kommisjonen anbefalt at institusjonene i større grad tar ansvar forå bevisstgjøre og veilede sine forskere i forhold til hvilke regler som gjelder, samt føre et visstminimum av kontroll og tilsyn, samtidig som det tas tilbørlig hensyn til den akademiske frihet.Kommisjonen har ikke sett det som sin oppgave å avdekke konkrete skadevirkninger. Detvil trolig være et tema for Helsetilsynets granskning. Kommisjonen har imidlertid bemerket atkollegaer, forskere, klinikere og enkeltpasienter ventelig har bygget på Sudbøsforskningsresultater, og da er det naturlig å anta at enkelte av disse har blitt skadelidende. Detalvorlige forholdet må ha vært åpenbart for Jon Sudbø fra starten av.
1.5
Kommisjonens rapport – en oversikt
I granskningsrapportens kapittel 2 redegjøres det for kommisjonens oppnevning, mandat ogarbeidsmåte. Her omtales blant annet utredningsprinsippet og informasjonsinnhentingen,kontradiksjonsprinsippet, beviskrav, forholdet til offentlighet, samt terskler for kritikk.I kapittel 3 har kommisjonen funnet grunn til å skissere det generelle regelverk somgjelder for medisinsk og helsefaglig forskning. Kommisjonen omtaler her på generelt grunnlagbl.a. forfatterskapsregler og veilederforhold.I kapittel 4 redegjøres det for fakta slik kommisjonen har funnet å legge det til grunn.Faktafremstillingen er ordnet tidskronologisk fra og med Jon Sudbøs doktorgradsprosjekt,påbegynt i 1993. Det redegjøres for det datagrunnlaget som ligger til grunn for deler av JonSudbøs doktorgrad og flere senere publikasjoner. Kommisjonen går i detalj på hvilke pasientdataSudbø faktisk har eller kan ha hatt, og sammenholder dette med hvilke Sudbø og medforfattereoppgir å ha hatt av data i ulike publikasjoner. Deretter har kommisjonen foretatt en gjennomgangav Sudbøs senere vitenskapelige publikasjoner, som i all hovedsak bygger på det opprinneligedatagrunnlaget fra doktorgradsprosjektet.I kapittel 5 har kommisjonen forsøkt å belyse enkelte forhold som kan bidra til å forklarehvordan og hvorfor ting ble som de ble.I kapittel 6 drøftes kort mulige konsekvenser av de avdekkede forhold, for blant annetnorsk forskning og pasienter.I kapittel 7 sammenfattes de funn og kritikkverdige forhold som kommisjonen har funnetgrunn til å påpeke. Denne kritikken retter seg både mot enkeltpersoner og institusjoner.8
Avslutningsvis i kapittel 8 har kommisjonen fremsatt enkelte anbefalinger.
9
22.1
Kommisjonens oppnevning, mandat og arbeidsmåteOppnevning av granskningskommisjonen
Fredag den 13. januar 2006 gikk Rikshospitalet - Radiumhospitalet Helseforetak (RR HF) ogUniversitetet i Oslo ut i media med opplysninger om at en forsker ansatt hos dem haddeinnrømmet fabrikasjon av data som lå til grunn for en vitenskapelig artikkel i det anerkjentemedisinske tidsskriftet The Lancet.Onsdag 18. januar 2006 kunngjorde Rikshospitalet - Radiumhospitalet HF ogUniversitetet i Oslo at de ville oppnevne en egen kommisjon med et nærmere fastlagt mandat(punkt 2.3) til å forestå granskningen og klargjøre fakta.
2.2•••••---•
Kommisjonens sammensetningProfessor dr.med. Anders Ekbom (leder), Institusjonen för medisin, KarolinskaUniversitets Sjukehuset, Stockholm.Spesialrådgiver Gro E. M. Helgesen, cand.pharm., Norges forskningsrådPost doc Tore Lunde, dr. juris, Det juridisk fakultet, Universitetet i Bergen.Forsker Aage Tverdal, professor dr.philos., Nasjonalt folkehelseinstitutt.Professor dr.P.H. Stein Emil Vollset, Institutt for samfunnsmedisinske fag, Universitetet iBergen.Stipendiat Sigmund Simonsen (sekretær), cand.jur. LL.M, Institutt for samfunnsmedisin,Norges Teknisk-Naturvitenskapelige Universitet.
Kommisjonen fikk følgende sammensetning:
I tillegg ble the National Cancer Institute (NCI) i USA tilbudt en plass i kommisjonen, men harikke takket ja til dette.
2.3
Kommisjonens mandat
Formålet med granskingen er å finne fram til og gjennomgå alle faktiske forhold i forbindelsemed forskningsartikkelen “Non-steroidal anti-inflammatory drugs and the risk of oral cancer: anested case-control study” by J Sudbø et al. in The Lancet, vol. 366, pp. 1359-1366, October 15,
10
2005. Kommisjonen skal også vurdere øvrig forskning og andre forhold som kommisjonenvurderer at har tilknytning til denne saken.Kommisjonen skal foreta de undersøkelser den finner nødvendig for å bringe på det reneomfanget av brudd på standarder for vitenskapelig forskning og andre kritikkverdige forhold.Kommisjonen skal søke å klarlegge om det er spesielle forhold som har innvirket på detsom er gjort i denne saken, både forskeres egeninteresser og om det har vært til stede spesielleeksterne interesser, rammer, betingelser og bindinger for virksomheten.Kommisjonen skal kartlegge og vurdere eventuelle skadelige konsekvenser avforskningen og av øvrige forhold som inngår i mandatet. Dette gjelder om, og eventuelt hvilkeskadevirkninger dette har hatt i forbindelse med pasientbehandling. Likeledes skal kommisjonensøke å klarlegge og vurdere de negative virkninger som er påført den vitenskapelige forskningenved Rikshospitalet - Radiumhospitalet HF og relevante forskningsområder ved Universitetet iOslo samt vitenskapelig forskning ved andre institusjoner.Kommisjonen skal vurdere regler og rutiner for kontroll og kvalitetssikring som gjelderfor vitenskapelig forskning ved Rikshospitalet - Radiumhospitalet HF og Universitetet i Oslo, ogom disse er blitt fulgt i denne saken. Kommisjonen skal vurdere om disse reglene og rutinenebør endres og eventuelt komme med forslag til slike endringer.Skulle kommisjonen i sitt arbeid bli kjent med forhold som har virkninger som børmeddeles før kommisjonens arbeid er avsluttet må kommisjonen bringe dette til oppdragsgiverserfaring så raskt som mulig.Dersom kommisjonen mener at mandatet setter begrensninger for arbeidet må dette tasopp med oppdragsgiver umiddelbart.Kommisjonen skal avgi sin rapport til Rikshospitalet - Radiumhospitalet HF ogUniversitetet i Oslo senest innen 1. april 2006, og rapporten blir deretter offentliggjort samtidigsom den blir behandlet uavhengig i de to institusjoners styrer.
2.4
Kommisjonens rettslige status, rettslige rammer,
sakshandlingsregler og prinsipper i granskningsprosessen2.4.1 Kommisjonens rettslige statusGranskningskommisjonen ble oppnevnt av Rikshospitalet – Radiumhospitalet HF (RR HF) ogUniversitetet i Oslo (UiO) (heretter; oppdragsgiver) som er, eller har vært, arbeidsgiver til denforskeren som innrømmet å ha fabrikkert forskningsdata, og som foranlediget granskningen.Oppdragsgiver er således to offentlige institusjoner.
11
Kommisjonen er ikke en ”offentlig granskningskommisjon”, men snarere et midlertidigog faglig uavhengig forvaltningsorgan av spesiell karakter, bestående av uhildede eksperter, somledelsen ved de to nevnte offentlige institusjoner i felleskap har opprettet i sakens anledning for åutføre en granskning på deres vegne. Hensynet til en faglig uavhengig granskning har imidlertidstått helt sentralt for så vel oppdragsgiveren som kommisjonen.For denne typen ad-hoc oppnevnte kommisjoner er det ikke gitt særskiltesaksbehandlingsregler i lov eller forskrift. Et regjeringsoppnevnt utvalg ga i 1968 innstilling omRegler for granskningskommisjoner (trykt i 1969). Justisdepartementet utferdiget deretter etrundskriv1, som innholdsmessig er en blanding av informasjon, instruks, veiledende regler ogbestemmelser av mer tvingende karakter.2Rundskrivet er beregnet påoffentligegranskningskommisjoner oppnevnt av Regjeringen eller et departement, såkalte ”offentligegranskningskommisjoner”. Det er således klart at disse retningslinjene verken er utformet medtanke på, eller er bindende for denne kommisjonen.Siden kommisjonen er et organ for to offentlige organer, er det imidlertid klart atkommisjonen er underlagt forvaltningsloven og alminnelige ulovfestede krav til godforvaltningsskikk. Siden kommisjonens rapport ikke kan anses som noe enkeltvedtak iforvaltningslovens forstand, er det især kapitlene II og III i forvaltningsloven som har hattbetydning for arbeidet.
2.4.2 Habilitet og uavhengighetKommisjonen har i samsvar med reglene i forvaltningsloven § 8 vurdert sin egen habilitet. Ingenav medlemmene er forbundet med sakens parter, og kommisjonen kan heller ikke se at detforeligger forhold som er egnet til å svekke tilliten til deres upartiskhet, jf. forvaltningsloven § 6.I kontakten mellom kommisjonen og oppdragsgiver har kommisjonen lagt stor vekt påhensynet til uavhengighet. Oppdragsgiver har lagt forholdene til rette for at granskningen harkunnet gjennomføres uavhengig, selvstendig og uten ressursmessige begrensninger. Av hensyntil kommisjonens uavhengighet har sekretariatet ikke vært fysisk eller funksjonelt samlokalisertmed oppdragsgivere, personer eller institusjoner som har kunnet bli gjenstand for granskning.Kommisjonen har således disponert lokaler for sekretariat i Trondheim, og har gjennomført defleste møter i møtelokaler på Gardermoen, foruten telefonmøter. Ett møte er holdt vedRadiumhospitalet, i samband med befaring og samtaler med ansatte, og ett møte er holdt vedKreftregisteret. Kommisjonen har hatt gode rammevilkår for gjennomføring av granskningen.
Rundskriv G-48/75 av 4. mars 1975 ”Regler for granskningskommisjoner”Bratholm A. Granskning som statlig virkemiddel for å bringe faktiske forhold eller ansvarsforhold på rene. Lov ogRett, 1986: s. 439.2
1
12
2.4.3 Rettslige virkemidlerKommisjonen har ikke hjemmel for å foreta ransaking eller beslag. Intervjuobjekter har hellerikke forklaringsplikt for kommisjonen. Det rettslige grunnlaget for innhenting av bevis, i form avmuntlig og skriftlig informasjon, herunder e-post og intervjuer, er samtykke. Samtligeintervjuobjekter har gitt samtykke til å gi opplysninger til kommisjonen. Det samme gjelderandre personer og institusjoner som kommisjonen har rettet henvendelser og forespørsler til.Generelt har kommisjonen hatt et godt samarbeid med berørte personer og institusjoner. Ingenhar nektet å samarbeide med kommisjonen.
2.4.4 Utredningsprinsippet og forsvarlighetsprinsippetKommisjonen har iakttatt utredningsprinsippet i forvaltningsloven § 17, og de prinsipper somfølger av krav til forsvarlig saksbehandling og god forvaltningsskikk. Kommisjonen har innenforden begrensede tidsrammen som har stått til disposisjon søkt å tilveiebringe et så bredtinformasjonsgrunnlag som mulig, og har herunder foretatt kritiske etterprøvinger av informasjonmottatt fra ulike kilder, og sammenholdt disse mot hverandre med sikte på å avdekke eventuelleuoverensstemmelser.Kommisjonen peker imidlertid på de vanskeligheter som ligger i at en del av forholdenesom har vært gjenstand for granskning ligger mer enn ti år tilbake i tid. Et så vidt langt tidsforløpsetter naturlig nok sitt preg på muligheter for intervjuobjekter til å erindre detaljer om hva somhar foregått. De reservasjoner som av den grunn har måttet gjøres i forhold til hva man kantrekke ut av bevismaterialet, har imidlertid ikke rokket ved kommisjonens hovedkonklusjoner,slik disse fremgår av rapporten.
2.4.5 KontradiksjonFor å sikre en forsvarlig saksbehandling i tråd med grunnleggende rettsikkerhetshensyn og kravtil god forvaltningskikk, har kommisjonen tatt utgangspunkt i, og praktisert, rundskrivetsveiledende normer så langt det har vært hensiktsmessig og naturlig. De enkeltpersoner som ergransket, har blitt varslet om dette, og de er oppfordret til å komme med innspill frivillig.Samtidig har de blitt opplyst om at de ville kunne bli utsatt for kritikk, og at de i så tilfelle villebli særskilt varslet dersom det skulle bli aktuelt. De enkeltpersoner som utsettes for kritikk hardessuten fått lese notater, dokumenter og til slutt selve rapportutkastet, dvs. kapittel 4 til og medkapittel 7 (kapittel 1-3 og 8 inneholder mer generelle betraktninger). De har således fåttanledning til å imøtegå kritikken og komme med innspill ved flere anledninger. Kommisjonenhar også møtt disse personene.
13
Kommisjonen vil her bemerke at den personen som har vært mest sentral forgranskningen, Jon Sudbø, har vært bistått av advokat under granskningen. Saksbehandlingen ogfaktiske forhold har fortløpende vært diskutert med Sudbø og hans advokat. Ingen vesentligeinnsigelser mot kommisjonens skisserte opplegg for selve granskningen har fremkommet.Herunder bemerkes at Sudbøs kontormateriale har vært avlåst av arbeidsgiver under helegranskningen, og at Sudbø har fått flere tilbud om tilgang til dette materialet for eventuelt å finnefram dokumentasjon og lignende av betydning i denne saken. Sudbø har fått tilsendt torapportutkast sammen med datalister, koblinger og andre sentrale dokumenter som kommisjonenhar bygget på. Sudbø innga detaljerte kommentarer på det første utkastet – som kommisjoneninnarbeidet, men ønsket ikke å kommentere på det neste utkastet han fikk.Kommisjonen har med andre ord lagt til rette for kontradiksjon i større utstrekning enndet man har vært forpliktet til. Dette har vært gjort av hensyn til berørte enkelpersoner, men ogsåav hensyn til å få belyst saken best mulig.
2.4.6 Beviskrav og terskler for kritikkKommisjonens primære oppgave er å klargjøre fakta med sikte på å avdekke hvorvidt og ihvilket omfang det har forekommet brudd på standarder for vitenskaplig forskning og andrekritikkverdige forhold. Tilsvarende som i rettslige prosesser, både sivilprosess og straffeprosess,vil det også i granskningsprosesser forekomme ulike grader av sannsynliggjøring av fakta.Kommisjonen har vurdert hvilke krav til bevis som bør stilles i en sak av denne karakter for atkommisjonen kan legge til grunn et nærmere beskrevet faktum som grunnlag for eventuellkritikk.Etter kommisjonens vurdering er det flere grunner som taler for at det bør gjelde etstrengere krav til sannsynliggjøring av faktum enn det tradisjonelle sivilprosessuelle prinsippetom såkalt simpel sannsynlighetsovervekt.3For det første vises det til at granskningen har sommål å klargjøre et faktum med sikte på å avdekke omfanget av vitenskapelig uredelighet oglignende. Kritikk på et slikt grunnlag må anses som meget inngripende for de enkeltpersoner detangår. Hensett til de alvorlige rettsvirkninger og eventuelle sanksjoner som vil kunne utløses avkonklusjoner om vitenskapelig uredelighet, brudd på god forskningsskikk og lignende kriterier,bør det ordinære overvektsprinsippet fravikes i favør av den granskningen er rettet mot. For detandre vil bevisføringen og praktiseringen av bevisumiddelbarhetsprinsippet under engranskningsprosess være mer begrenset enn ved en ordinær domstolsbehandling. På den annenside finner kommisjonen at det ikke er grunnlag for å oppstille et tilsvarende strengt beviskravsom i strafferetten. Kommisjonen finner ut fra en samlet vurdering at det bør gjelde et krav om3
Se nærmere Skoghøy JE. Tvistemål. Oslo: Universitetsforlaget, 2001: s. 673 flg.
14
såkalt kvalifisert sannsynlighetsovervekt for at kommisjonen kan legge et nærmere konkretisertfaktum til grunn som bevist. Kommisjonen har anvendt dette prinsippet i granskningen ogutarbeidelsen av rapport.Kommisjonen har derfor, primært av rettsikkerhetsmessige hensyn, men også avpragmatiske hensyn, lagt lista for personkritikk meget høyt. Mange enkeltpersoner har værtinvolvert i den forskningen som har vært undergitt granskning, og en eventuell kritikk for mindrealvorlige forhold ville, slik kommisjonen ser det, kunne ramme enkeltpersoner uforholdsmessighardt, spesielt sett i lys av oppdragsgivers uttalte intensjoner om å offentliggjøre rapporten, samtden omfattende pressedekningen denne saken har vært undergitt.I forhold til involverte institusjoner har imidlertid kommisjonen funnet grunnlag for ennoe annen innfallsvinkel. Kommisjonen har varslet to institusjoner om at de ville kunne bli utsattfor kritikk. Disse har fått mulighet til å lese selve kritikken, men ikke rapportutkastet i sin helhet,og er således gitt en begrenset mulighet til å komme med innspill. Videre har kommisjonen ikkevalgt å varsle oppdragsgiverne Rikshospitalet - Radiumhospitalet HF og Universitetet i Oslo,selv om disse som ansvarlige institusjoner må tåle kritikk. Varsling er unnlatt for å forhindrerisiko for uheldig påvirkning fra disse institusjonene. Kommisjonen har imidlertid hatt møtermed ledere på flere nivå ved Rikshospitalet - Radiumhospitalet HF og Universitetet i Oslo, for åklargjøre faktiske forhold. Unnlatt varsling og mulighet til å lese rapportutkast, har ogsåsammenheng med styrkeforholdet til institusjonene sammenlignet med enkeltpersoner. Hensynettil kommisjonens integritet og faglige uavhengighet har også vært en viktig faktor for dennevurderingen. Kommisjonen har vurdert det slik at institusjonene i en helt annen grad ennenkeltpersoner må tåle offentlig kritikk.
2.4.7 UskyldspresumsjonenDen såkalte uskyldspresumsjonen som er nedfelt i Den europeiske menneskerettskonvensjon(EMK) artikkel 6 (2) fastslår at ”enhver som blir siktet for en straffbar handling, skal antasuskyldig inntil det motsatte er bevist etter loven”. Konvensjonen er inkorporert som norsk lov, jf.menneskerettsloven. Kommisjonens mandat er utformet med sikte på å klargjøre faktiske forholdsærlig relatert til Lancet-artikkelen, og avdekke omfanget av brudd på standarder forvitenskapelig praksis. Mandatets utforming innebærer at kommisjonen kan utføre sine oppgaveruten å foreta skyldkonstateringer som kommer i konflikt med uskyldspresumsjonen.
2.4.8 OffentlighetKommisjonen er å anse som et forvaltningsorgan etter offentlighetsloven § 1. Offentlighetslovengjelder derfor for kommisjonens virksomhet. Alle dokumenter som er levert til kommisjonen er15
underlagt offentlighet med mindre unntaksgrunnene i §§ 4, 5, 5a eller 6 kommer til anvendelse.Nedtegnelse av forklaringer, rapportutkast og lignende notater er ansett som interne dokumentersom kan unntas etter § 5. Det gjelder også innspill og støttedokumenter som de som har forklartseg har levert kommisjonen, samt utdypende merknader de har gitt til utskrifter de har fåtttilsendt til gjennomlesning. Det er ikke praktisert meroffentlighet i forhold til nedtegnelse avforklaringer. Kommisjonen har under granskningen mottatt én begjæring om dokumentinnsyn,fra Verdens Gang. Begjæringen ble under henvisning til offentlighetsloven § 4 første leddavslått. Etter klage fra VG og fornyet vurdering ble enkelte dokumenter frigitt.Kommisjonen har ved utformingen av rapporten lagt til grunn oppdragsgivers uttalte målom offentliggjøring. Vedlegg som dokumenterer feil og mangler i pasientmaterialet, og sominneholder pasientidentifiserbar informasjon (i form av for eksempel blokknummer), er unntattfra offentliggjøring, og er kun meddelt oppdragsgiver og de personer og institusjoner somkritikken er rettet mot, og som i den egenskap tidligere har hatt befatning med disse dataene. Enanonymisert og forenklet utgave av disse vedlegg, uten pasientidentifiserbare opplysninger, erinntatt som vedlegg i rapporten som blir offentliggjort.Kommisjonen opphører ved avgivelse av rapporten til Rikshospitalet - RadiumhospitaletHF og Universitetet i Oslo, og sakens dokumenter blir deretter overlatt til og håndtert avRikshospitalet - Radiumhospitalet HF og Universitetet i Oslo for arkivering på ordinær måte. Detlegges til grunn at materialet vil være underlagt offentlighetsloven og arkivlovgivningen.Etterfølgende innsynsrett vil for øvrig kunne være begrenset på grunn av avgrensninger sommåtte følge av avgitte samtykker, taushetspliktsregler og lignende.
2.5
Kommisjonens forhold til mandatet
Mandatet er meget vidt. Utformingen av mandatet må ses i lys av at oppdragsgiver påoppnevningstidspunktet naturlig nok ikke hadde oversikt over sakens nærmere karakter ogomfang, og at man ikke ønsket å legge begrensninger på kommisjonens granskning.Kommisjonen har videre merket seg den omfattende pressedekning og debatt som harfulgt i kjølvannet av denne saken, herunder mer eller mindre eksplisitte forventningerkommentatorer og andre har hatt til kommisjonen. Kommisjonen har naturligvis verken forsøkteller hatt mulighet til å imøtekomme alle disse.I tråd med mandatet gikk imidlertid kommisjonen bredt ut og vurderte en rekke aktuelleforhold. Samtidig var det klart at det ville ha vært en uoverkommelig oppgave å foreta en likegrundig vurdering av alle de spørsmål som reises i mandatet innenfor den begrensedetidsrammen som kommisjonen hadde til rådighet. Kommisjonen har dermed måttet foreta
16
fortløpende avgrensninger og presiseringer av mandatet. Kommisjonen har da måttet prioriterede forhold som for kommisjonen har fremstått som de mest sentrale og alvorlige.Kommisjonen ble i mandatet bedt om å avlevere rapport til oppdragsgiver innen 1. april2006. Det ble etter hvert klart for kommisjonen at det ikke ville være mulig å overholde denfristen. Ny frist ble satt til 30. juni 2006 etter forslag fra kommisjonen selv.
2.6
Nærmere om kommisjonens arbeidsmåte
2.6.1. GenereltKommisjonens medlemmer har utført sine oppgaver ved siden av annen virksomhet.Kommisjonens sekretær har arbeidet for kommisjonen på heltid, og har i tillegg hatt en 20%stilling ved NTNU. Kommisjonen har dessuten fått kontorteknisk bistand, bl.a. til transkriberingav intervjuer, fra Marit Kvidal og Toril Synnøve Strand. Alle har undertegnet erklæring omtaushetsplikt.
2.6.2 MøtevirksomhetKommisjonen har hatt 13 heldagsmøter og 11 telefonmøter. En god del av møtetiden har blittbrukt til å møte sentrale personer – til sammen 15.
2.6.3 InformasjonsinnhentingDen sentrale oppgaven for kommisjonen har vært å klargjøre fakta. Kommisjonen har innhentetså vel skriftlig som muntlig informasjon. Informasjonstilfanget er betydelig. Det skriftligematerialet fremgår av dokumentlister inntatt som vedlegg til rapporten. Materialet kan grupperesi 1) forskningspublikasjoner hvor Jon Sudbø har vært førsteforfatter eller medforfatter, 2)korrespondanse, herunder e-post, mellom kommisjonen og berørte personer, institusjoner ogoffentlige myndigheter, 3) datafiler som inneholder opplysninger om benyttetgrunnlagsmateriale, herunder kommisjonens egne utarbeidede datafiler med forsøk pårekonstruksjon og etterprøving av grunnlagsmaterialet. Muntlig informasjon er dels tatt opp pålydbånd og deretter transkribert, dels mottatt pr telefonhenvendelser og nedtegnet i internesaksdokument og/eller utvekslet per e-post til kommisjonens medlemmer, og dels mottatt imøter, uten at det har vært gjort lydbåndopptak, men hvor opplysninger er nedtegnet i internesaksdokumenter. Kommisjonen har bare benyttet mandatrelevant informasjon.Det ligger implisitt i mandatet at det er forskning i regi av Jon Sudbø som har stått mestsentralt, fordi Jon Sudbø, ut fra de opplysninger som forelå per oppnevningstidspunktet, allerede
17
hadde innrømmet fabrikasjon av forskningsdata, for så vidt gjelder en artikkel i The Lancet fraoktober 2005.Kommisjonen besluttet derfor tidlig, i lys av sakens karakter, at hele Jon Sudbøsvitenskapelige virksomhet og produksjon, som i henhold til databasen PubMed4omfatter 38publikasjoner, måtte granskes, se publikasjonsliste vedlegg 1. Dette er det nærmere redegjort forunder faktagjennomgangen i kapittel 4.Det medførte at de forfatterne som har vært med på publikasjoner sammen med JonSudbø (ca. 60), i realiteten også har vært undergitt granskning. Disse er behandlet likt.Forfatterne ble tilskrevet og orientert om at de formelt sett var under granskning, og formeltvarslet om at det kunne resultere i kritikk. Samtidig ble de anmodet om å avgi en skriftligforklaring frivillig. De ble også informert om at de ikke har noen plikt til å avgi slik forklaring,ettersom kommisjonen ikke har hjemmel for åkrevenoen avhørt. Samtlige forfattere respondertepå kommisjonens henvendelse. I tillegg ble enkelte personer og samarbeidspartnere som ertakket iacknowledgementkontaktet. Etter behov har kommisjonen også stilt tilleggs- ogoppfølgningsspørsmål. Flere forfattere og samarbeidspartnere har dessuten forklart seg muntligfor kommisjonen (15 personer). Jon Sudbø har avgitt muntlig og skriftlig forklaring forkommisjonen. De fleste forklaringene er, i forståelse med intervjuobjektene, tatt opp på lydbåndog transkribert. De som har forklart seg har fått mulighet til å lese utskriftene fra samtalene, ogkomme med korreksjoner, presiseringer eller tilleggskommentarer. Lydbåndene er, i samsvarmed de forutsetninger for lydbåndopptak som intervjuobjektene selv har satt, slettet avkommisjonen.Kommisjonen har videre innhentet skriftlig og muntlig informasjon fra relevanteinstanser og institusjoner som Jon Sudbø har vært i kontakt med i forbindelse med sin forskning.Her skal spesielt nevnes Kreftregisteret, som selv har gjennomført meget omfattendeundersøkelser som ledd i egen internkontroll, bl.a. fordi Kreftregisteret angivelig har vært ensentral samarbeidspartner for Jon Sudbø. Kreftregisterets uavhengige undersøkelser har vært avstor verdi for granskningskommisjonen, først og fremst fordi Kreftregisteret har tilgang på detmeste av grunnlagsdata som Sudbø har brukt i sin forskning.Som det redegjøres for i detalj i kapittel 4, har den sentrale informasjonsbæreren værttilgjengelige datalister og publiserte forskningsresultater som kunne belyse detgrunnlagsmaterialet som ligger til grunn for Jon Sudbøs forskning. Disse datafilene har derettervært koblet og sammenlignet med hverandre og annen tilgjengelig dokumentasjon, bl.a. fraKreftregisteret. På den måten har kommisjonen forsøkt å gjenskape det faktiske
4
www.pubmed.gov
18
grunnlagsmaterialet som har eller med stor grad av sannsynlighet kan ha vært brukt av JonSudbø i hans forskning.
2.6.4 God vitenskapelig praksis, normavvik og uredelighetEt mål med granskningen har som nevnt vært, gjennom en klargjøring av fakta, å avdekkehvorvidt det i Jon Sudbøs vitenskapelige virksomhet og produksjon har forekommet brudd pågod vitenskapelig praksis, dvs. brudd på god forskningsskikk. Dette målet har kommisjonensenere avgrenset til å gjeldegroveogalvorligebrudd. Det vil først og fremst si ”vitenskapeliguredelighet”, slik dette tradisjonelt er definert, samt alvorligere grader av uaktsomhet ogkritikkverdighet. Kriteriet ”vitenskapelig uredelighet” er nylig lovfestet i forskningsetikkloven(ikke trådt i kraft), hvor det i lovens § 5 andre avsnitt heter:”Med vitenskapelig uredelighet menes forfalskning, fabrikkering, plagiering og andre alvorlige brudd medgod vitenskapelig praksis som er begått forsettlig eller grovt uaktsomt i planlegging, gjennomføring ellerrapportering av forskning.”
Hensett til at skyldkravet for brudd på vitenskapelig uredelighet er formulert som et krav omforsett eller grov uaktsomhet, har kommisjonen lagt til grunn en relativt høy terskel for åkonstatere brudd på vitenskapelig uredelighet, samt grove og alvorlige brudd på godforskningsskikk. Kommisjonen viser også til avsnitt 3.2. Kommisjonen har på denne bakgrunnikke funnet det formålstjenelig å foreta en inngående granskning av hver enkelt av de 60forfatterne, i den hensikt å avdekke avvik fra normer som må anses å være av mindre betydning iforhold til sakens hovedspørsmål.Denne viktige avgrensningen er først og fremst begrunnet i at slike eventuelle mindrealvorlige forhold kommer i en helt annen kategori enn de alvorlige påstandene som kommisjonenprimært har hatt i oppgave å granske. Det understrekes at dette fra kommisjonens side på ingenmåte må tolkes som et forsøk på å bagatellisere mindre forseelser. Tvert i mot er forebygging avenhver form for normavvik fra god forskningsskikk tillagt stor vekt i kommisjonensanbefalinger. Avgrensningen må heller ses i lys av et reelt og praktisk behov for å trekke opppraktikable rammer for kommisjonens arbeid. Innenfor kommisjonens begrensede tidsramme hardet ikke vært mulig å granske hver enkelt forfatter i detalj, med de krav til grundighet ogrettssikkerhet som det ville ha krevd. Kommisjonen viser her til at hver enkelt person somkommisjonen i tilfelle hadde funnet grunn til å kritisere direkte, uansett om det varbagatellmessige eller alvorlige forhold, ville måttet få anledning til å uttale seg og imøtegå deneventuelle kritikk som måtte bli rettet mot vedkommende (kontradiksjonsprinsippet). Endelig
19
viser kommisjonen til at arbeidet med å avdekke de mest graverende og alvorlige forhold harvært betydelig større enn det man i begynnelsen hadde grunn til å forutse.På den annen side har kommisjonen funnet grunn til å komme med enkelte mer generellebemerkninger knyttet til hvordan forskere og forskningsinstitusjoner bør opptre, herunder hvilkemindre normavvik som synes å ha forekommet. Dermed er personkritikken først og fremstknyttet til grove og alvorlige normavvik, mens påvisningen av mindre alvorlige forhold er holdtpå et mer generelt og institusjonelt nivå.I kommisjonens klargjøring av fakta har således to spørsmål stått sentralt:1. Har det, og i tilfelle i hvilket omfang, forekommet grove og alvorlige brudd på godforskningsskikk?2. Hva har skjedd (årsaksfaktorer), og hvem er ansvarlige for eventuelle brudd på godforskningsskikk?Før disse spørsmålene skal besvares, har kommisjonen funnet grunn til å skissere det generellerammeverk og den bakgrunn som denne konkrete saken er vurdert opp mot, se kapittel 3.
20
33.1
Regulering av medisinsk forskning
Oversikt over gjeldende regelverk
I mandatets andre avsnitt heter det:”Kommisjonen skal foreta de undersøkelser den finner nødvendig for å bringe på det reneomfanget av brudd på standarder for vitenskapelig forskning og andre kritikkverdigeforhold.””Brudd på standarder for vitenskapelig forskning og andre kritikkverdige forhold” er et megetvidt begrep. Begrepet retter seg mot handlingerogunnlatelser som bryter med etablertehandlingsnormer/handlingsregler – her; god forskningsskikk. Slike normer eller regler forakseptert atferd kan ha ulik status og betegnelse, som for eksempel:••••Etiske normer og sosiale normer5Profesjonsnormer (forskere og helsepersonells selvreguleringer)6Instrukser og normer utarbeidet av arbeidsgiverRettsnormer (lovfestede og ulovfestede rettsregler)7
Reguleringen av medisinsk og helsefaglig forskning preges av et intimt samspill mellom etikk,jus og profesjonens egne normer, der etikken (etiske refleksjoner) normalt ligger til grunn for såvel rettsnormer som profesjonens egne normer.Kommisjonen vil ikke her gi en detaljert beskrivelse av alle relevante regler som gjelderfor medisinsk forskning. Disse reglene er nylig beskrevet utførlig i andre fremstillinger, ogkommisjonen viser til disse.8Kommisjonen skal likevel meget kort skissere det rammeverk som gjeldende reglerutgjør, og som denne konkrete saken er vurdert opp mot. Rammeverket angir hvilkeforventninger og krav som stilles til norske forskere og forskningsmiljøer.Selv om forskning i utgangspunktet skal være fri og uavhengig, finnes det selvfølgeligspilleregler som forskere må forholde seg til på samme måte som alle andre.Se for eksempel Ruyter KW. Forskningsetikk. Oslo: Gyldendal, 2003.Se for eksempel Benestad HB, Laake P. Forskningsmetode i medisin og biofag. Oslo: Gyldendal, 2004.7Se for eksempel Simonsen S, Nylenna M. Helseforskningsrett. Oslo: Gyldendal, 2005.8NOU 2005:1 God forskning – bedre helse. Lov om medisinsk og helsefaglig forskning som involverer mennesker,humant biologisk materiale og helseopplysninger (helseforskningsloven); Ot.prp. nr. 58 (2005-2006) Om lov ombehandling av etikk og redelighet i forskning; Ruyter KW. Forskningsetikk. Oslo: Gyldendal, 2003; Benestad HB,Laake P. Forskningsmetode i medisin og biofag. Oslo: Gyldendal, 2004; Simonsen S, Nylenna M.Helseforskningsrett. Oslo: Gyldendal, 2005.65
21
Det finnes en rekke regler og kontrollrutiner for medisinsk og helsefaglig forskning.Tradisjonelt har forskningsmiljøet regulert seg selv, gjennom utvikling av normer for godvitenskapelig praksis (profesjonsnormer og bransjepraksis). De senere årene har imidlertid ogsålovgivende myndigheter spilt en mer aktiv rolle, særlig når det gjelder medisinsk og helsefagligforskning som involverer mennesker, humant biologisk materiale og/eller personopplysninger.Pasientrettighetsloven, biobankloven og personopplysningsloven er sentrale eksempler pålovfestede rettsregler. Ulovfestede rettsregler kommer i tillegg. En rekke skrevne og uskrevneprofesjonsnormer (selvreguleringer), som f.eks. Helsinki-deklarasjonen utarbeidet av Verdenslegeforening (WMA) og de såkalte Vancouver-reglene, jf. punkt 3.5, er dessuten fremdelesmeget aktuelle og relevante. I tillegg kommer stadig mer detaljerte arbeidsinstrukser ellerunderforståtte krav til akseptabel atferd ved den enkelte forskningsinstitusjon. I dag fremkommerdisse gjerne på institusjonenes intranett. Et økende antall internasjonale direktiver ogkonvensjoner påvirker også reguleringen av medisinsk og helsefaglig forskning, og bidrar bl.a.til at det er store likhetstrekk mellom den nasjonale reguleringen i ulike land. EUspersonverndirektiv av 1995 og legemiddeldirektiv av 2001, samt Europarådets konvensjon ombiomedisin og menneskerettigheter av 1997, er eksempler på sistnevnte.Et offentlig utvalg som utredet reguleringen av medisinsk forskning,Nylenna-utvalget,fant at det ikke først og fremst var mangelen på regler som var problemet, selv om enkeltemangler fantes.9Hovedproblemet var, slik utvalget så det, at reglene var fragmenterte,kompliserte og utilgjengelige, og at meget få av den grunn syntes å ha tilfredsstillende oversiktover regelverket.For å få en oversikt over dagens forskningsregelverk, kan det være hensiktsmessig å skillemellom ulike typer handlingsnormer for medisinsk og helsefaglig forskning, ut fra hvilket formålnormene har (selv om disse naturligvis også må ses i sammenheng):•Beskyttelsesregler:Det er her tale om regler som tar sikte på å beskytte enkeltpersoners(forskningsdeltakeres) integritet.Hovedreglene er at samtykke fra den enkelte forskningsdeltaker (dvs. denpersonen som deltar i forskningen direkte eller indirekte, ved for eksempel avgivelse avvevsprøver eller personlige opplysninger) må foreligge. Forskningen må dessuten væreforsvarlig og i tråd med god forskningsskikk, samt være forhåndsvurdert av en av deregionale komiteer for medisinsk forskningsetikk (REK) og andre relevante instanser.Reglene omfatter ikke bare forskning på mennesker, men også bruk avutelukkende humant biologisk materiale og personopplysninger. Brudd på disse regleneNOU 2005:1 God forskning – bedre helse. Lov om medisinsk og helsefaglig forskning som involverer mennesker,humant biologisk materiale og helseopplysninger (helseforskningsloven).9
22
vil ofte anses som alvorlige, fordi de setter andre menneskers liv og helbred i fare, evt.krenker deres integritet (privatliv). Derfor følger disse reglene gjerne av lovbestemmelsereller ulovfestet rett.10Menneskerettighetsloven av 1999, helsepersonelloven av 1999,pasientrettighetsloven av 1999, spesialisthelsetjenesteloven av 1999, biobankloven av2001, personopplysningsloven av 2000 og helseregisterloven av 2001 er sentrale lover pådette området. Den såkalte Helsinki-deklarasjonen av 196411angir sentraleprofesjonsnormer. I tillegg tilkommer dyrevernlovgivningen ved dyreforsøk.•Vitenskapelige redelighetsregler:Det er her tale om regler som tar sikte på å regulereselve forskningen, som for eksempel normer for valg av metode, studiedesign oglignende, som skal sikre at forskningsresultatene er valide og at kunnskapen ergeneraliserbar. Derfor er det fundamentalt at data ikke manipuleres, fabrikkeres ellerforfalskes. Videre må ikke inklusjonen av forskningsdeltakere være utilbørlig selektiv, ogforskningsdata må oppbevares i en tid etter avslutning for å sikre etterprøvbarhet.Ærlighet, grundighet, fullstendighet og åpenhet er sentrale idealer her.12Brudd på en eller flere av slike atferdsnormer/regler (god vitenskapelig praksis)vil kunne medføre at forskningsresultatene ikke kan anses som gyldige (valide).Disse reglene er først og fremst uskrevne og følger av etablert vitenskapeligpraksis og god forskningsskikk, samt mer alminnelige krav til forsvarlighet.•Publiseringsregler (redelighetsregler):En tredje gruppe reguleringer er de som gjelderfor publisering av forskningsresultater. Det er her tale om regler som skal bidra tilåpenhet rundt og etterprøvbarhet av forskningsresultater, dvs. at det som står ipublikasjonen faktisk er riktig og fyllestgjørende, slik at andre kan bygge videre på disse.Det som taler for og mot (positive, så vel som negative) resultater må oppgis.Interessekonflikter, tilknytningsforhold og lignende som kan tenkes å ha påvirketresultatene bør også oppgis. En annen dimensjon, som også kan sies å høre hjemme i
10
NOU 2005:1 God forskning – bedre helse. Lov om medisinsk og helsefaglig forskning som involverer mennesker,humant biologisk materiale og helseopplysninger (helseforskningsloven)., Simonsen S, Nylenna M.Helseforskningsrett. Oslo: Gyldendal, 2005. Ruyter KW. Forskningsetikk. Oslo: Gyldendal, 2003.11Helsinki-deklarasjonen: World Medical Association Declaration of Helsinki. Ethical Principles for MedicalResearch Involving Human Subjects. Ferney-Voltaire: World Medical Association, 2004.12Benestad HB, Laake P. Forskningsmetode i medisin og biofag. Oslo: Gyldendal, 2004. Tranøy KE. Vitenskapen –samfunnsmakt og livsform. Oslo: Universitetsforlaget, 1986.
23
denne ”regelgruppen”, er regler og praksis vedrørende forfatterskap, plagiering ogopphavsrett.13Disse reglene følger også først og fremst av etablert vitenskapelig praksis og godforskningsskikk, samt mer alminnelige krav til forsvarlighet. Åndsverksloven av 1961 ogde såkalte Vancouver-reglene vil dessuten også kunne være relevante i dennesammenheng.
3.2
Ulike grader av normavvik, skyld og kritikkverdighet
Det er viktig å understreke at avvik fra normer og regelbrudd forekommer i mange nyanser – frade bagatellmessige til de eklatante.14Såkaltvitenskapelig uredeligheter i den nylig vedtatte forskningsetikkloven (ikke trådt ikraft) § 5 annet avsnitt, avgrenset til enkelte grove og alvorlige avvik, dvs. ”forfalskning,fabrikkering, plagiering og andre alvorlige brudd med god vitenskapelig praksis som er begåttforsettlig eller grovt uaktsomt”.Det forekommer naturligvis også ”mindre alvorlige” avvik, men som likevel kanrepresentere brudd på god forskningsskikk, som for eksempel mangelfulle kildehenvisninger,sviktende design, brudd på kvalitetssikringsrutiner, misvisende forfatterskap eller ved at man”ser bort fra” ekstreme eller uventede observasjoner og andre merkverdigheter som ikke heltstemmer med ens egen hypotese. Slike avvik må også tas på alvor, da de er egnet til å forringekvaliteten på og troverdigheten til forskningen, og til å skape klima for mer alvorlige avvik.Det er dermed en glidende overgang fra de bagatellmessige til de grove og mest alvorligeavvikene.På samme måte vil også skyldgraden variere, fra unnskyldelige feil, via tilfeller hvor manhandlet ubevisst men like fullt burde handlet annerledes (uaktsomhet), til forsettlige regelbrudd,begått med vitende vilje. Normavvik vil dermed kunne være kritikk- og klanderverdige selv omforskeren ikke handlet med vitende og vilje, men kanskje heller har vært uaktsom, uinteressert,uforsiktig, inkompetent eller lignende.Graden av kritikkverdighet vil dermed avhenge av graden av normavvik og skyld.
13
Ot.prp. nr. 58 (2005-2006) Om lov om behandling av etikk og redelighet i forskning; NOU 2005:1 God forskning– bedre helse. Lov om medisinsk og helsefaglig forskning som involverer mennesker, humant biologisk materiale oghelseopplysninger (helseforskningsloven)., Simonsen S, Nylenna M. Helseforskningsrett. Oslo: Gyldendal, 2005.Ruyter KW. Forskningsetikk. Oslo: Gyldendal, 2003. Benestad HB, Laake P. Forskningsmetode i medisin ogbiofag. Oslo: Gyldendal, 2004.14Nylenna M, Simonsen S. Scientific misconduct: a new approach to prevention. The Lancet 2006;367:1882-1884.
24
3.3
Personlig ansvar og overordnet systemansvar
Hovedregelen i norsk rett er at den enkelte er personlig ansvarlig for sine handlinger ogunnlatelser. Den enkelte vil dermed kunne bli holdt personlig ansvarlig for det man har gjort,eventuelt ikke gjort, men burde ha gjort, og bli møtt med forskjellige reaksjoner. Dette følgerbl.a. av det alminnelige ulovfestede uaktsomhetsansvaret og mer spesielle ansvarsregler.De aller fleste forskere er imidlertid vanlige arbeidstakere i offentlig eller privat sektor.Dermed vil det i tillegg kunne være tale om et systemansvar for den overordnede, dvs. den somer ansvarlig for den som faktisk har utført handlingen. Det personlige ansvar utelukker ikkesystemansvar, og motsatt.Arbeidsgiver er i utgangspunktet ansvarlig for det deres ansatte forskere gjør, og heftersom hovedregel for de ansattes handlinger, uavhengig av om arbeidsgiver kan klandres ellerikke. Dette såkalte arbeidsgiveransvaret følger av skadeerstatningsloven § 2-1, hvor det i førsteledd første punktum heter:Arbeidsgiver svarer for skade som voldes forsettlig eller uaktsomt under arbeidstakers utføring av arbeideller verv for arbeidsgiveren, idet hensyn tas til om de krav skadelidte med rimelighet kan stille tilvirksomheten eller tjenesten, er tilsidesatt.
Forskning er for eksempel angitt som en av spesialisthelsetjenestens hovedoppgaver på lik linjemed medisinsk behandling, jf. spesialisthelsetjenesteloven § 3-8 nr. 3. Dermed vil de kravspesialisthelsetjenesteloven stiller til forsvarlighet, organisering og ledelse på ulike nivå kommetil anvendelse på forskning. Helseforetakene er hierarkisk oppbygd, med staten som eier, og somi prinsippet har det øverste ansvar samt styrings- og instruksjonsrett, jf. helseforetaksloven §§ 3og 7.15Staten har imidlertid utpekt et styre, som igjen har utpekt en daglig leder, administrerendedirektør, med det daglig ansvar og styrings- og instruksjonsrett, jf. helseforetaksloven § 37. Mendette ansvaret, herunder styrings- og instruksjonsretten, vil være delegert nedover og spredt påklinikksjefer, avdelingsledere, seksjonssjefer og prosjektledere (herunder prosjektledere forforskningsprosjekter, dvs. den person som har det daglige ansvaret for et konkretforskningsprosjekt).16I spesialisthelsetjenesteloven § 3-9 heter det at det skal være en ansvarligleder på hvert nivå. Men slik hierarkisk delegering (linjeledelse) betyr ikke at den overordnede ilinjen mister sitt ansvar. Det er i prinsippet ikke noe i veien for at det overordnede ansvaret erdelt, for eksempel mellom et helseforetak og et universitet. I slike tilfeller vil det imidlertidnormalt være tale om et solidarisk ansvar, dvs. at begge institusjoner er ansvarlig uavhengig avhverandre – en for alle, alle for en. Generelt må det antas at den institusjonen som den daglige1516
Buskop T. Hvem har ansvaret for et forskningsprosjekt?www.forskningsjus.no,2006.Simonsen S, Nylenna M. Helseforskningsrett. Oslo: Gyldendal, 2005.
25
forskningen har nærmest tilknytning til, typisk sykehuset, har det primære ansvaret forforskningen.Tilrettelegging og forsvarlig organisering av forskningen, med angivelse avansvarsforhold og lignende, er dermed sentrale oppgaver for arbeidsgiver, dvs.forskningsinstitusjonen. Ved forskning må det selvfølgelig tas tilbørlig hensyn til den sedvanligeakademiske frihet, dvs. at arbeidsgiver ikke på en utilbørlig måte må forsøke å påvirke forskning.Arbeidsgiver kan imidlertid ikke gi ansatte forskere blanko-fullmakter og fraskrive seg ethvertansvar. Arbeidsgiver vil dermed også kunne bli holdt ansvarlig på selvstendig grunnlag, foreksempel pga. manglende rutiner, opplæring, ledelse, kontroll og tilsyn i forbindelse medforskning så vel som medisinsk behandling. Dette gjelder spesielt hvor pasienter,pasientmateriale, pasientdata, dyr eller andre sensitive forskningsobjekter involveres iforskningen.I den gjeldende Lov om universiteter og høgskoler av 1. april 2005 § 1-5 uttrykkes deteksplisitt at universiteter og høgskoler ikke kan gis pålegg eller instrukser om læreinnholdet iundervisningen og innholdet i forskningen eller det kunstneriske og faglige utviklingsarbeidet. Ievalueringer av norsk forskning etterlyses samtidig sterkere faglig ledelse. Faglig ledelse ogstyringsstruktur vil kunne sette rammer for den enkelte vitenskapelig ansattes forskning. Det kanderfor ligge en spenning mellom den enkeltes akademiske frihet og institusjonens fagligelederansvar på alle nivåer, selv om loven ikke inneholder bestemmelser som direkte kan sies åinnskrenke individuell akademisk frihet på noen uheldig måte.I innstillingen fra kirke-, utdannings- og forskningskomiteen til forskningsetikkloven,Innst.O.nr.70 (2005-2006), heter det:Komiteen tar i likhet med Regjeringen utgangspunkt i at forskning foregår under betydelig grad av frihet ogtillit, og derved også en betydelig grad av personlig ansvar for den enkelte forsker. Samtidig er det grunn tilå understreke at forskningsinstitusjonene har et selvstendig ansvar for kontroll og ledelse. Institusjonenesfaglige lederansvar må imidlertid hele tiden vurderes opp mot hensynet til den akademiske frihet og denenkelte vitenskapelig ansattes rettigheter. Komiteen har merket seg at dette spørsmålet blir utredet av detsåkalte Underdal-utvalget, som skal avgi innstilling i oktober 2006.
Her skal det bemerkes at ansatte forskere, til tross for disse formelle utgangspunkter,tradisjonelt har hatt en meget fri rolle ved de fleste offentlige forskningsinstitusjoner, bl.a. for åsikre nettopp forskningens faglige uavhengighet. Det skal imidlertid påpekes at det ikkenødvendigvis er et motsetningsforhold mellom faglig integritet og uavhengighet, og etoverordnet ansvar for og tilsyn med at institusjonens virksomhet er forsvarlig.
26
Et behov for større bevisstgjøring av forskningsinstitusjonenes ansvar og plikter er etgjennomgående tema i utredninger av regulering av medisinsk og helsefaglig forskning.17Veiledere ved doktorgrads- eller mastergradsprosjekter kan ha ulike roller, og er ikkenødvendigvis en del av forskningsinstitusjoners linjeledelse. I klinisk forskning vil veileder ofteogså være medforsker, og da gjerne prosjektleder, slik at vedkommende innehar det dagligeansvaret for det konkrete forskningsprosjektet. Veileder vil da ha et overordnet linjeansvar forstipendiaten eller studenten. Men veileder kan også ha en mer tilbaketrukket rolle, ved atvedkommende utelukkende fungerer som rådgiver og samtalepartner (mentor). Veileders ansvarvil i slike tilfeller være mer beskjedent og avledet. Veilederrollen er omtalt nærmere underavsnitt 3.7.
3.4
Reglenes virkning i tid
Det er et grunnleggende rettsikkerhetsprinsipp at det er reglene som gjaldt på den tidenhandlingen eller unnlatelsen skjedde som kommer til anvendelse.I og med at forholdene i denne konkrete saken spenner over et tidsrom fra 1993 til 2006,har det vært viktig for kommisjonen å klargjøre hvilke regler som til enhver tid var gjeldende.Som et utgangspunkt må det kunne sies at dagens grunnleggende hovedprinsipper, sompresentert over, har stått fast siden 1993 da Jon Sudbø påbegynte sitt doktorgradsprosjekt og sinvitenskapelige karriere. Vitenskapelig uredelighet var med andre ord uakseptabelt da som nå.Kommisjonen har i denne forbindelse innhentet uttalelser fra REK-Sør, Datatilsynet,NSD og Sosial- og helsedirektoratet. Disse instansene gir klart uttrykk for at de reglene vi har idag på de områder som har vært aktuelle i denne saken, i det alt vesentlige tilsvarer de reglene ogprinsippene som eksisterte og ble praktisert i 1993. Eksempelvis gjaldt således kravene tilkonsesjon for, og forhåndsvurdering av, forskningsprosjekter fra hhv. Datatilsynet og Regionalkomité for medisinsk forskningsetikk da som nå. Det samme gjaldt krav om entendeltakersamtykke eller dispensasjon fra taushetsplikt fra Sosial- og helsedirektoratet for bruk avtaushetsbelagte pasientopplysninger i forskning. Tidligere, før 1. januar 2002, var dennemyndighetsoppgaven tillagt Statens helsetilsyn.På den annen side har det skjedd en viss innstramming av reglene på det mer detaljertenivå, som for eksempel personvernreglene. Viktigst er kanskje en stadig økende bevisstgjøringomkring hvilke regler som gjelder, blant forskere, institusjoner og myndighetsorganer.
17
NOU 2005:1 God forskning – bedre helse. Lov om medisinsk og helsefaglig forskning som involverer mennesker,humant biologisk materiale og helseopplysninger (helseforskningsloven).; Ot.prp. nr. 58 (2005-2006) Om lov ombehandling av etikk og redelighet i forskning.
27
Ansatte ved Rikshospitalet - Radiumhospitalet HF og Universitetet i Oslo har også fåttstadig flere og klarere interne regler og instrukser å forholde seg til på arbeidsplassen enn dehadde tidligere.
3.5
Særlig om forfatterskap
3.5.1 Noen utgangspunkterKommisjonen finner det nødvendig med en innledende presentasjon av regler og praksis relaterttil spørsmål som knytter seg til forfatterskap på et mer generelt plan, før man kommentererenkeltstående forhold.Kommisjonen vil under dette punkt først vise til at diskusjonen om forfatterskap,medforfatterskap og bidragsytere innen medisinsk forskning er et gammelt og stadigtilbakevendende tema, som har vært gjenstand for omfattende diskusjoner internasjonalt i enårrekke. Spørsmålet om hvem som er rettmessig forfatter av en artikkel, er et av de mestomdiskuterte og omstridte spørsmål innen medisinsk publisering.18Det kan anføres flere argumenter for at det bør gjelde enhetlige regler for forfatterskap.For det førsteforutsetter ansvarligheten overfor leserne, herunder det vitenskapeligemiljø, at den eller de som er angitt som forfattere virkelig kan stå inne for budskapet sompresenteres.For det andrevil ulike krav til og ulik praktisering av regler om forfatterskap kunne gi eturiktig og urettferdig grunnlag for sammenligninger innenfor det meritteringssystem hvorvitenskapelig forfatterskap spiller en hovedrolle. Ett aspekt i denne forbindelse er også18
Om denne diskusjonen, se bl.a Bates T, Anič A, Marušič M, Marušič A. Authorship Criteria and Disclosure of
Contributors. Comparison of 3 General Medical Journals With Different Author Contribution Forms. JAMA 2004;292: 86–88; Bhopal R et al. The vexed question of authorship: views of researchers in a British medical faculty.BMJ 1997; 314: 1009; Hoen WP, Walvoort HC, Overbeke AJPM. What Are the Factors Determining Authorshipand the Order of the Authors’ Names?, A Study Among Authors of the Nederlands Tijdschrift voor Geneeskunde(Dutch Journal of Medicine). JAMA 1998; 280: 217–218; Kwok LS. The White Bull effect: abusive coauthorshipand publication parasitism. J Med Ethics 2005; 31: 554–556; Nylenna M. Forfatterskapskriteriene er endret.Tidsskrift for Den Norske Lægeforening 2000; 120: 1844; Pignatelli B, Maisonneuve H, Chapuis F. Authorshipignorance: views of researchers in French clinical settings. J Med Ethics 2005; 31: 578–581; Rennie D, Flanagin A,Yank V. The Contributions of Authors. JAMA 2000; 284: 89–91; Sheikh A. Publication ethics and the researchassessment exercise: reflections on the troubled question of authorship. Journal of Medical Ethics 2000; 26: 422–426; Sox HC. Research Misconduct, Retraction, and Cleansing the Medical Literature: Lessons from the PoehlmanCase. Annals of Internal Medicine 2006; 144: E-7–E-11; Yank V, Rennie D. Disclosure of ResearcherContributions: A Study of Original Research Articles in The Lancet. Annals of Internal Medicine 1999; 130: 661–670.
28
finansieringssystemer innen vitenskapelig forskning, hvor forfatterskap er ett suksesskriterium iforhold til tildeling av forskningsstøtte. De siste årene er de økonomiske insentivene knyttet tilslike forfatterskap styrket av myndighetene.
3.5.2 Vancouver-reglene for medisinsk publiseringSentralt i diskusjonen om forfatterskap innenfor medisinsk og helsefaglig forskning står desåkalte Vancouver-reglene eller -kriteriene.19Disse standardiserte kriteriene ble utarbeidet i regiav en liten gruppe av redaktører av internasjonale medisinske tidsskrift, som møttes uformelt iVancouver i 1978, med formål å etablere retningslinjer for manuskripter levert tilpublikasjonene. Gruppen ble etter hvert kjent som Vancouver-gruppen, og publiserteretningslinjene første gang i 1979. Vancouver-gruppen ekspanderte, og utviklet seg etter hvert tilThe International Committee of Medical Journal Editors (ICMJE), som møtes årlig. Kriterienehar vært gjenstand for stadige revisjoner. Vancouver-gruppen har vært en liten gruppe uten noenegentlig formell eller rettslig status. Til tross for dette, har Vancouver-gruppen opparbeidet segen autoritativ status, som nyter respekt hos forskere, akademiske institusjoner og offentligemyndigheter over hele verden. Vancouver-reglenes autoritative kraft kan i stor grad tilskrives deviktige medisinske tidsskriftene som er representert i gruppen, bl.a. de amerikanske NewEngland Journal of Medicine og Journal of the American Medical Assiciation (JAMA), samt debritiske British Medical Journal (BMJ) og The Lancet.Den grunnleggende tanken bak Vancouver-gruppens kriterier for forfatterskap er atforfatterskap er en intellektuell aktivitet, og at det er ideer, analyser og ikke minst selvemanuskriptutarbeidingen som er kjernepunktene i det vitenskapelige forfatterskap.20Denne tanken harmonerer godt med de mer alminnelige kriteriene for forfatterskap ogalminnelige opphavsrettslige prinsipper. Det skal imidlertid bemerkes at Vancouver-reglene ikkeer strengere enn mer alminnelige kriterier. Tvert i mot har Vancouver-reglene vært gjenstand forstadige tillempninger som gjør at de i dag fremstår som relativt liberale, i den forstand at foreksempel datainnsamling nå sidestilles med idé/design og analyse/fortolkning. Vancouver-reglene har gjennom revisjonene de siste 10 årene også nedjustert det ansvaret som må bæres avden enkelte forfatter, se vedlegg 2. Mens det i 1997 het at ”Hver enkelt forfatter skal ha deltatttilstrekkelig i arbeidet til å ta offentlig ansvar for innholdet”, heter det i senere versjoner at ”Hverenkelt forfatter skal ha deltatt tilstrekkelig i arbeidet til å ta offentlig ansvar for relevante deler avinnholdet”. I 2003-versjonen het det at ”en eller flere forfattere skal ta ansvaret for helheten avarbeidet, fra begynnelse til publisert artikkel”. I 2006-versjonen er dette ansvaret ytterligere19
Uniform Requirements for Manuscripts Submitted to Biomedical Journals: Writing and Editing for BiomedicalPublication – updated February 200620Nylenna M. Forfatterskapskriteriene er endret. Tidsskrift for Den Norske Lægeforening, 2000;120:1844
29
svekket til ”Noen tidsskrifter ber nå også om at en eller flere forfattere, som kalles garantister,identifiseres som de personene som skal ta ansvaret for helheten av arbeidet, fra begynnelse tilpublisert artikkel”.Vancouver-reglene kan således ses på som en presisering av de mer alminneligeforfatterskapsprinsipper som gjelder generelt på alle områder. Kriteriene er med andre ordtilpasset de særegne forhold som man mener eksisterer ved medisinsk forskning og publiseringav medisinske forskningsresultater i medisinske tidsskrifter. Forfatterskapskriteriene er dermedikke nødvendigvis betegnende for de prinsipper som gjelder utenfor det medisinske fagområdet.Herunder pekes det særlig på den nye endringen som kom i 2000 etter kritisk revisjon, hvor det åsamle inn data ble tillagt en verdi, som sammen med skriving og godkjennelse av manuskriptkan gi opphav til forfatterskap. Dette at leveranser av datamateriale vil kunne kvalifisere tilforfatterskap har, slik kommisjonen ser det, sammenheng med at dette er utbredt i det medisinskefagmiljøet, og at det ofte er en forutsetning for å kunne utføre medisinsk og helsefagligforskning. Man er i stor grad avhengig av underleverandører, som ikke nødvendigvis deltar i denintellektuelle prosessen av forskningsprosjektet og/eller publiseringen av forskningsresultatene,men som like fullt innehar en vesentlig rolle i forskningsprosjektet. De er nødvendigebidragsytere for at forskningsprosjektet skal kunne gjennomføres. Dette bidraget og denkompetanse som ligger hos underleverandørene, må på en eller annen måte synliggjøres ogverdsettes. Disse forholdene, i kombinasjon med at medisinske publikasjoner også er blitt enviktig meritterende faktor i det medisinske miljøet, har resultert i en praksis hvor personer blirkreditert for sin innsats i forskningsprosjektet gjennom et medforfatterskap, uten at denødvendigvis har bidratt i særlig grad til den intellektuelle prosessen og skapelsen av selveåndsverket som man forbinder med forfatterskap generelt. I mange viktige medisinske studier erdet ikke uvanlig at en artikkel har fra 20-50 medforfattere. Det typiske bidraget, som er i fulloverensstemmelse med Vancouver-reglene, kan da være bidrag med pasienter eller annetdatamateriale samt kritisk gjennomgang av et endelig manuskript og godkjennelse av dette. Formange, og da særlig allmennheten, kan det virke noe uforståelig at man på denne måten fjernerseg fra alminnelige oppfatninger om forfatterbegrepet.De forfatterskapskriteriene som angis i Vancouver-reglene må ses i lys av at medisinskforskning ofte bærer preg av samarbeidsprosjekter. Ofte samarbeider man på tvers avfagområder, for eksempel ved at laboratorier og statistikere samarbeider med klinikere ogepidemiologer. Videre samarbeides det på tvers av institusjoner, og ikke minst på tvers avlandegrenser. Man får dermed en oppsplitting av arbeids- og ansvarsområder. I debatten som harvært rundt medforfatterskap, har disse momentene stått sentralt.
30
En slik fordeling av oppgaver vil imidlertid også kunne bidra til at ansvaret pulveriseres.I Vancouver-reglene er det tatt hensyn til dette, på den måten at det ved publisering i regi avstørre forskningsgrupper skal være en eller flere forfattere/medforfattere som tar hovedansvaretfor publikasjonen og prosjektet som helhet, på samme måte som en prosjektleder vil hahovedansvaret for planlegging, gjennomføring og avslutning av forskningsprosjektet som helhet.For fullstendighetens skyld finner kommisjonen det hensiktsmessig å innta de sentralebestemmelsene i Vancouver-reglene i sin helhet, slik disse lyder per 1. juni 2006:“II. Ethical Considerations in the Conduct and Reporting ofResearchII.A Authorship and ContributorshipII.A.1. Byline AuthorsAn “author” is generally considered to be someone who has made substantiveintellectual contributions to a published study, and biomedical authorshipcontinues to have important academic, social, and financial implications. (1) Inthe past, readers were rarely provided with information about contributions tostudies from those listed as authors and in acknowledgments. (2) Some journalsnow request and publish information about the contributions of each personnamed as having participated in a submitted study, at least for original research.Editors are strongly encouraged to develop and implement a contributorshippolicy, as well as a policy on identifying who is responsible for the integrity of thework as a whole.While contributorship and guarantorship policies obviously remove much of theambiguity surrounding contributions, it leaves unresolved the question of thequantity and quality of contribution that qualify for authorship. The InternationalCommittee of Medical Journal Editors has recommended the following criteria forauthorship; these criteria are still appropriate for those journals that distinguishauthors from other contributors.• Authorship credit should be based on 1) substantial contributions toconception and design, or acquisition of data, or analysis andinterpretation of data; 2) drafting the article or revising it critically forimportant intellectual content; and 3) final approval of the version to bepublished. Authors should meet conditions 1, 2, and 3.• When a large, multi-center group has conducted the work, the groupshould identify the individuals who accept direct responsibility for themanuscript (3). These individuals should fully meet the criteria forauthorship defined above and editors will ask these individuals tocomplete journal-specific author and conflict of interest disclosure forms.When submitting a group author manuscript, the corresponding author
31
should clearly indicate the preferred citation and should clearly identify allindividual authors as well as the group name. Journals will generally listother members of the group in the acknowledgements. The NationalLibrary of Medicine indexes the group name and the names of individualsthe group has identified as being directly responsible for the manuscript.• Acquisition of funding, collection of data, or general supervision of theresearch group, alone, does not justify authorship.• All persons designated as authors should qualify for authorship, and allthose who qualify should be listed.• Each author should have participated sufficiently in the work to take publicresponsibility for appropriate portions of the content.Some journals now also request that one or more authors, referred to as“guarantors,” be identified as the persons who take responsibility for the integrityof the work as a whole, from inception to published article, and publish thatinformation.Increasingly, authorship of multi-center trials is attributed to a group. All membersof the group who are named as authors should fully meet the above criteria forauthorship.The order of authorship on the byline should be a joint decision of the co-authors.Authors should be prepared to explain the order in which authors are listed.
II.A.2. Contributors Listed in AcknowledgmentsAll contributors who do not meet the criteria for authorship should be listed in anacknowledgments section. Examples of those who might be acknowledgedinclude a person who provided purely technical help, writing assistance, or adepartment chair who provided only general support. Editors should ask authorsto disclose whether they had writing assistance and to identify the entity that paidfor this assistance. Financial and material support should also be acknowledged.Groups of persons who have contributed materially to the paper but whosecontributions do not justify authorship may be listed under a heading such as“clinical investigators” or “participating investigators,” and their function orcontribution should be described—for example, “served as scientific advisors,”“critically reviewed the study proposal,” “collected data,” or “provided and caredfor study patients.”Because readers may infer their endorsement of the data and conclusions, allpersons must give written permission to be acknowledged.”
32
Vancouver-reglene stiller opp tre sentrale vilkår for medforfatterskap:1) substantial contributions to conception and design, OR aquisition ofdata, OR analysis and interpretation of data,2) drafting the article OR revising it critically for importantintellectual content; and3) final approval of the version to be published.Alle tre kriterier skal være oppfylt.
Tabell 1: Vancouver-reglenes hovedkriterier for forfatterskapSom det fremgår av tabell 1 skal alle tre kriterier være oppfylt, men slik at det er tilstrekkelig atett av alternativene under hhv 1 og 2 er oppfylt. Det betyr at samtlige forfattere må ha værtinvolvert i den intellektuelle prosessen det er å skrive en vitenskapelig publikasjon, se vilkår 2,og ”tilleggskravet” om at samtlige forfattere må ha deltatt tilstrekkelig i arbeidet til offentlig åkunne ta ansvaret for passendedelerav innholdet i publikasjonen. Det understrekes at dissekriteriene har vært under utvikling. I vedlegg 2 har kommisjonen laget en tabell som viserhvordan de sentrale kriterier så ut på forskjellige tidspunkt.Som det også fremgår, sondrer Vancouver-reglene mellom forfattere og bidragsytere(contributors). Bidragsytere som ikke kvalifiserer som forfatter, ved at de ikke oppfyller alle trevilkårene, skal angis og anerkjennes i et eget avsnitt,”acknowlegdement”.Eksempler på slikebidragsytere kan være en person som yter hjelp utelukkende ved datainnsamling, delanalyser,teknisk hjelp, skriveassistanse, eller mer generell støtte.
3.5.3 Medisinsk forsknings forhold til Vancouver-regleneVancouver-reglene representerer rettslig sett ikke noen form for tvingende lovgivning. Kriterienehar karakter av å være retningslinjer som har autoritet i kraft av den grad av etterlevelse avprinsippene som skjer i praksis.Flere av publikasjonene som det er vist til over, viser imidlertid både at Vancouver-reglene i varierende grad er kjent blant medisinske forskere, og at de også i varierende gradaksepteres eller praktiseres av de forskere som kjenner prinsippene.På bakgrunn av det samlede inntrykk kommisjonen blant annet har fått gjennom arbeidet,synes det også innen medisinsk forskning i Norge å gjøre seg gjeldende ulike oppfatninger omVancouver-reglenes autoritet. Det er kommisjonens inntrykk at prinsippene ikke er (eller har
33
vært) godt kjent i alle miljøer, til tross for at de fleste nok har ”hørt om” dem. Det er ogsåkommisjonens inntrykk at prinsippene i enkelte forskningsmiljøer praktiseres nokså lempelig.Kommisjonen understreker at disse inntrykk er basert på et begrenset materiale, menfinner likevel grunn til å gi uttrykk for disse observasjoner, i det det for kommisjonen fremstårsom åpenbart at en eventuell slik utstrakt avvikende praktisering – eller ikke-praktisering – avVancouver-reglene i en større del av det medisinske forskningsmiljøet, åpenbart vil måtte tashensyn til i vurderingen av hvorvidt det foreligger grunnlag for kritikk mot medforfatternes rollei saken. Kommisjonens inntrykk på dette punkt harmonerer for øvrig med de funn som erdokumentert i internasjonale tidsskrifter.Kommisjonen viser særlig til en britisk undersøkelse blant 66 forskere, som fant at 76%støttet kriterier for forfatterskap, men at få hadde kunnskap om eller benyttet tilgjengeligekriterier. Av de fem personene som kunne spesifisere alle tre Vancouver-reglene, var det bare enperson som hadde kunnskap om at alle tre kriterier skulle være oppfylt.21Undersøkelsen konkluderte med at ”there seems to be a gap between editors’ criteria forauthorship and researchers’ practice”, og at “the strategy for communicating and implementingthe criteria of the International Committee of Medical Journal Editors has largely failed. Newinitiatives should engage researchers and meet their legitimate needs. Future guidelines shouldbe developed collaboratively and not be imposed on researchers by editors.”Lignende avvik mellom Vancouver-prinsippene og det som praktiseres i medisinskeforskningsmiljøer i andre land er dokumentert i andre artikler.22På den annen side er det klart at så vel tidsskrifter som forskningsinstitusjoner må kunnepraktisere og håndheve Vancouver-reglene som om disse var bindende, og ikke bare veiledende.De kan dermed stille krav om at forfattere som hhv. publiserer eller arbeider hos dem, følgerdisse kriteriene. Dermed vil kriteriene fremstå som tvingende for disse forskerne. For eksempelhar ledelsen ved Radiumhospitalet overfor kommisjonen klart gitt uttrykk for at Vancouver-reglene gjelder for forskere ved institusjonen, og forutsettes fulgt. Dette kravet må kunne ansessom en bindende arbeidsinstruks som arbeidsgiver må kunne gi og håndheve. Det er imidlertidfor kommisjonen uklart om og eventuelt i hvilken grad denne instruksen har nådd frem til ogblitt praktisert av de ansatte ved institusjonen.
21
Bhopal R et al. The vexed question of authorship: views of researchers in a British medical faculty. BMJ 1997;314: 100922Pignatelli B, Maisonneuve H, Chapuis F. Authorship ignorance: views of researchers in French clinical settings. JMed Ethics 2005; 31: 578–581.
34
3.5.4 ForfatteransvaretUt i fra Vancouver-reglene og andre regler for forfatterskap kan det synes uklart hvilket ansvarden enkelte forfatter har ved publikasjon av forskningsresultater. Etter kommisjonens oppfatningmå dette ansvaret ses i lys av alminnelig ansvarsregler, se punkt 3.3.For forfattere betyr det at man må ta ansvar for det man har gjort, eventuelt ikke har gjort,men burde ha gjort. Det er følgelig ikke nødvendigvis det forhold at man står som forfatter ellermedforfatter som er avgjørende for ansvarsspørsmålet. Det er først og fremst hva man faktisk hargjort eller ikke gjort. Det betyr videre at det kan aksepteres at enkeltforfattere har ansvar forforskjellige elementer, selv hvor de opptrer i fellesskap, så sant det lar seg fastlegge hva denenkelte har gjort. Når flere personer er sammen om å utarbeide en publikasjon, så ligger detimplisitt i dette at man i ikke ubetydelig grad må basere seg på og stole på det ensamarbeidspartner eller andre involverte gir av opplysninger om andre deler avforskningsarbeidet. På en annen side kan det selvfølgelig tenkes at en medforfatter eller andreblir holdt ansvarlig fordi det forelå forhold som tilsa at man burde ha reagert og foretatt nærmereundersøkelser.Å være forfatter innebærer imidlertid ikke at man ved å akseptere (med)forfatterskap,nærmest skriver under en kontrakt, og står ansvarlig for at absolutt alle sider ved det som står ipublikasjonen er korrekte. En slik fortolkning har ikke noe grunnlag eller legitimitet i dagensvirkelighet, heller ikke i gjeldende versjon av Vancouver-reglene, jf. kravet om ansvar for”passende deler”.
3.6
Tilbaketrekking av ikke-valide publikasjoner (Retraction)
For medisinske tidsskrifter eksisterer det kutymer for tilbaketrekking av ikke-validepublikasjoner som er publisert. Reglene for såkalt tilbaketrekking er imidlertid verken enhetligeeller helt klare, og det er relativt sjelden at slik tilbaketrekking forekommer. I Vancouver-gruppens retningslinjer punkt III.B er det inntatt retningslinjer for Corrections, Retractions and”Expression of Concern”, med følgende ordlyd:
“III.B. Corrections, Retractions and "Expressions of Concern"Editors must assume initially that authors are reporting work based on honest observations. Nevertheless,two types of difficulty may arise.First, errors may be noted in published articles that require the publication of a correction or erratum of partof the work. The corrections should appear on a numbered page, be listed in the contents page, include thecomplete original citation, and link to the original article and vice versa if online. It is conceivable that anerror could be so serious as to vitiate the entire body of the work, but this is unlikely and should be handledby editors and authors on an individual basis. Such an error should not be confused with inadequacies
35
exposed by the emergence of new scientific information in the normal course of research. The latter requireno corrections or withdrawals.The second type of difficulty is scientific fraud. If substantial doubts arise about the honesty or integrity ofwork, either submitted or published, it is the editor’s responsibility to ensure that the question isappropriately pursued, usually by the authors’ sponsoring institution. However, it is not ordinarily the taskof editors to conduct a full investigation or to make a determination; that responsibility lies with theinstitution where the work was done or with the funding agency. The editor should be promptly informedof the final decision, and if a fraudulent paper has been published, the journal must print a retraction. If thismethod of investigation does not result in a satisfactory conclusion, the editor may choose to conduct his orher own investigation. As an alternative to retraction, the editor may choose to publish an expression ofconcern about aspects of the conduct or integrity of the work.The retraction or expression of concern, so labeled, should appear on a numbered page in a prominentsection of the print journal as well as in the online version, be listed in the contents page, and include in itsheading the title of the original article. It should not simply be a letter to the editor. Ideally, the first authorshould be the same in the retraction as in the article, although under certain circumstances the editor mayaccept retractions by other responsible persons. The text of the retraction should explain why the article isbeing retracted and include a full original citation reference to it.The validity of previous work by the author of a fraudulent paper cannot be assumed. Editors may ask theauthor’s institution to assure them of the validity of earlier work published in their journals or to retract it.If this is not done editors may choose to publish an announcement expressing concern that the validity ofpreviously published work is uncertain.”
3.7
Nærmere om forskerutdanning/forskeropplæring ogveilederrollen
Siden 1993 har det nasjonale reglementet Standardforskrift for doktorgrader med krav omorganisert forskerutdanning utgjort et felles grunnlag for organisert forskerutdanning i Norge.Den organiserte forskerutdanningen innebærer at den tradisjonelle dr.philos-graden etter hvertskulle erstattes av fagspesifikke doktorgrader, det ble innført obligatorisk kursundervisning for ågi forskerutdanningen større bredde, og forholdet mellom doktorgradsstudent og veileder skulleformaliseres gjennom skriftlige avtaler.Universitetene har et hovedansvar for forskerutdanningen i Norge. Likevel har anslagsvisen tredjedel av doktorgradsstudentene sin hovedarbeidsplass ved andre institusjoner, og får ibetydelig grad veiledning av personer som ikke er ansatt ved universitetene. I tillegg tildoktorgradsstudentenes egne intellektuelle forutsetninger, er det veilederne og forskningsmiljøetsom studentene har tilknytning til, som er av størst betydning for kvaliteten og effektiviteten iforskerutdanningen. Relasjonen mellom veileder og doktorgradsstudent er her et kritisk punkt.Analyser av utviklingen av den organiserte forskerutdanningen viser store variasjoner nårdet gjelder tilpasninger til det felles reglementet, i praktiseringen av det, i tolkninger av de36
faglige kravene til en doktorgrad, i holdninger til veiledning og i synet på kursdelens omfang oginnretning. Variasjonene knytter seg særlig til ulike fagspesifikke tradisjoner som har hengtigjen, og det synes ofte å oppstå et spenningsforhold mellom kravene til selvstendigforskningsinnsats og kravene til veileders bidrag i arbeidet med avhandlingen.23I hovedtrekk innebærer det å være forskerrekrutt at man skal gjennomføre enforskerutdanning med en avlagt doktorgrad som endelig mål. Slik sett vil doktorgradsstudentenvære i en utdanningssituasjon, og rollen vil ha visse likhetstrekk med studentrollen.På den annen side har doktorgradsstudenten avsluttet universitetsutdannelsen påhovedfags-/masternivå, og har dessuten gjerne en viss arbeidserfaring. Den vesentligste delen avdoktorgradsutdanningen består da også av mer eller mindre selvstendig forskning. Slik sett vil dekunne sammenlignes med ordinært tilsatt vitenskapelig og/eller klinisk personell. Dette trekker iretning av at forskerrekruttene ligger nært ordinært vitenskapelig ansatte når det gjelderrettigheter og plikter.Som et utgangspunkt kan det derfor være naturlig å anse rekruttene som studenter når destuderer og deltar på kurs/seminarer og lignende, og som ansatt vitenskapelig personell når de forøvrig driver med forskning.Rekruttenes personlige ansvar må imidlertid avgjøres konkret i forhold til den enkeltesituasjon. Enkelte stipendiater arbeider nokså selvstendig og fremstår som de factoprosjektledere for sine doktorgradsprosjekt, hvor de også har et betydelig/det vesentlige ansvarfor prosjektets planlegging, gjennomføring og avslutning. Andre rekrutter vil gjerne være i etlangt mer underordnet forhold, hvor typisk veileder også er prosjektleder, medforsker oginnehaver av det daglige ansvarer for doktorandens prosjekt fra begynnelse til slutt, uten at detteutelukker et personlig ansvar også for rekrutten.Det å være veileder er således en sentral oppgave i forskerutdanningen. Til tross forovennevnte retningslinjer, finnes det ikke klare og entydige regler for veiledernes rolle når detgjelder opplæring i god forskningsskikk i bred forstand (yrkesetikk for forskere). Veilederrollenog hvilken status veileder har, er i stor grad basert på kutymer i forskningsmiljøene, tilpassetspesielle forhold ved den enkelte institusjon, det enkelte fag- og forskningsmiljø, og ikke minstkonkrete avtaler mellom og omstendigheter ved det enkelte veileder og/eller stipendiatforhold. Iheftet PhD-veiledning et idéhefte utarbeidet av tre danske medisinske forskere heter det på side8:”Formålet med vejledningen er i en mesterlæresituation at inspirere og kommentere den Ph.D.-studerendespersonlig indsats og det arbejde, der kommer ud af det. Desuden skal man som vejleder fungere som en23
Kyvik S. Forskerutdanning. I Magnus Gulbrandsen M, Smeby JS (red). Forskning ved universitetene. Oslo:Cappelen Akademisk forlag, 2005.
37
personlig støtte. Målet med vejledningen er ikke primært at formidle kundskaber og viten om metoder, mensnarere at være katalysator for den studerendes utvikling som forsker. … Vejledning er en proces, hvorman ved en kombination af induktiv og deduktiv pædagogik skal hjælpe den Ph.D.-studerende til aterkende problemer og finde løsninger på disse.”24
Disse generelle betraktningene synes også å ha noe for seg i en norsk kontekst.Det heter videre i heftet at veileder ikke nødvendigvis er det samme som prosjektleder. Veilederkan selvfølgelig være prosjektleder, men det er ingen automatikk i en slik dobbeltfunksjon.Det er heller ingen automatikk i at man som veileder også skal være medforfatter ellersisteforfatter på stipendiatens publikasjoner, selv om det spesielt innenfor det medisinske miljøhar utviklet seg en viss tradisjon for dette. Veileder må i likhet med alle andre oppfylleforfatterskapskriteriene for å stå som forfatter.Veileder vil dermed i utgangspunktet primært fremstå som en rådgiver og samtalepartner,med mindre mer forpliktende ansvar og rettigheter følger av andre omstendigheter, som foreksempel at veilederen også står i linje over stipendiaten og er dennes nærmeste overordnede.Det har etter hvert blitt vanlig at det ved opptak på doktorgradsprogrammer inngåes enkontrakt om faglig veiledning i doktorgradsutdanningen. På den annen side er disse kontrakteneofte så vage at de gir liten veiledning utover sedvanlige kutymer. I mangel av klare avtaler ogregler må altså en veileders ansvar og plikter og rettigheter avgjøres konkret.I henhold til Doktorgradsprogrammet ved Det medisinske fakultet, Universitetet i Oslo(vedtatt 14.6.2005) gjelder eksempelvis følgende regler:§ 8 VeiledningDoktorgradskandidat og veileder skal ha jevnlig kontakt. Hvis doktorgradskandidaten har flere veiledere,skal det oppnevnes en hovedveileder med primært ansvar for den faglige oppfølging avdoktorgradskandidaten.Minst en av veilederne skal være ansatt ved det fakultet doktorgradskandidaten er opptatt ved ellerved annen enhet ved universitetet godtatt av fakultetet. Alle veiledere skal ha doktorgrad eller tilsvarendefaglig kompetanse.Både (hoved)veileder og doktorgradskandidat plikter å rapportere i samsvar med de regler fakultetet harfastsatt.Veileder har i samråd med institusjonen ansvar for å legge til rette for at doktorgradskandidatendeltar regelmessig i et aktivt forskermiljø. For doktorgradskandidater som har tilknytning ved anneninstitusjon, skal det inngås avtale mellom gradstildelende og samarbeidende institusjon som regulererarbeidsvilkårene og herunder sikrer doktorgradskandidatens deltakelse i et aktivt forskermiljø.Hyppigheten av formalisert veilederkontakt (individuell veiledning og gruppeveiledning)avtalefestes.Minst én veileder skal være tilknyttet Det medisinske fakultet ved Universitetet i Oslo.24
Bentzen N, Hansen BL, Nexøe J (red.). Ph.D.-vejledning. Et idéhæfte. Købehavn, 1999.
38
Veileder skal:• Gi råd om formulering og avgrensning av tema og problemstilling• Drøfte og vurdere hypoteser og metoder• Gi hjelp til orientering i faglitteratur og datagrunnlag (bibliotek, arkiv, etc.)• Drøfte opplegg og gjennomføring av fremstillingen (disposisjon, språklig form, dokumentasjonm.v.)• Holde seg orientert om fremdriften i kandidatens arbeid og vurdere den i forhold tilarbeidsplanen• Hjelpe med å føre kandidaten inn i relevante vitenskapelige miljøer• Drøfte resultater og tolkningen av disse• Gi kandidaten veiledning i forskningsetiske spørsmål knyttet til avhandlingenDoktorgradskandidaten skal:• Legge frem rapporter eller utkast til deler av avhandlingen for veileder i samsvar meddoktorgradsavtalen• I sitt arbeid etterleve forskningsetiske prinsipper som gjelder for fagområdetPartene plikter å gi hverandre løpende informasjon om alle forhold av betydning for gjennomføringen avdoktorgradsutdanningen. Partene plikter aktivt å følge opp omstendigheter som kan medføre fare forforsinket eller manglende gjennomføring av doktorgradsutdanningen, slik at utdanningen så langt det ermulig, kan bli gjennomført.Doktorgradskandidat og veileder kan ved enighet anmode opptaksinstansen om å oppnevne nyveileder for kandidaten.Hvis en doktorgradskandidat eller veileder finner at den annen part ikke etterlever sineforpliktelser, plikter den part som hevder at det foreligger brudd på forpliktelser, å ta dette opp med denannen part. Kandidat og veileder skal i fellesskap søke å finne en løsning på den situasjonen som eroppstått.Hvis en doktorgradskandidat eller veileder finner at den annen part ikke oppfyller sineforpliktelser, og partene etter drøfting ikke er kommet til enighet om hvordan situasjonen skal løses, kankandidat eller veileder be om å bli løst fra veiledningsavtalen. En anmodning om å bli løst fraveilederavtalen skal stiles til Det medisinske fakultet og sendes via grunnenhet. Kopi av anmodningensendes til den annen part av den som reiser saken. Beslutning om å løse doktorgradskandidat og veileder fraveilederavtalen tas av Det medisinske fakultet.Det tilligger Det medisinske fakultet å godkjenne skifte av veileder når veileder ellerdoktorgradskandidat har anmodet om det.Veileder kan ikke i noe fall fratre før ny veileder er oppnevnt.
I søknadsskjemaet for opptak av Jon Sudbø på doktorgradsprogrammet i desember 2000 var dettilsvarende tatt inn en avtale om faglig veiledning med følgende hovedelementer:5. VEILEDNINGSFORHOLDET
39
I den faglige veiledningen skal veilederen særlig:••••etc.)•••Holde seg orientert om progresjonen i kandidatens arbeid og vurdere den i forhold tilHjelpe til med å føre kandidaten inn i relevante vitenskapelige miljøerDrøfte resultater og tolkningen av demarbeidsplanenGi råd om formulering og avgrensing av tema og problemstillingDrøfte og vurdere hypoteser og metoderGi hjelp til orientering i faglitteratur og datagrunnlag (bibliotek, arkiv, etc)Drøfte opplegg og gjennomføring av fremstillingen (disposisjon, språklig form, dokumentasjon
Dr. gradskandidaten forplikter seg til å legge frem rapporter eller utkast til deler av avhandlingen forveileder, eventuelt i sammenheng med seminar, hver(t)…Begge parter i veiledningsforholdet har krav på jevnlig kontakt og orientering om arbeidets gang.Rammene for dette fastsettes av det organ som godkjenner årlig fremdriftsrapport, jfr. punkt 4.
3.8
Oppbevaringsplikt og -rett for forskningsmateriale
3.8.1 ProblemstillingMateriale brukt i medisinsk og helsefaglig forskning består ofte av humant biologisk materiale(herunder biobanker), datafiler (herunder personregistre), pasientjournaler, analyser, notater,manuskriptutkast og liknende. Forskningsmaterialet ligger til grunn for forskningsresultatene.For at det i ettertid skal være mulig å kontrollere om forskingsresultatene stemmer og/eller erutført på en forsvarlig måte, er det ofte en forutsetning at det underliggende forskningsmaterialetkan undersøkes.I den forbindelse kan det reises spørsmål om, og i tilfelle hvordan og hvor lenge, forskeremå oppbevare forskningsmaterialet (oppbevaringsplikt).En annen problemstilling knytter seg til oppbevaringsretten – det vil si forskerensdisposisjonsrett over forskningsmaterialet: kan forskere slette forskningsmateriale når de vil,eventuelt oppbevare forskningsmateriale så lenge de ønsker og gjøre med det som de selv finnerdet tjenlig?Det finnes en del regler og retningslinjer om dette, men de er uklare og fragmenterte, ogav den grunn tilsynelatende nokså ukjente.
3.8.2 OppbevaringspliktenI henhold til god vitenskapelig praksis skal grunnlagsmateriale som utgangspunkt oppbevares forå sikre etterprøving. Hvor lenge dette skal oppbevares i henhold til vitenskapelig praksis, er40
vanskelig å angi. Denne normen er for eksempel konkretisert i forskrift for klinisk utprøving avlegemidler, hvor det i § 5-3, 2. og 3. ledd heter at det skal påses at kildedata er tilgjengelig påutprøvingsstedet i minst 15 år etter at sluttrapport foreligger. Nylenna-utvalget har også anbefaltat det lovfestes en oppbevaringsplikt for alt grunnlagsmateriale i 10 år etter atforskningsprosjektet er avsluttet (NOU 2005:1). I tillegg finnes det relevante regler om dette ibiobankloven, personopplysningsloven og helseregisterloven, uten at kommisjonen finner grunntil å gå i detalj på disse. Det finnes dessuten regler om oppbevaring og behandling avdokumenter i helsetjenesten i bl.a. spesialisthelsetjenesteloven, helsepersonelloven ogjournalforskriften. Arbeidsgiver kan også ha utarbeidet interne instrukser om dette. Dessuten vildokumenter utarbeidet av ansatte forskere ved offentlige institusjoner, som for eksempel etoffentlig sykehus, strengt tatt, selv om det ikke er praktisert slik i dag, kunne komme inn undermer generelle regler om oppbevaring og behandling av dokumenter som for eksempelarkivloven. Oppbevaringsplikten må naturligvis ta tilbørlig hensyn til de krav som stilles tilbehandling og oppbevaring av personidentifiserbare opplysninger.Som eksempel skal det også nevnes at Forskningsrådet i sine standardkontrakterforutsetter at forskningsmaterialet skal oppbevares i tråd med god vitenskapelig praksis. Igjeldende kontraktsvilkår ”Standardkontrakter og bevilgningsbrev – FOU” heter det blant annet:”Dersom ikke annet blir bestemt av den instans som har myndighet til å bestemme over bruken av dataene,skal kopi av alle forskningsgenererte data, inkludert nødvendig dokumentasjon, overføres til Norsksamfunnsvitenskapelig datatjeneste. Overføring skal finne sted så snart som mulig og senest to år etteravslutning av den perioden prosjektbevilgningene gjelder for. Hvilke data dette skal gjelde, må da avtaleskonkret med Forskningsrådet. … Prosjektansvarlig har ansvar for å følge relevante kvalitetsstandarder,lover og andre offentlige reguleringer. Hvis forsøkspersoner/pasienter/klienter inngår iforskningsprosjekter, kreves tilråding av regional komité for medisinsk forskningsetikk i henhold tilgjeldende regler om framleggelsesplikt. Prosjektansvarlig har ansvar for at tilrådingen blir fulgt. …Prosjektansvarlig skal arkivere sluttrapport og prosjektdata på en betryggende måte i minimum 10 år etteravslutningen av prosjektet. Den prosjektansvarlige pålegges å sikre at dataene oppbevares på en slik måte atde også vil bli tatt vare på og være tilgjengelige om den prosjektansvarlige opphører. Prosjektansvarligplikter å følge anerkjente kvalitetsnormer ved innsamling og arkivering av data. Brudd på forpliktelservedrørende rapportering og arkivering betraktes som vesentlig mislighold og gir dermed Forskningsrådetgrunnlag for å heve kontrakten, jf punkt. 12.2 ....”
For medisinsk og helsefaglig forskning har Forskningsrådet siden 1995 hatt avtale med Norsksamfunnsvitenskapelig datatjeneste (NSD) om arkivering av forskningsdata. For år 2000 gjaldt at”Prosjektansvarlig skal arkivere sluttrapport og prosjektdata på en betryggende måte i minimum10 år etter avslutningen av prosjektet. Den prosjektansvarlige pålegges å sikre at dataene
41
oppbevares på en slik måte at de også vil bli tatt vare på og være tilgjengelige om denprosjektansvarlige opphører” (les: institusjonen).
3.8.3 Oppbevarings- og disposisjonsrettNår det gjelder spørsmålet om disposisjonsrett mer generelt vises det til at forskningsmateriale,og i sær bruk og oppbevaring av humant biologisk materiale og personopplysninger, innsamletved eller i regi av en forskningsinstitusjon, som den klare hovedregel vil være underlagtinstitusjonens overordnede ansvar, og dermed også institusjonens disposisjonsrett. Denne typensensitivt materiale er ikke ansatte forskers private eiendom.25Dette må i dag være rimelig klartselv om en underrettsdom fra 199926kan tas til inntekt for den motsatte løsning.27
25
NOU 2005:1 God forskning – bedre helse. Lov om medisinsk og helsefaglig forskning som involverer mennesker,humant biologisk materiale og helseopplysninger (helseforskningsloven).26Rettens Gang (RG) 2000, side 1010.27Simonsen S, Nylenna M. Helseforskningsrett. Oslo: Gyldendal, 2005.
42
4
Klargjøring av fakta
4.1 Foranledningen – Lancet-artikkelenI desember 2005 leste Camilla Stoltenberg, divisjonsdirektør ved Nasjonalt folkehelseinstitutt, enartikkel publisert av en gruppe norske og utenlandske forskere i det internasjonalt megetanerkjente tidsskriftetThe Lancetoktober samme år:Sudbø J, Lee JJ, Lippman SM, Mork J, Sagen S, Flatner N, Ristimaki A, Sudbø A, Mao L, Zhou X, KildalW, Evensen JF, Reith A, Dannenberg AJ. Non-steroidal anti-inflammatory drugs and the risk of oralcancer: a nested case-control study. Lancet. 2005 Oct 15-21;366:1359-66.
Ved lesing av artikkelen ble Stoltenberg oppmerksom på enkelte refererte forhold som hun ikkefikk til å stemme med faktiske forhold. Dette ble drøftet med andre forskere påFolkehelseinstituttet. Kreftregisteret, som var oppgitt som leverandør av krefttilfellene, ble ogsåkontaktet. Kreftregisteret tok videre kontakt med professor dr.med. Lars Vatten ved NTNU.Vatten er bl.a. medlem av styringsgruppen for Cohort of Norway (CONOR), som det også varhenvist til i artikkelen. CONOR er både betegnelsen på en samling helsedata og blodprøver, oget samarbeid mellom Folkehelseinstituttet og universitetene om regionale helseundersøkelser. Itillegg er Vatten involvert i HUNT (Helseundersøkelsen i Nord-Trøndelag). Vatten lesteartikkelen og reagerte på flere åpenbare uoverensstemmelser med faktiske forhold. Han tok oppdette i en e-post som han sendte til førsteforfatter Jon Sudbø den 5. januar 2006. Den 10. januarble det avholdt et møte med Jon Sudbø og Albrecht Reith hos Kreftregisteret, hvor bl.a. Vattenvar til stede. Den 12. januar innrømmet Jon Sudbø overfor sine overordnede vedRadiumhospitalet at han hadde fabrikkert den datafilen som forskningsresultatene presentert iLancet-artikkelen bygget på. Det vil si at de angivelige pasientene som de analyserte dataenestammet fra, var fiktive. Jon Sudbø har senere bekreftet dette overfor kommisjonen. Jon Sudbøhar også forklart at det hefter mangler ved to andre artikler:Sudbø J, Samuelsson R, Risberg B, Heistein S, Nyhus C, Samuelsson M, Puntervold R, Sigstad E,Davidson B, Reith A, Berner A. Risk markers of oral cancer in clinically normal mucosa as an aid insmoking cessation counseling. J Clin Oncol. 2005 Mar 20;23:1927-33Sudbø J, Lippman SM, Lee JJ, Mao L, Kildal W, Sudbø A, Sagen S, Bryne M, El-Naggar A, Risberg B,Evensen JF, Reith A. The influence of resection and aneuploidy on mortality in oral leukoplakia. N Engl JMed. 2004 Apr 1;350:1405-13.
43
Lancet-artikkelen, er senere trukket tilbake. Tidsskriftredaksjonene har utstedt såkaltebekymringsmeldinger (”expression of concern”) vedrørende artiklene i Journal of ClinicalOncology 2005 og New England Journal of Medicine 2004, samt to artikler av Sudbø et alpublisert i samme tidsskrifter i henholdsvis 2002 og 2001.28På denne bakgrunn fant kommisjonen grunn til å granske hele Jon Sudbøs vitenskapeligevirksomhet og produksjon. Kommisjonen fant også grunn til å granske samtlige medforfatteresog andre aktørers rolle.Den sentrale oppgaven for kommisjonen har vært å kartlegge det materiale som ligger tilgrunn for publikasjonene. Viktige spørsmål har vært:•••••Er pasientene som hevdes å være studert reelle eller fiktive?Har pasientdata vært manipulert?Foreligger det alvorlige metodologiske feil?Foreligger det åpenbare og alvorlige feil i forskningsrapportering?Foreligger det andre alvorlige brudd på god vitenskapelig praksis/god forskningsskikk?
I tråd med disse utgangspunkter begynte kommisjonen sitt arbeid med å kartlegge detdatagrunnlag som ligger til grunn for Jon Sudbøs første store vitenskapelige prosjekt,doktorgradsprosjektet. Bakgrunnen for dette valget er at det grunnlagsmaterialet som ble samletinn i forbindelse med doktorgradsprosjektet, samt resultatene derav, er brukt i og ligger til grunnogså for Sudbøs senere forskning.Jon Sudbø har fått seg forelagt utkastet til rapport, dvs. det som i foreliggende rapporttilsvarer kapittel 4 til og med punkt 7.2.1, ved to anledninger. I brev av 30. mai 2006 har han gitten rekke kommentarer til det første rapportutkastet, som kommisjonen har sammenholdt medopplysninger som ellers er kommet fram under granskningen. Kommisjonen har korrigertutkastet på punkter hvor en har funnet faktisk grunnlag for å ta hensyn til Sudbøs merknader.Kommisjonen vil imidlertid presisere at disse kommentarene ikke har medført nevneverdigeendringer i kommisjonens vurderinger av validiteten av Sudbøs forskningsarbeider. En vesentligdel av Sudbøs innvendinger knytter seg til forholdet mellom ham og veileder Reith, i det Sudbøgjør gjeldende at veileder hadde en mye mer sentral rolle i forskningsprosjektet enn detkommisjonen har fått inntrykk av gjennom granskningen for øvrig. Kommisjonen vil enkelte28
Horton R. Retraction—Non-steroidal anti-inflammatory drugs and the risk of oral cancer: a nested case-controlstudy. The Lancet 2006; 367:382, Expression of concern for Sudbø et al., J Clin Oncol 23: 1927-1933.Journal of Clinical Oncology 2006; 24: pp. 2404; Curfman GD, Morrissey S, Drazen JM. Expression of concern:Sudbo J et al. DNA content as a prognostic marker in patients with oral leukoplakia. N Engl J Med 2001;344:1270-8and Sudbo J et al. the influence of resection and aneuploidy on mortality in oral leukoplakia. N Engl J Med2004;350:1405-13.
44
steder kommentere divergerende oppfatninger av fakta hvor dette anses nødvendig. Sudbø valgteå ikke kommentere på det reviderte rapportutkastet, som han deretter fikk tilsendt.
4.2 Doktorgradsprosjektet om munnhulekreft4.2.1 OpptaktJon Sudbø er utdannet tannlege (cand.odont.) fra 1985 og lege (cand.med) fra 1994 medtoppkarakterer. På odontologistudiet var han kullets beste. I 1993 søkte Sudbø, i samarbeid medprofessor dr. med. Albrecht Reith ved Radiumhospitalet, Kreftforeningen om finansiering av sittdoktorgradsprosjekt. Studien gikk ut på å finne fram til metoder for å forutsi kreft i munnhulen.Sudbø har fremholdt at det var Albrecht Reith som var den som tok initiativ til det aktuelleprosjektet. Dette skjedde ved at Reith tok kontakt med førsteamanuensis T. Ingar Leidal vedOdontologisk fakultet ved Universitetet i Oslo, for å be ham om å rekruttere en kandidat til etforskningsprosjekt på orale premaligne lidelser, som Reith hadde hatt under planlegging i noentid. Etter denne første kontakt i februar 1993, ble Sudbø kontaktet av Leidal, som mente at Sudbøkunne egne seg for et slikt prosjekt. Sudbø hadde imidlertid ikke tidligere arbeidet med denneproblemstillingen, som han fant interessant. Den første kontakt mellom Sudbø og Reith skjedde ifebruar eller tidlig i mars 1993. Kreftforeningen innvilget Sudbø et treårs stipend, med AlbrechtReith som hovedveileder. Sudbø var da fra 1994 lønnet av Kreftforeningen somrekrutteringsstipendiat.
4.2.2 Doktorgradsprosjekts temaBakgrunn:Det finnes ikke metoder for å angi hvilke dysplasier i munnhulen som også villekunne utvikles til kreft.Målsetting I:Av prosjektbeskrivelsen fra 1993 fremgår det at Sudbø og Reith ønsket å studeredet maligne transformasjonspotensialet gjennom en historisk prospektiv studie avleukoplakimateriale, for å kartlegge eventuelle strukturelle DNA-forandringer i dysplasier, ogsammenholde disse funn med hvilke personer som senere utviklet cancer. De ønsket også åinnlede en prospektiv studie. Målet var å kunne si noe om prognosen til premaligne tilstander.Bildeanalysemetoder skulle også utprøves. Materialet til den historisk prospektive studien varifølge prosjektbeskrivelsen allerede tilgjengelig, mens materialet til den prospektive studienskulle skaffes ved skrapning av suspekte slimhinneområder.Målsetting II:I tillegg ønsket de å studere manifeste cancere. Håpet var å kartlegge DNA-forandringer som identifiserer cancere med god og dårlig prognose. I prosjektbeskrivelsen heter45
det at materialet var innsamlet. Sudbø har anført at han stiller seg uforstående til at det iprosjektbeskrivelsen er anført at materialet allerede var innsamlet. Han gjør gjeldende at det ikkehersker tvil om at dette materialet ble samlet inn etter at han begynte som rekrutteringsstipendiat.Kommisjonen finner det overveiende sannsynlig at Sudbø ikke på dette tidspunktet, i et prosjektsom han først hadde hørt om bare noen uker i forveien, hadde hatt forutsetninger for å samle innmaterialet på forhånd. Sudbø antar at formuleringen i prosjektbeskrivelsen reflekterer atprosjektet var forberedt av Reith. Kommisjonen legger til grunn, som også er bekreftet av Reith,at denne formuleringen i prosjektbeskrivelsen reflekterer det forhold at Reith gjennom sinekontakter hadde kunnskap om det materialet som var innsamlet ved Gades institutt, (og muligensogså materialet fra Odontologisk fakultet), som kommisjonen kommer nærmere tilbake til.
4.2.3 Organiseringen av doktorgradsprosjektetJon Sudbøs doktorgradsprosjekt ble gjennomført i perioden 1993 til 2001. Doktorgradsprosjektethar en noe uklar, men på denne tiden neppe uvanlig, forankring og organisatorisk struktur, somkommisjonen har funnet grunn til å forsøke å klargjøre og knytte noen bemerkninger til.Organiseringen av doktorgradsprosjektet og formalia rundt dette har bl.a. stor betydning for såvel det daglige som det mer overordnede ansvaret for prosjektets planlegging, gjennomføring ogavslutning (rapportering).Jon Sudbø fikk først stipendmidler fra Kreftforeningen fra 1. januar 1994 til 31. desember1996. I 1996 fikk han i tillegg innvilget ett avslutningsår. I denne perioden var Kreftforeningenformelt sett hans arbeidsgiver. Fra 1. august 1996 til 19. januar 1998 hadde Sudbø permisjon forå avvikle sin turnustjeneste. I tillegg drev han egen privat tannlegepraksis ved Årvolltannlegesenter i kontorfellesskap med noen kolleger.I de første årene hadde ikke Sudbø et formelt ansettelsesforhold ved Radiumhospitalet.Men hans hovedveileder – Albrecht Reith – var imidlertid ansatt som forsker vedpatologiavdelingen, divisjon for digital patologi. I henhold til vanlig praksis ved eksternfinansiering av prosjekter ble det ordnet med kontorplass og praktisk tilrettelegging av arbeidetfor Jon Sudbø ved denne avdelingen. Fra januar til september 2000 mottok Sudbø stipend fraKreftforskningsinstituttet ved Radiumhospitalet, og han ble da formelt midlertidig ansatt vedRadiumhospitalet. Leder av patologiavdelingen var, og er, professor dr.med Jahn Nesland.Professor dr.philos. Håvard Danielsen var seksjonssjef ved divisjon for digital patologi.Sudbø har gitt uttrykk for overraskelse over at han ikke hadde noe formeltansettelsesforhold ved Radiumhospitalet de første årene han arbeidet ved Avdeling for patologi,bl.a. fordi Jahn M. Nesland i egenskap av avdelingsoverlege anbefalte søknaden til
46
Kreftforeningen. Han hevder også at han først i 2005 ble klar over at Reith ikke var professorved Universitetet i Oslo.Uansett er det er på det rene at Jon Sudbø og Reith har hatt daglig tilhold vedRadiumhospitalet, og at forskningen har funnet sted der. Dette forhold har vært kjent ogakseptert ved Radiumhospitalet. Kommisjonen vil også peke på, som fremholdt av Reith, atSudbøs doktorgradsarbeid var en fortsettelse av 3 andre doktorgradsarbeider som Reith haddeveiledet før Sudbøs prosjekt, og hvor disse 4 prosjekter, som alle var støtte av Kreftforeningen,fokuserte på samme forhold – sammenhengen mellom forstadier av kreft og senere utviklet kreft.Kommisjonen finner således at denreelletilknytningen til Radiumhospitalet fremstårsom så sterk, at man i realiteten står overfor et tilknytningsforhold som fullt ut må kunnesammenlignes med et ansettelsesforhold. Kommisjonen legger da også til grunn atRadiumhospitalet har hatt en sedvanlig daglig styrings- og instruksjonsrett over Jon Sudbø i heledoktorgradsperioden, og at forskningen har skjedd i regi av Radiumhospitalet. De fleste samtalermed kommisjonen trekker klart i denne retning. Dessuten er det for eksempel på det rene at såvel Gades institutt i Bergen som Kreftregisteret forholdt seg til Radiumhospitalet som institusjon,og ikke til Jon Sudbø som privatperson. Det siste har da også formodning mot seg.Kommisjonen legger dermed til grunn at Radiumhospitalet har hatt det primære ansvarfor Jon Sudbøs forskning.Først den 26. november 2000 søkte Sudbø om opptak på doktorgradsprogrammet vedUniversitetet i Oslo. Det var da rimelig klart at avhandlingen allerede var så godt som ferdig.Etter at administrasjonen ved Universitetet i Oslo gjorde Sudbø oppmerksom på at han ikke varopptatt på programmet, konfronterte han Reith med dette, som etter Sudbøs forklaring skal haunnskyldt seg med at det var en forglemmelse. Sudbø har presisert at han – tross manglendeopptak på doktorgradsprogrammet – hadde deltatt på ”alle de obligatoriskeforskerutdanningskursene”, og at disse var betalt av Radiumhospitalet. Kommisjonen har ikkefunnet det hensiktsmessig å gå nærmere inn på disse forhold.Sudbø ble tatt opp på programmet ultimo desember samme år, samtidig somavhandlingen ble levert. Sudbøs avhandling ble godkjent 20. februar 2001. Disputasen fant sted9. mars 2001, og han ble kreert i juni 2001. Hovedveileder var Albrecht Reith. Siden Reith ikkevar professor ved Universitetet i Oslo, ble Jahn Nesland, som hadde en professor-II stilling vedUniversitetet i Oslo, oppnevnt som såkalt kontaktveileder. Nesland var den eneste vedavdelingen som hadde slik tilknytning til Universitetet i Oslo, og han hadde derfor en rekke slikeadministrative verv. Kontaktveileder var med andre ord en posisjon han hadde av formelleårsaker, ved at han fungerte som bindeleddet mellom Universitetet i Oslo og Sudbø. Noen reellveiledning var det i liten grad tale om fra Neslands side. Nesland er da heller ikke medforfatter47
på noen av de publikasjoner som doktorgradsprosjektet resulterte i.UiO har altså først og fremsthatt et ansvar for godkjenningen av avhandlingen og disputasen. Kreftforeningen harutelukkende opptrådt som finansieringskilde, og har ikke hatt noe med prosjektets organiseringog gjennomføring å gjøre.Samtaler med kommisjonen trekker klart i retning av at Jon Sudbø hadde en relativt fristilling som stipendiat, noe som ikke er uvanlig. Sudbø blir beskrevet som flink, ambisiøs,erfaren og selvstendig sammenlignet med andre stipendiater. Reith hadde et bredt nettverk somblant annet ble benyttet til å fremskaffe pasientmateriale. Sudbø og Reith hadde et nært forhold,med tilnærmet daglig kontakt, hvor faglige spørsmål synes å ha vært drøftet jevnlig, om enn pået mer overordnet plan. Reith har dermed åpenbart vært mer perifer i forhold til å gå inn idatamaterialet, dataanalyser og lignende. Reiths rolle fremstår dermed mer som en aktivmentorrolle enn en medforskerrolle, se punkt 3.7 ovenfor,Sudbø har imidlertid bestridt at han hadde en slik fri stilling. Han har gjort gjeldende athans arbeidsinnsats ”ble klart styrt av Albrecht Reith”, og mener at det ikke er riktig at Reithsrolle kan beskrives som en mentorrolle. Sudbø mener å underbygge dette ved å vise til at hansarbeidsinnsats, da han tiltrådte stillingen i 1994, ble rettet mot arbeid med grafteorianalyse påkarsinomer, først prostatakarsinomer, og senere munnhulekarsinomer. Sudbø peker på at detteikke i det hele tatt var omfattet av den opprinnelige prosjektbeskrivelsen. Sudbø har gjortgjeldende at han ved å kommentere dette til Reith, fikk beskjed om at han likevel skulle begynnemed dette arbeidet, og at man senere kunne komme tilbake til arbeidet relatert til denopprinnelige prosjektbeskrivelsen. Sudbø er således av den oppfatning at Reith redefinerteSudbøs forskningsprosjekt i retning av metodeutvikling. Bakgrunnen for denne endringen hevdeså være at Reith hadde invitert en fransk forsker til Radiumhospitalet, Raphael Marcelpoil, sompost doc. i 12 måneder, etter at Reith hadde vært opponent ved Marcelpoils disputas i 1993.Sudbø har anført at arbeidet med grafteorianalyse utgjorde den helt dominerende del av hansforskningsinnsats fram til 1999. Kommisjonen forstår Sudbø slik at han mener at han i dettearbeidet var avhengig av samarbeid med andre i en slik grad at dette ikke gir holdepunkter for ålegge til grunn at han hadde en fri og uavhengig stilling som stipendiat, og heller ikke at Reithhadde en tilbaketrukket rolle som veileder. Kommisjonen forstår videre Sudbø slik at arbeidetsom var omfattet av den opprinnelige prosjektbeskrivelsen (orale premaligne lidelser), og somskulle omfatte analyser av materialet fra Gades institutt og Odontologisk fakultet, Universitetet iOslo, ikke ble gitt prioritet i perioden fram til 1999. Reith tilbakeviser imidlertid at han skal hainstruert Sudbø om å prioritere arbeidet med grafteorien, og at dette i all hovedsak var Sudbøsprioritering. Denne forklaringen har klar støtte i et notat skrevet av Sudbø i 2000, hvor detfremgår at ”[f]or undertegnede [Jon Sudbø] sto det helt klart under det meste av min tid som48
stipendiat at disse metodene [grafteorien] før eller senere ville gi resultater, hvilket var grunnentil at jeg fortsatte å arbeide med dem, til tross for at Reith og undertegnede flere gangerdiskuterte mine prioriteringer i så måte”.Til tross for Reiths tette kontakt med Jon Sudbø, og Sudbøs beskrivelser av detteforholdet i ettertid, fremstår imidlertid prosjektet for kommisjonen først og fremst som Sudbøseget prosjekt, hvor han selv har forestått den daglige forskningen. Det virker som om det er hanalene som i realiteten har hatt full kontroll med forskningsprosjektet, herunderforskningsmaterialet som kom fra Gade og Odontologen, se for øvrig brev fra Sudbø tilKreftregisteret datert 20. februar 1996, gjengitt under punkt 4.2.7, og svarbrev av 22. mars 1996.Kommisjonen legger etter dette til grunn at Jon Sudbøde factovar prosjektleder fordoktorgradsprosjektet, en beskrivelse som Sudbø er sterkt uenig i. Kommisjonen legger videre tilgrunn at Albrecht Reith har vært veileder og mentor for prosjektet.Ansvaret fremstår således som delt, hvor den enkelte person/institusjon har et selvstendigansvar. Den enkeltes nærmere ansvar, og hva dette består i, vil variere, og må av den grunnvurderes konkret.Det bemerkes at det at ansvarsforholdene tilsynelatende har vært relativt uklare ogupåaktet i denne saken, først og fremst er et institusjonelt ledelsesansvar.
4.2.4 Forhåndsvurdering av doktorgradsprosjektetTre selvstendige sentrale krav til forhåndsvurdering av forskningsprosjekter er aktuelle i dennesaken.
1. TaushetspliktDet første knytter seg til innsyn i taushetsbelagte personopplysninger(pasientdata/helseopplysninger). Vilkårene for behandling av slike opplysninger er somhovedregel samtykke fra den pasient opplysningene gjelder. Det finnes flere unntak. Et unntaksom er særlig aktuelt, er dispensasjon fra tauhetsplikten i forbindelse med forskning. Dissereglene har vært uforandret minst de siste ti årene. Legeloven av 13. juni 1980 nr. 42 § 36”Anonymisering – forskning” første ledd og annet ledd første punktum, lød den gang:”Taushetsplikt er ikke til hinder for at en lege kan meddele ellers taushetsbelagte opplysninger om legems-eller sykdomsforhold når individualiserende kjennetegn er utelatt eller endret slik at vedkommende ervernet mot å bli kjent. Departementet kan bestemme at opplysninger kan eller skal gis til bruk formedisinsk forskning, og at det kan skje uten hinder av taushetsplikt.”
Se for øvrig legeloven § 31 (hovedregelen om taushetsplikt) og tilsvarende bestemmelser idagjeldende lov om tannleger av 13. juni 1980 nr. 43 §§ 31 og § 36, samt forvaltningsloven §§49
13 og § 13d. Forvaltningsloven er uforandret, mens lege- og tannlegelovens bestemmelser i dager videreført i helsepersonelloven §§ 21 og § 29. Dispensasjon fra taushetsplikten må det søkesom på forhånd. Tillatelse ble tidligere gitt av Statens helsetilsyn, men etter 1. januar 2002 hardenne myndigheten vært delegert fra Helse- og omsorgsdepartementet til Sosial- oghelsedirektoratet.Det er på det rene at Sudbø og Reiths munnhuleprosjekt innebar innsamling ogbehandling av taushetsbelagte og sensitive pasientopplysninger. Kommisjonen har ikke funnetnoen holdepunkter for at det foreligger deltakersamtykke, dispensasjon fra taushetsplikten ellerat andre relevante unntak er oppfylt. Det betyr at denne databehandlingen fremstår som i stridmed dagjeldende regelverk.I denne sammenheng skal det bemerkes at det naturligvis ikke er fritt frem forforskningsinstitusjoner og lignende å gi ut pasientopplysninger til forskere. Dette fordipasientopplysninger er underlagt taushetsplikt. Dette har således ikke bare betydning for de somfikk uhjemlet tilgangtil taushetsbelagte opplysninger, men også de som uhjemletgav utpasientopplysninger.
2. PersonopplysningsvernEt annet krav knytter seg til behandling av personopplysninger og opprettelse av personregistremer generelt. Hovedregelen her er at slik databehandling fordrer melding til eller konsesjon fraDatatilsynet. Melding eller konsesjonssøknad kan også sendes via personvernombudet, omforskningsinstitusjonen har det, i praksis vil det ofte si Norsk samfunnsvitenskapelig datatjeneste(NSD).Det er på det rene at Sudbø og Reith ved å samle inn pasientopplysninger fra forskjelligeinstitusjoner opprettet personregister med til dels meget sensitiv informasjon. Dennedatabehandlingen var sannsynligvis konsesjonspliktig, noe kommisjonen har fått bekreftet fraDatatilsynet og NSD. Det finnes ingen holdepunkter for at Sudbø eller Reith har søktDatatilsynet eller NSD om slik konsesjon.
3. Etisk vurderingEt tredje krav som først og fremst er et forskningsetisk krav, men som i stadig større grad ogsåhar blitt et rettslig krav, er prinsippet om at medisinske eller helsefaglige forskningsprosjekt skalforhåndsvurderes av en regional forskningsetisk komité (REK). Dette har vært ordningen i Norge
50
siden etableringen av etikkomiteene i 1985, men likevel slik at fremleggelsesplikten har blittgradvis innskjerpet.29Det er på det rene at REK-Sør (som ville vært rette instans) aldri fikk seg forelagt Sudbøsdoktorgradsprosjekt, ei heller fra Reith. Ved oppstarten på 1980-tallet var det nok stort sett bareinvasive studier, dvs. studier hvor man utsetter pasienter eller andre forskningsdeltakere for eneller annen form for intervensjon/påvirkning, som var omfattet av en forskningsetiskfremleggelsesplikt. Kommisjonen fant derfor grunn til å reise spørsmål om Sudbøsdoktorgradsprosjektburdeha vært fremlagt for forskningsetisk godkjenning.I den anledning henvendte kommisjonen seg til REK-Sør for å få klarlagt hvilke reglersom eksisterte i 1994 da prosjektet ble påbegynt. REK-Sør uttalte da på generelt grunnlag, uten åha fått tilsendt verken prosjektbeskrivelsen eller andre dokumenter, at:”dersom det er slik at det i denne studien ble ”samlet inn registerdata og kjørt koblinger med pasientdata”og at ” biologiske prøver ble analysert og pasienter ble ringt opp for å supplere med opplysninger omtobakksbruk der man manglet data” da er det ingen tvil om at studien burde ha vært lagt fram for REK(Regional komité for medisinsk forskningsetikk). For et studium med registerdata vil det vært nok medgodkjennelse fra Datatilsynet, men når det gjelder pasientdata, pasientjournal, biologiske data fra pasienter,kontakt med pasienter på telefon for å hente inn opplysninger, og så videre da er det klart at det skulle værtlagt fram for REK.”
Dette forhold må ses i lys av at langt fra alle medisinske forskningsprosjekter av denne typen bleforelagt Regional komité for medisinsk forskningsetikk på denne tiden, hvor det nok også harhersket en berettiget tvil om omfanget av fremleggelsesplikten.Brudd på den typen formalia det her er tale om, var neppe spesielt uvanlig på den tiden.Trolig har det sammenheng med at regelverket var lite kjent. Her har det ventelig skjedd enforbedring ved en økende bevisstgjøring av regelverket blant forskere, forskningsinstitusjoneneog kontrollorganene. Dette har nok en viss sammenheng med diskusjoner rundt formalia oggjeldende regelverk i kjølvannet av Biobankloven som trådte i kraft 1. juli 2003, Nylenna-utvalgets utredning fra desember 2004 (NOU 2005:1), forslaget om lovfestingen av de etiskekomiteer og et nasjonalt uredelighetsutvalg, og de høringer som har vært i forbindelse med disselovforslagene. I 2004 avdekket imidlertid Datatilsynet at bare ett av omtrent 30 medisinske oghelsefaglige forskningsprosjekter hadde rutiner som sikret at personopplysningslovgivningen ble
29
Se bl.a. artikkel av Bergsjø P. Biomedisinske forskningsprosjekter hvor forsøk på mennesker inngår – hva er nå
det?. Tidsskrift for Den norske lægeforening, 1993;113: 1443-1444.
51
fulgt, og 11 av 28 prosjekter fulgte ikke konsesjonskravene. Sletteplikten var sjelden ivaretatt, ogi nær halvparten av prosjektene var samtykkekravene ikke fullt ut oppfylt.30
FremleggelsesansvarDet kan reises spørsmål om hvem som hadde ansvaret for at formalia rundt Jon Sudbøsdoktorgradsprosjekt var i orden.Jon Sudbø har i sin forklaring til kommisjonen gjort gjeldende at han anså det som sinveileders plikt og ansvar å sørge for at formalia var i orden. Det synspunktet kan ha noe for seg,da det er relativt vanlig at hovedveilederen tar ansvar for og/eller påpeker behovet forforhåndsgodkjenning. På den annen side vil det ofte være naturlig å involvere en stipendiat i enslik prosess, særlig hvor det dreier seg om et selvstendig prosjekt hvor stipendiaten fungerer somde facto prosjektleder. Det vil dermed normalt være stipendiaten som har best kjennskap tilprosjektet, gjennom størst nærhet til dette, selv om det er hovedveileder som undertegner selvesøknaden og andre dokumenter relatert til prosjektet.Sudbø peker imidlertid på at det meste av tiden fram til 1999 gikk med tilmetodeutvikling, og var et arbeid som angivelig ikke krevde noen form for godkjenning avoffentlige instanser, og at det var et prosjekt som han hevder ble pålagt ham av Reith, og somikke var omfattet av den opprinnelige søknaden til Kreftforeningen. Sudbø bestrider på dennebakgrunn at han var å anse som prosjektleder. Sudbø erkjenner riktig nok at det parallelt blesamlet inn klinisk materiale, men at dette skjedde i regi av hans veileder, og at det da må værenaturlig å kreve at veileder tar ansvar for å sikre at forskningsprosjektet er i samsvar medregelverket – særlig i en situasjon hvor Sudbø av sin veileder ble pålagt å arbeide med et heltannet prosjekt som han oppfattet som krevende.Overholdelse av det regelverk som forskningsvirksomhet er underlagt, og prinsippene omgod forskningsskikk, skal imidlertid også være en viktig del av forskerutdanningen. Slik sett erdette forhold som Jon Sudbø burde være klar over om var gjort eller ikke. Kommisjonen legger itråd med de synspunkter som det ble redegjort for i punkt 3.7 til grunn at en stipendiat somhovedregel må ha et visst selvstendig ansvar for selv å påse at sentrale forhold somgodkjenninger, konsesjoner og andre formalia (f.eks. deltakersamtykke) er i orden. Dette gjelderspesielt når stipendiaten har en så selvstendig stilling som i dette tilfellet, hvor han trolig er deneneste som har hatt full kontroll med prosjektet i det daglige. Dette ansvaret er et personlig ogselvstendig ansvar, som gjelder uavhengig av veileders og institusjonens selvstendige ansvar.
30
Datatilsynet. Tilsyn våren 2004. Behandling av helseopplysninger i forskning. Funn og tendenser. Oslo:Datatilsynet, 2004.
52
Det skal her bemerkes, uten at kommisjonen har funnet grunn til å forfølge det, at JonSudbø etter å ha avsluttet doktorgradsprosjektet, så langt kommisjonen kan se, ikke har sørgetfor å melde fra til relevante instanser så som Regional komité for medisinsk forskningsetikk,NSD, Datatilsynet og Sosial- og helsedirektoratet i forbindelse med andre forskningsprosjekter,inklusive prosjekter hvor han har vært veileder. Dette med ett unntak; den såkalte PROTOCOL-studien, se punkt 4.3 og 5.3. Til gjengjeld demonstrerer Sudbø i protokollen til den nevntestudien og andre artikler god kjennskap til de formelle krav som stilles til denne typen forskningi Norge, bl.a. hva gjelder deltakersamtykke og forhåndsvurdering av forskningsprosjekter.Et problem, som neppe er enestående i denne saken, synes å være en mer eller mindreubevisst og uheldig sammenblanding av rollen som kliniker (behandlende helsepersonell) ogforsker, hvor man på en urettmessig måte benytter klinikerens adgang til pasienter og pasientdatai forskningsøyemed, uten at formalia er i orden. At klinikere driver forskning er selvsagt positivt,men kombinasjonen av ulike roller krever åpenhet og bevisstgjøring med hensyn til regelverketfor de respektive roller for å unngå en uheldig rolleblanding.Hovedveileder, Albrecht Reith, forklarer at han ikke kjente til disse reglene og kraveneom etisk forhåndsvurdering og innhenting av konsesjon fra Datatilsynet mm. Han har av dengrunn heller ikke sett det som sin oppgave å sørge for forhåndsvurdering. Slik kommisjonen serdet, tilligger det normalt hovedveilederen et selvstendig ansvar å påse at formalia av denne art eri orden før stipendiaten tar fatt på selve forskningen, enten ved at han besørger det selv, ellerinstruerer stipendiaten om å bringe dette i orden. Sudbø har gitt uttrykk for at han har vanskermed å følge kommisjonens betraktninger rundt dette med sammenblanding av rollen somkliniker og forsker.Å påse at forskningsprosjekter forhåndsvurderes, og for øvrig tilfredsstiller andreformelle krav, må videre være et ansvar for forskningsinstitusjonene. Kommisjonen harimidlertid fått inntrykk av at institusjonene, verken Radiumhospitalet eller Universitetet i Oslo,har sett det som sin oppgave å kontrollere at forskningsprosjekter faktisk blir initiert oggjennomført i samsvar med verken lover, forskrifter eller arbeidsinstrukser. Kommisjonen harfått inntrykk av at så vel opplæringen som praktiseringen av dette ikke har vært god nok vedRadiumhospitalet.På den annen side har Radiumhospitalet de siste 10-20 årene hatt stadig bedre instrukserog lignende når det gjelder forskning på pasienter og pasientmateriale, bl.a. med egneintranettsider og et støttekontor for klinisk forsking (www.klinforsk.no). Likefullt fremstår detfor kommisjonen slik at det har skortet på effektive rutiner og internkontroll ved institusjonensom kunne ha bidratt til å sikre at lover og arbeidsinstrukser faktisk var kjent blant de ansatte ogble overholdt. Problemet var med andre ord selve implementeringen og praktiseringen av53
eksterne regler og interne instrukser. Sudbøs doktorgradsprosjekt ble for eksempel aldri lagt fremfor Radiumhospitalets protokollutvalg. I retningslinjene fra 1998 heter det at protokollutvalget”skal vurdere alle typer kliniske forskningsprosjekter som ønskes gjennomført ved DNR og sompå en eller annen måte involverer pasienter eller pasientmateriale. PU kan også på eget initiativta opp saker som ikke er fremlagt for utvalget dersom det kan synes som om disse burde værtfremlagt.” Ingen synes å ha sett det som sitt ansvar å besørge fremleggelse for PU.Videre vises det til at stipendiaten ikke ble avkrevd dokumentasjon på at formalia var iorden da han disputerte i 2001. Det burde være en enkel og lite inngripende sak å kreve fremlagtprotokoll fra Regional komité for medisinsk forskningsetikk, konsesjon fra Datatilsynet,dispensasjon fra taushetsplikt etc., sammen med en erklæring om at forskningsetiske regler ogretningslinjer var fulgt. Kommisjonen har ikke funnet noen henvisninger til slike regler idoktorgradsreglementet eller stipendiatkontrakten.Selv om en forhåndsvurdering ikke nødvendigvis hadde forhindret andre brudd på godforskningsskikk, ville likevel en slik gjennomgang, slik kommisjonen ser det, værtkvalitetssikrende og bevisstgjørende. Manglende forhåndsvurdering øker risikoen for krenkelserav pasientenes integritet, og er en trussel mot befolkningens tillit til forskningen. Det er viderevanskelig for institusjoner å sikre seg helt mot at uredelige forskere omgår systemet og unnlater åetterleve formelle regler og instrukser. Systemet må nødvendigvis være basert på en viss grad avtillit.Til tross for kommisjonens begrensede grunnlagsmateriale er det like fullt klart forkommisjonen at det heftet så åpenbare mangler ved den institusjonelle kulturen og systemet pådenne tiden når det gjaldt institusjonens og ansatte forskeres holdning til formalia, som foreksempel personvern, at det må kunne karakteriseres som en systemsvikt. Kommisjonen har fåttinformasjon om hvilke tiltak som nå eksisterer, og har fått inntrykk av at dette er et”problemområde” som ledelsen ved Rikshospitalet - Radiumhospitalet HF tar på alvor. Det synessom at dette er et pågående innsatsområde med styrking og implementering av flere gode tiltak.
4.2.5 Rapportering og publikasjon av doktorgradsarbeidetDoktorgradsprosjektet kan deles i to.Den første delen ble gjennomført delvis i samarbeid med en post.doc. fra Frankrike.Denne delen består av tre vitenskapelige publikasjoner fra 2000 som kan knyttes tilmetodeutvikling og bildeanalyse av vevsarkitektur basert på et grunnlagsmaterialet som stammerfra Tyskland. Studiene er etter kommisjonens oppfatning av mindre oppsiktsvekkende karaktervitenskapelig sett enn doktorgradsprosjektets hoveddel. Som det er gjort rede for i avsnitt 4.2.3,er imidlertid Sudbø helt uenig i at disse arbeider har en mindre sentral rolle, selv om det har vært54
mindre oppmerksomhet rundt disse studiene enn doktorgradsprosjektets hoveddel. Sudbøunderstreker at disse studiene var det som tidsmessig og arbeidsmessig utgjorde hoveddelen avhans doktorgradsarbeid, og at de er publisert i anerkjente tidsskrifter. Kommisjonen har vurdertartiklene, og har ikke funnet holdepunkter for feil eller mangler ved dem.Doktorgradsprosjektets hoveddel består av tre artikler publisert i New England Journal ofMedicine fra 2001 (NEJM 2001), Journal of Pathology fra 2001 (J Pathol 2001) og Journal ofOral Oncology 2001 (Oncology 2001):Sudbø J, Kildal W, Risberg B, Koppang HS, Danielsen HE, Reith A. DNA content as a prognostic markerin patients with oral leukoplakia. N Engl J Med. 2001 Apr 26;344: 1270-8.)Sudbø J, Bryne M, Johannessen AC, Kildal W, Danielsen HE, Reith A. Comparison of histological gradingand large-scale genomic status (DNA ploidy) as prognostic tools in oral dysplasia. J Pathol. 2001Jul;194:303-10.Sudbø J, Ried T, Bryne M, Kildal W, Danielsen H, Reith A.Abnormal DNA content predicts the occurrence of carcinomas in non-dysplastic oral white patches. OralOncol. 2001 Oct;37:558-65.
Artiklene bygger på det samme pasientmaterialet, og må ses i sammenheng. Pasientmaterialetble trolig hentet inn av Sudbø og Reith i 1995-1996 og koblet mot Kreftregisteret forsupplerende opplysninger i 1996. Datamaterialet og prøvene ble deretter trolig analysert i 1999.Publikasjonene og avhandlingen ble publisert i 2001.Dette pasientmaterialet og de funnene som presenteres i nevnte publikasjoner står heltsentralt i Sudbøs senere vitenskapelige karriere og en rekke senere publikasjoner.De seks artiklene er deretter samlet i selve doktorgradsavhandlingen, som ogsåinneholder en selvstendig sammenstilling og redegjørelse for doktorgradsprosjektet.Dermed er det de tre sistnevnte artiklene, samt selve avhandlingen, og detpasientmaterialet som ligger til grunn for disse, som har vært gjenstand for inngåendeundersøkelser som skal beskrives i det følgende. Det er tatt utgangspunkt i selve avhandlingen.
4.2.6 Pasientmaterialet – en oversiktI figur 5 side 40 i doktorgradsavhandlingen, inntatt som figur 1 i denne rapporten, fremgår det atSudbø har startet med humant biologisk materiale (parafinblokker med biopsiprøver, vevssnittetc.) og personidentifiserbare opplysninger fra 263 pasienter (casus). I hovedtrekk blepasientmaterialet ifølge New England Journal of Medicine 2001 og J Pathol 2001 samtforklaringer for kommisjonen skaffet til veie på følgende måte:55
•••
Pasientmateriale fra Patologisk laboratorium, Det odontologiske fakultet, Universitetet iOslo (heretter: Odontologen).Pasientmateriale fra Avdeling for patologi, (”Gades institutt”), Det odontologiskefakultet, Universitetet i Bergen (heretter: Gade)Pasientdata fra Gade og Odontologen ble deretter sendt samlet til Kreftregisteret forkobling, dvs. en supplering av ytterligere data.
Kommisjonen har på sin side samlet inn omfattende dokumentasjon i form av opprinnelige ogbearbeidede datafiler fra ulike personer og instanser, samt forklaringer for kommisjonen.Kommisjonen har videre foretatt egne koblinger mellom ulike datafiler for å spore pasienter,vevsprøver, kontrollere innbyrdes overensstemmelse med videre. Kreftregisteret har dessutensom ledd i egen internkontroll foretatt tilsvarende undersøkelser. Kommisjonen fikk tilgang tilKreftregisterets meget grundige undersøkelser. På den måten har kommisjonen klarlagt hvordanpasientmaterialet til doktorgradsarbeidet er fremskaffet, og hvordan dette opprinnelig så ut,herunder hvilke pasienter som inngikk i studien og deres sykdomsforløp.Kommisjonens har deretter sammenlignet en rekke tall og fakta som presenteres ipublikasjonene med tall og fakta som kommisjonen besitter.I det følgende vil kommisjonen fortløpende peke på avdekkede feil, mangler oguoverensstemmelser ved de tre nevnte artikler og selve avhandlingen, herunder detgrunnlagsmaterialet disse publikasjonene oppgis å bygge på.
56
Figur 1 er hentet fra Jon Sudbøs doktorgradsavhandling, og viser blant annetinklusjonsprosessen. En nesten tilsvarende figur er inntatt i New England Journal ofMedicine2001.
57
4.2.7 Fremstillingen av grunnlagsmaterialet i publikasjoneneTotalantalletI avhandlingen oppgis det at man opprinnelig hadde tilgang til materiale fra 263 personer samletinn i tidsintervallet 1976-1995. Ifølge artiklene og avhandlingen stammer materialet utelukkendefra arkiver ved Odontologen og Gade.Det vil si at Sudbø opprinnelige hadde tilgang på humant biologisk materiale ogpersonopplysninger fra til sammen 263 forskjellige personer. Antallet prøver og vevsblokker oglignende var imidlertid langt høyere, fordi man normalt har flere prøver og blokker fra sammepasient. I Oncology 2001 vises det til samtlige 263 pasienter fordi den omfatter bådeleukoplakier (hvite flekker i munnhulen) og erythroplakier (røde flekker i munnhulen). I NewEngland Journal of Medicine 2001 er dette utgangspunktet redusert til 242 (263 – 21) fordipasienter med erythroplakier er ekskludert initialt. I J Pathol 2001 er utgangpunktet 196 (263 –(21+46)), selv om dette tallet er 217 i avhandlingen. Ifølge Sudbø var det imidlertid bare for 196personer at det forelå ploidiklassifikasjon, og som av den grunn ble behandlet i J Pathol 2001. Idet videre vil kommisjonen forsøke å kartlegge når og hvor disse pasientene kommer fra, oghvilke egenskaper de har.
TidsintervalletI New England Journal of Medicine 2001 oppgis det at materialet stammer fra perioden 1982 til1995, mens det i de to andre artiklene og i avhandlingen oppgis å stamme fra 1976 til 1995. Detkorrekte tidsintervallet er uklart. Ifølge Kreftregisteret skal det være 1976 til 1995. I brev av 1.februar 1996 fra Sudbø og Reith til Gisle Bang ved Gade oppgis det at materialet fraOdontologen stammer fra 1984-89. I udatert brev, trolig fra primo 1996, fra Bang til Reith ogSudbø vises det til at Gade-materialet stammer fra 1981-95. I brev fra Sudbø til Kreftregisteretdatert 20. februar 1996 vises det til at pasientene ble diagnostisert fra 1984 frem til 1995.Kommisjonen finner det påfallende at det ikke er samsvar mellom de angitte årstall. Det er hellerikke samsvar mellom den oppgitte tidsperioden for innsamling i New England Journal ofMedicine 2001 og de andre artiklene.Sudbø har overfor kommisjonen bestridt at det foreligger uoverensstemmelser eller”åpenbare feil” i de ulike tidsangivelsene, og har anført at det totale materialet er fra 1976-1995,og at det er sannsynlig at noen blokker tatt før 1982 er blitt ekskludert fordi det før 1982 ikke varvanlig med bruk av bufret formalin ved fiksering av vevsblokker, som er mindre egnet tilhydrolyse og Feulgen farging.58
De uklarheter som foreligger i forhold til tidsintervallene er imidlertid etterkommisjonens vurdering unøyaktigheter av en slik art at de er egnet til å svekke troverdighetentil publikasjonene.
Materialet fra OdontologenSudbø forklarer at han via Reith fikk tilgang til pasientmateriale fra Odontologen ved Hanna S.Koppang. Reith har forklart at han, så vidt han erindrer, ba Sudbø om å henvende seg tilprofessor Kjærheim ved Odontologen, som skal ha anbefalt Sudbø om å kontakte Koppang.Reith har ifølge sin forklaring ikke foretatt innhenting av materiale fra Odontologen. Det er noeuklart hvor mange pasienter det er tale om. Sudbø forklarer at materialet ble oversendt i flereomganger, og inneholdt både pasienter med leukoplakier og erythroplakier. Kommisjonen harikke funnet opprinnelige oversendelsesbrev eller datalister fra Odontologen som kandokumentere hvor mange og hvilke pasienter det er tale om.Kommisjonen kan heller ikke se at det foreligger deltakersamtykke eller dispensasjon frataushetsplikt for utlevering av pasientdata, selv om dette var et krav ved utlevering avtaushetsbelagte pasientopplysninger, se punkt 4.2.4. Dermed fremstår utleveringen som i stridmed dagjeldende regelverk. Universitetet i Oslo har ikke fått anledning til å kommentere detteforhold, se punkt 2.4.6 og 7.3.2.Hanna S. Koppang, som var ansvarlig for patologen ved Odontologen, kan heller ikkehuske å ha utlevert materiale til Jon Sudbø i den aktuelle perioden, uten at kommisjonen av dengrunn kan slutte at Sudbø eller Reithikkehar fått utlevert materialet, i det forklaringene fraKoppang er preget av sviktende erindringer fra denne perioden.Sudbø har fremholdt at det er oppsiktsvekkende at professor Koppang angivelig ikkehusker å ha overlevert klinisk materiale til Reith og Sudbø. Han har opplyst at det på Reiths ogPuntervolds kontor skal finnes lister tilsendt fra professor Koppang, som angivelig skal viseantall pasienter, antall lesjoner per pasient, gradering av dysplasi, overgang tilcarcinoma in situsamt tidspunkt for når disse er oversendt. Ifølge Sudbø oversendte Koppang leukoplakier i flereomganger, deretter erythroplakier, om enn i et langt mindre antall, siden disse er langt sjeldnereenn leukoplakier. Sudbø hevder videre at han (”vi”) har oversendt samtlige snitt fra Gade tilKoppang for klassifisering/gradering av dysplasier, og at lister over dette skal foreligge hosReith eller Puntervold. Kommisjonen har forelagt disse opplysningene fra Sudbø for RuthPuntervold og Reith, med spørsmål om de har sett eller hatt tilgang til filer, oversendelsesbrev oglignende som kan belyse hva Sudbø har fått fra Odontologen og Hanna S. Koppang. Puntervoldopplyser at hun fikk blokkene med merking av blokk id., og at dette var grunnlaget for journalenL 34 som ble opprettet for preparering av ploidiprøver fra Odontologen. Utover det har hun59
ingen kjennskap til Sudbøs kontakt med Odontologen. Reith sier at han i dag ikke kan finnelister, oversendelsesbrev eller lignende. Dog skal det bemerkes at kommisjonen fra Koppang harfått tilgang på en liste som viser at noen pasientprøver ble utlevert til Sudbø i 2001. Slik settfremstår det materialet fra Odontologen som angivelig ligger til grunn for doktorgradsarbeidetsom vanskelig etterprøvbart.I et brev fra Sudbø og Reith til professor Bang ved Gade datert 1. februar 1996 vises detimidlertid til at Sudbø og Reith har fra ”… Odontologisk institutt for patologi, UiO, fått utlånt 83biopsier fra 63 individer, tatt i perioden 1984-89. Om lag halvparten av disse er innsendtebiopsier fra tannleger på Østlandet, i Midt-Norge og i Nord-Norge. Den andre halvparten erbiopsier tatt ved Klinikk for oral kirurgi og oral medisin ved det odontologiske fakultet, UiO…”Sudbø har dessuten overfor kommisjonen lagt til grunn at 63 personer synes å stemme.Antallet 63 personer fra Odontologen synes også å stemme med kommisjonens ogKreftregisterets egne undersøkelser. En liste som Kreftregisteret har laget i 2006, etter at de selvhar innhentet og påført fødselsnummer på de pasienter som kun hadde navn og fødselsdato, viser132 observasjoner fordelt på 62 forskjellige personer, dvs. at 70 av observasjonene er dubletter.31Kommisjonen legger dermed til grunn at Sudbø opprinnelig og i utgangspunktet haddetilgang til pasientdata og -materiale fra ca. 63 forskjellige personer fra Odontologen i Oslo.
Kreftregisterets koblingFor å få kontrollert og supplert de innhentede pasientdata, ble disse oversendt Kreftregisteret forsåkalt kobling (samkjøring). I brev av 20. februar 1996 fra stipendiat Jon Sudbø til overlegeFrøydis Langmark ved Kreftregisteret heter det:”Jeg viser til vår telefonsamtale for noen uker siden, hvor vi diskuterte muligheten for gjennomgang avKreftregisterets database som ledd i en retrospektiv prognostisk studie over premaligne forandringer imunnslimhinne. Jeg beklager at våre data kommer senere enn antydet til deg. Vi har i mellomtiden samletinn data over personer med diagnosen dysplasi i munnhulen også fra Haukland sykehus, og innsamling ogsystematisering av disse dataene har tatt noe tid.Som nevnt foregår det ved Avdeling for patologi, Billedanalyseseksjonen, ved Det NorskeRadiumhospital, og jeg arbeider for tiden med et prosjekt som tar sikte på å definere morfologiskekarakteristika ved premaligne tilstander (dysplasier) i munnslimhinne. Studien er finansiert over 3 år av denNorske Kreftforening. Veileder for prosjektet er prof. dr.med. Albrecht Reith, Avdeling for patologi, DetNorske Radiumhospital.Vedlagt følger en utskrift av de aktuelle pasientene. Dette utgjør en samling pasienter fra helelandet, diagnostisert fra 1984 frem til 1995. Personopplysninger er gitt så langt de er kjent. Jeg vedleggerogså en diskett med de aktuelle data. Kunne du overbringe denne til rette vedkommende.”
31
Liste: ”Oslo_030606.xls”
60
Den vedlagte listen over pasienten inneholdt data fra 226 pasienter. Kreftregisteret harremisser og lignende dokumentasjon knyttet til de aktuelle pasientene. Kreftregisteretsetterundersøkelser i 2006 viser at 63 av 226 personer stammer fra Odontologen. Dettepasientantallet stemmer altså med antallet i ovennevnte brev fra Sudbø og Reith datert 1. februar1996. Resten (163 av 226) stammer fra Gades institutt (se nedenfor).Kreftregisteret har imidlertid fremholdt at de personene som det i ettertid har vist segstammet fra Odontologen, ikke hadde personnummer, og at de av den grunn ikke ble koblet.Kreftregisteret er sikre på at de eneste pasienter som ble koblet og returnert til Sudbø, var160personer,som alle stammet fra Gade (3 personer ble ekskludert, av disse var to dubletter og énhadde adenom i magesekken). Sudbø fikk således tilsendt fra Kreftregisteret koblede data på 160pasienter den 22. mars 1996.Sudbø har fastholdt at han var ukjent med at det ikke skjedde en kobling av de 63pasienter fra Odontologen. På den annen side forklarer Sudbø at han med hjelp fra Reith og enlaboratorietekniker ved Radiumhospitalet, Ruth Puntervold, fikk tilgang til pasientenes fullepersonnummer fra Folkeregisteret, og derigjennom fikk kjørt en kobling via Kreftregisteteret.Puntervold benekter at hun har bistått Sudbø i dette. Også Reith stiller seg helt avvisende til athan har hjulpet Sudbø med å skaffe opplysninger fra Folkeregisteret eller bistått ham medkoblinger. Kommisjonen holder det således som lite sannsynlig at pasientene fra Odontologenhadde personnummer og at de ble koblet mot Kreftregisteret. I lys av både Puntervolds ogKreftregisterets opplysninger på dette punkt, finner kommisjonen ikke holdepunkter for å kunnelegge Sudbøs anførsler om de faktiske forhold til grunn.Dødsårsaksregisteret har ikke registrert noen henvendelser fra Reith eller Sudbø. Sudbøhadde på denne tiden ikke en klinisk stilling ved Radiumhospitalet, og hadde dermed heller ikkefri tilgang til sykehusets journaler. Kommisjonen holder det derfor som lite sannsynlig atmangelfulle datasett skulle vært supplert på denne måten.Kommisjonen legger dermed til grunn at Sudbø sannsynligvis hadde tilgang på humantbiologisk materiale og remisse-opplysninger på ufullstendige (ikke-koblet mot Kreftregisteret forå utelukke samtidig og tidligere kreft) pasientdata fra 63 individer fra Odontologen. Det betyr atsamtlige pasienter fra odontologen skulle ha vært ekskludert fra studien initialt, og at detopprinnelige pasientantallet skulle vært 63 personer færre enn det som er oppgitt i avhandlingenog Oncology 2001.Anførslene fra Sudbø om at kommisjonen tar feil på dette punkt, må avvises, i detkommisjonen ikke finner det sannsynlig at det har funnet sted kobling i Kreftregisteret av disse63 personer slik Sudbø hevder har skjedd. Det er også et faktum at den såkalte Sudbø8-filen,som lå til grunn for New England Journal of Medicine 2004 (og dermed i det alt vesentlige også61
New England Journal of Medicine 2001), ikke inneholdt noen personer fra materialet fraOdontologen.En kobling av pasientdata mot Kreftregisteret i forskningsøyemed forutsatte da, som nå, at detforelå deltakersamtykke eller dispensasjon fra taushetsplikten, se punkt 4.2.4 og Kreftregisteretsrammekonsesjon datert 9. desember 1985, jf. konsesjonens punkt 4.3. Dette forelå ikke.Kreftregisteret ble varslet om at kommisjonen vurderte å gi uttrykk for en viss kritikk pådette grunnlag, og har benyttet seg av retten til å kommentere et tidligere utkast til rapport punkt7.3.4. Kreftregisteret har i brev til kommisjonen 20. juni 2006 anført at utkastet til kritikk erbasert på feilaktig oppfatning av Kreftregisterets forskjellige roller. Kreftregisteret hevder at deoppfattet Jon Sudbøs anmodning av 20. februar 1996 som en rutinemessig anmodning omoppfølgningsdata for pasienter ved Radiumhospitalet, Avdeling for patologi. Kreftregisterethevder at utlevering av de etterspurte dataene ikke skjedde som ”dataleverandør ellersamarbeidspartner i et forskningsprosjekt, men som ledd i registerrollen vedrørende sikring avdatakvalitet, datakompletthet og oppfølgning av pasienter”, med fokus på de sentraleproblemstillinger som normalt inngår i slik oppfølgning. Det anføres at den datautveksling somforegår mellom det enkelte sykehus og dets avdelinger og Kreftregisteret i relasjon tilkvalitetssikring, innebærer at Kreftregisteret bidrar til diagnose- og behandlingsavdelingeneskvalitetskontroll av ”deres” pasientmateriale, samtidig som dette som regel fører tilkvalitetshevning av Kreftregisterets hoveddatabase. Kreftregisteret anfører at denne gjensidigekvalitetskontrollen er ”… en helt sentral del av vår registerfunksjon”, og at denne”[v]irksomheten har pågått på rutinemessig basis gjennom alle år, og at den er ansett dekket såvel av tidligere konsesjon som av nåværende forskrift”.Kreftregisteret har videre fremholdt at utkastet til kritikk synes å være basert på atKreftregisteret burde oppfattet at Sudbø søkte om data til etforskningsprosjekt.Dette er i tilfelleet grunnlag for kritikk som Kreftregisteret oppfatter som urimelig. Kreftregisteret viser i denneforbindelse til at Sudbøs henvendelse var ledsaget av en detaljert liste med pasienter, at det ioversendelsesbrevet var angitt at Sudbøs prosjekt foregikk ved Radiumhospitalet, Avdeling forpatologi, og at det også var innhentet data fra Haukeland sykehus. Kreftregisteret anfører at det ilys av samtlige omstendigheter rundt Sudbøs henvendelse i 1996 ikke var grunn til å tro annetenn at pasientlisten gjaldt Radiumhospitalets egne og innkalte biopsipreparater, og atanmodningen var fremsatt som en henvendelse om oppfølgningsdata – en type henvendelse somKreftregisteret mottar og behandler kontinuerlig. Først i 2006, etter at denne saken ble avslørt,ble det kjent for Kreftregisteret at materialet som Sudbø ved henvendelsen i 1996 ønsketkvalitetssikret, ikke gjaldt Radiumhospitalets pasienter, men materiale fra Gades institutt og62
Odontologisk institutts patologiavdeling. Kreftregisteret anfører videre at man, dersom faktumhadde vært korrekt opplyst i 1996, ville Sudbø ikke ha fått utlevert kreftregisterdata.Kreftregisteret viser i denne forbindelse til at Sudbøs henvendelse i 1994 ble avslått nettopp fordihan ønsket oppfølgning på andre institusjoners pasientmateriale, og dessuten ønsket egenhendigtilgang til Kreftregisterets database.Kommisjonen har vurdert Kreftregisterets merknader, og sammenholdt dette med deopplysninger som gis i Jon Sudbøs brev av 20. februar 1996 til Kreftregisteret, sitert ovenfor, ogandre opplysninger. På den bakgrunn legger kommisjonen til grunn at det fremgår av brevet atdet er tale om et forskningsprosjekt, noe Kreftregisteret burde ha forstått. Utleveringen fremstårdermed som i strid med konsesjonsvilkårene, se for øvrig punkt 7.3.4.
Materialet fra GadeI ovennevnte brev av 1. februar 1996 fra Sudbø og Reith til professor Bang ved Gade heter detvidere:”… Vi har videre en avtale med overlege Langmark ved Kreftregisteret om fremskaffing av data overhvilke av disse personene som senere har utviklet en munnhulecancer. Vårt aktuelle materiale på 63individer er imidlertid for lite til å kunne brukes til en slik retrospektiv studie, og vårt spørsmål til deg erderfor om du kunne stille et tilsvarende materiale til vår midlertidige disposisjon. I første omgang er viinteressert i personopplysninger fra individer som har fått stillet diagnosen lett, moderat eller grovplateepiteldysplasi fra munnhule, uansett lokalisasjon. Dersom data fra Kreftregisteret skulle vise atandelen som har utviklet munnhulecancer er tilstrekkelig stor, ville det også være av interesse å få utlåntbiopsiene for fremstilling av snitt til farging og undersøkelse.”
I udatert brev oversendes en dataliste med pasientdata for perioden 1981-95 fra Bang til Reith ogSudbø. Kommisjonen kan ikke se at det foreligger deltakersamtykke eller dispensasjon frataushetsplikt for utlevering av pasientdata, selv om dette var et krav ved utlevering avtaushetsbelagte pasientopplysninger, se punkt 4.2.4. Dermed fremstår utleveringen som i stridmed dagjeldende regelverk, se for øvrig punkt 7.3.3. Universitetet i Bergen har ikke kommentertkommisjonens utkast til kritikk.I brev datert 15. mai 1996 fra Reith til professor Andreas Myking ved Gade (som Banghadde referert Reith til), heter det:”Vi har ved vår avdeling vært i kontakt med professor Gisle Bang ved Haukeland Sykehus. Han haroversendt oss data fra 161 pasienter med diagnosen dysplasi fra munnslimhinne (se den vedlagte listen).Disse dataene har vi sammenholdt med opplysninger fra Kreftregisteret. Det fremgår av disse at ca.halvparten (79/161) av pasientene med diagnosen mild, moderat eller grov dysplasi i munnslimhinne
63
innenfor en femårs periode utviklet plateepitelcarcnom i munnhulen. … Vårt spørsmål til deg er derfor omdet er mulig å få oversendtsnittblokker og kopier av remisserfra pasientene i den listen vi harvedlagt…”
Sudbø og Reith fikk tilsendt remisser fra Gade, noe som blant annet bekreftes i brev datert 9.desember 1996 fra Sudbø til professor Anne Christine Johannesen ved Gade. Gade-materialetstammer fra klinikker spredt over hele Vestlandet.Pasientantallet på 161 personer bekreftes av Kreftregisteret, som i februar 1996 koblet161 personer mot Kreftregisterets data. (To av 163 var dubletter. Ytterligere en person ble ifølgeKreftregisteret dessuten ekskludert pga. adenom i magesekken). Den listen som Sudbø og Reithfikk fra Kreftregisteret inneholdt følgelig koblede data fra 160 eller 161 personer.Kreftregisterets undersøkelse i 2006 viser at samtlige 161 personer som ble koblet, stammet fraGade.I nevnte brev datert 9. desember 1996 fra Sudbø til Johannesen heter det:”Vedlagt er et sett av kopier av remisser jeg har mottatt av prof. Gisle Bang, vedrørende dysplasier framunnhule. Videre finner du vedlagt et Microsoft Excel regneark som angir pasientdata slik de er koblet fraremisser til opplysninger fra Kreftregisteret. Det som spesielt er iøynefallende ved materialet, er den høyeandelen av dysplasier som viser malign transformasjon (50%). Det synes derfor påkrevet å få verifisert denopprinnelige diagnosen (mild, moderat eller grov dysplasi) og utelukke evt. CIS. Du har vært i kontakt medProf. Albrecht Reith ang. dette materialet, og du kjenner vel problemstillingen fra dette. Takk for interessenog viljen til å bistå med dette!”
I svarbrevet fra Johannesen til Jon Sudbø datert 21. mai 1997 heter det:”… Jeg har sett på samtlige snitt fra bunken som jeg fikk tilsendt. Jeg har en rekke kommentarer som jegskal prøve å få frem så tydelig og kortfattet som mulig:•••••Jeg har prøvd å lage en liste der jeg har satt opp navn, P-nummer (biopsinummer) og diagnose. Altdette står med vanlig skrift.Der jeg har innvendinger har jeg brukt kursiv.Der er noen remisser som mangler i forhold til listen tilsendt. Disse står nevnt med navn (kursiv)uten noen ytterligere tekst.Det er mange steder det ikke er samsvar mellom diagnosen på den tilsendte listen og biopsisvar!Her er det selvfølgelig biopsisvar som må gjelde.Forklaringen på at materialet fra Bergen har så høy frekvens av malign transformasjon er at derekanskje ikke har sammenholdt tidspunktet for deres dysplasidiagnose med tidspunktet for denmaligne diagnosen. Det fremgår flere steder at dysplasidiagnosen for eksempel ligger i enreseksjonsrand i et allerede oppstått carcinom. Dette er altså ingen malign transformasjon, men en
64
dysplasi hos en som allerede har en cancerdiagnose. Flere av pasientene er også tidligere operertfor plateepitelcarcinom.•Når det gjelder diagnosene, har jeg ikke forandret mange. Jeg har akseptert et avvik på en grad(lett-moderat, moderat-grov) uten at jeg har korrigert diagnosen, dette fordi denne graderingen ersåpass stor gjenstand for personlig skjønn. Dersom det er åpenbare feil eller større avvik, har jegkorrigert diagnosen.Jeg håper det er tilstrekkelig forståelig. Så vil jeg ønske dere lykke til med det videre arbeidet!”
Det skal bemerkes at Johannesens liste inneholder data fra kun144 ulike personer.Reith synesbrevet fra Johannesen ser ”greit ut”, men han stiller seg undrende til at Kreftregisteret bareekskluderte 2 av 163, mens Johannesen tydeligvis har ekskludert ytterligere 17 personer. Reithforklarer at han ikke kan huske å ha sett/lest brevet før.Kommisjonen har stilt seg samme spørsmål. Den sannsynlige forklaring er at den listenmed 163 observasjoner, som hadde sin opprinnelse fra Gade, og som ble koblet avKreftregisteret primo 1996 inneholdt to dubletter, slik at listen inneholdt 161 personer etterkobling. I en liste nylig utarbeidet av Kreftregisteret finnes en kolonne som heter "Diagnosis onA.C. Johannesen's quality assurance list".32Denne kolonnen inneholder 17 blanke observasjoner(som også er personer). Det betyr sannsynligvis at Johannesen har kvalitetssikret diagnosen på161 - 17 = 144 personer. Dette stemmer med de tall kommisjonens egne undersøkelser harfrembrakt, blant annet via kobling med blokknummer, se nedenfor. Det er også konsistent meddet Johannesen skriver i brev av 21.05.97 hvor det står: ”Der er noen remisser som mangler iforhold til listen tilsendt. Disse står nevnt med navn (kursiv) uten noen ytterligere tekst.”Samlet pasientantall:Dette betyr at Sudbø og Reith sommeren 1997 sto igjen med en re-klassifisert datafil fra Gades institutt, og som var koblet mot Kreftregisteret, med data fra kun144 personer, dvs. 119 personer mindre enn det som oppgis i avhandlingen og Oncology 2001.Kommisjonen finner det påfallende at det i kommunikasjonen med Gade, etter koblingenmot Kreftregisteret, ikke henvises til materialet fra Odontologen. Om de 63 personene fraOdontologen, som Kreftregisteret ikke har kjørt en kobling på, og som av den grunn skulle værtekskludert, likevel legges til, består datamateriale i beste fall av data fra 144 + 63 = 207 ulikepersoner.Det bemerkes at antalletprøver(vevsblokker, snitt, etc.) langt overstiger dette antallet,fordi det foreligger flere prøver fra samme person, noe som er helt vanlig.Sudbø har gitt uttrykk for at han ikke har forutsetninger for å kommentere disse tallene, idet han gjør gjeldende at det var Reith som var ansvarlig for håndtering av datafiler mellomGades Institutt og Kreftregisteret. Brevet fra Johannesen var imidlertid adressert til Sudbø alene,32
Notat fra Kreftregisteret av 7. mars 2006 med vedlegg.
65
selv om Reith overfor kommisjonen ikke utelukker at han har sett selve brevet. Reith erimidlertid bestemt på at han aldri har lest listen fra Johannesen av 21. mai 1997. Han forklarervidere at ”diagnosene inneholder så mange for meg ukjente histo-patologiske begreper at jegville ha diskutert disse med en patolog ved avdelingen, det vet jeg at jeg aldri har gjort.” Reithhar for øvrig vist til et notat skrevet av Sudbø i 2000, hvor Sudbø konsekvent bruker ”jeg”-form ibeskrivelsen av håndteringen av datamaterialet. Kommisjonen kan i lys av dette ikke feste lit tilSudbøs anførsler om Reiths angivelige sentrale rolle i håndteringen av datafiler, se for øvrig brevav 20. februar 1996 fra Sudbø til Kreftregisteret, gjengitt ovenfor, og brev fra Kreftregisteret tilJon Sudbø av 22. mars 1996.Et spørsmål kommisjonen har stilt seg, er om Sudbø og/eller Reith kan ha misforstått ogforvekslet prøveantallet med pasientantall etc. Kommisjonen finner dette lite sannsynlig.Kommisjonen finner her grunn til å peke på Johannesens brev av 21. mai 1997, som etterkommisjonenes vurdering ikke skulle gi rom for misforståelser og mistolkninger. I alle tilfellemåtte brevet foranledige en grundig revurdering fra deres side som kunne avdekket en eventuellmisforståelse.Kommisjonen har videre reist spørsmål ved om materialet fra Gade og eventueltOdontologen senere er supplert, for eksempel ved at materiale fra andre pasienter er samlet innog brakt inn i prosjektet, for eksempel fra Gade, Odontologen, privat praksis eller andre kanaler.Kommisjonen har ikke funnet noen som helst holdepunkter for at det kan være tilfelle.Kreftregisteret har konkludert tilsvarende. Dette bekreftes i og for seg også i avhandlingen ogartiklene. En slik supplering har dessuten formodning mot seg av mer praktiske årsaker.Sudbøs anførsler om at han fremskaffet supplerende opplysninger mht komplettepersonnummer fremstår i lys av Puntervolds, Reiths og Kreftregisterets redegjørelser heller ikkesom sannsynlige, og er for øvrig noe påfallende og motstridende i lys av hans øvrige anførslerom at det var Reith som var ansvarlig for håndteringen av datafiler mellom Gade ogKreftregisteret, og tilretteleggelsen av datamaterialet for øvrig. Kommisjonen fastholder pådenne bakgrunn sin klare oppfatning om at det pasientantallet som er oppgitt, ikke stemmer.Kommisjonen legger etter dette til grunn man trolig ikke hadde tilgang på koblede datafra mer enn 144 personer, i beste fall fra 207 personer.
Eksklusjon av pasienter med erytroplakier (røde flekker i munnhulen)I doktorgradsavhandlingen oppgis det at 21 av 263 pasienter ble ekskludert initialt fraoverlevelsesanalyser fordi de hadde erythroplakier. Erythroplakier er langt mer alvorlig enn hviteflekker, og forekommer dessuten langt sjeldnere. Det må bemerkes at disse personene, altså
66
personer med erythroplakier, trolig ble inkludert i en senere studie med 37 erythroplakipasientersom dannet grunnlaget for en vitenskapelig publikasjon33.Kommisjonen har funnet at tallet 263 ikke kan stemme. Hvorvidt det i detgrunnlagsmaterialet fantes 21 personer med erythroplakier er imidlertid for kommisjonen uvisst.Johannesen ved Gade har imidlertid opplyst at erythroplakier ikke ble registrert ved Gade. Detskulle i så tilfelle bety at pasienter med erythroplakier må stamme fra Odontologen. Sudbø gjørda også selv gjeldende overfor kommisjonen at erythroplakiene utelukkende stammer fraOdontologen. Kommisjonen stiller seg noe tvilende til at 21 av de 61 personene som kom fraOdontologen hadde erythroplakier, men dette kan likevel ikke utelukkes p.g.a den manglendedokumentasjon av disse pasientene. I artikkelen som rapporterte oppfølgningsresultater fra 37erythroplaki pasienter, oppgis det ikke hvor pasientmaterialet (som angivelig ble samlet inn1988-2000) stammer fra.Sudbø har imidlertid i ettertid, i kommentarer til foreløpig utkast til granskningsrapport,fastholdt at erythroplakiene stammer fra Odontologen. Han har opplyst at man der hadde etrelativt stort materiale av erythroplakier, fordi Hanna S. Koppang gjennom mange år haddeinteressert seg for disse lesjonene. Sudbø har opplyst at ”de opprinnelige 21 erythroplakier,opprinnelig ble sendt inn som leukoplakier, men klassifisert som erythroplakier fordi deopprinnelig hadde blitt beskrevet som erythroleukoplakier”. Kommisjonen stiller seg som nevntnoe tvilende til denne redegjørelsen. Dessuten har kommisjonen gjennomgått listen over de 63personene som kommer fra Oslo, uten å finne henvisninger til erythroplaki-diagnoser.Selv om kommisjonen ikke klarer å dokumentere at 21 personer ikke hadde røde flekker imunnhulen som oppgitt i avhandlingen, hefter det likevel så stor tvil og usikkerhet rundt dettematerialet at det gir grunn til bekymring for om det i det hele tatt er riktig. Dette spesielt i lys avandre funn i denne saken, som det skal redegjøres for nedenfor.
Klassifikasjon og re-klassifikasjon av pasienter med hvite flekker i munnhulen – inklusjons- ogeksklusjonsprosessenI figur 1 i New England Journal of Medicine 2001 og figur 5 i avhandlingen (se figur 1 irapporten) oppgis det at 242 pasienter med hvite flekker i munnhulen (leukoplaki), opprinneliginngikk i studien etter at 21 personer med røde flekker i munnhulen (erythroplakier) angiveligvar ekskludert.Kommisjonen viser til redegjørelsen ovenfor hvor det ble slått fast at det ikke ersannsynlig at dette tallet stemmer, dvs at man ikke har hatt tilgang på 242 personer med33
Sudbø J, Kildal W, Johannessen AC, Koppang HS, Sudbo A, Danielsen HE, Risberg B, Reith A. Gross genomicaberrations in precancers: clinical implications of a long-term follow-up study in oral erythroplakias. J Clin Oncol.2002 Jan 15;20:456-62.
67
dysplasidiagnose. Det reelle tallet er 144 eller i beste fall 207. Kommisjonen finner likevel grunntil å drøfte de faktiske forhold som gjøres gjeldende av Sudbø et al. i avhandlingen og artiklene.Det sentrale punkt på dette stadiet i studien var å avgjøre hvilke pasienter som oppfyltekriteriene (inklusjonskriteriene) for å inngå i den planlagte ploiditetsstudien, dvs. en såkaltinklusjonsprosess. Før man går i gang med et forskningsprosjekt er det vanlig å angi inklusjons-og eksklusjonskriterier for forskningsdeltakere, det vil si hvilke pasienter som har de egenskaperman skal studere, og hvilke som har egenskaper som gjør at disse ikke kan inkluderes i studien.Det er viktig at denne inklusjonsprosessen foregår etter etterprøvbare og bestemteforhåndsfastlagte kriterier, slik at man unngår en utilbørlig seleksjon.For å finne ut hvilke av pasientene med dysplasidiagnose som oppfylteinklusjonskriteriene, ble pasientene kontrollert mot tre sentrale kriterier (se figur 1):1. Dysplasiklassifikasjon: En vevsblokk fra hver enkelt pasient måtte klassifiseres for å sehvilkentypedysplasi den enkelte pasient hadde. Pasientene skulle da fordeles etterkriteriene mild, middels og grov dysplasi.2. Forutgående eller samtidig kreftdiagnose: Pasienter som hadde eller hadde hattmunnhulekreft skulle ekskluderes. Dette fordi det var omslag/transformasjon fra hviteflekker til kreft over et visst tidsintervall man skulle studere.3. Mangelfullt datamateriale: Personer som man ikke hadde tilstrekkelig data på, måtteekskluderes.1) Dysplasiklassifikasjon (reklassifikasjonen):Det fremgår av de tre artiklene og senereartikler at klassifikasjonen ble gjort avfire patologersom re-klassifiserte vevsprøver frahverenkelt pasient,i henhold til retningslinjer utarbeidet av Verdens Helseorganisasjon (WHO). INew England Journal of Medicine 2001 side 1270 heter det f.eks.: ”All histologic sections weresubsequently reevaluated by four pathologists according to the guidelines of the World HealthOrganization.” Slik prosedyren er beskrevet, må det forstås at reklassifikasjonen har skjeddblindt (uten å kjenne pasientenes identitet, diagnoser o.l.) og at patologene har arbeidetuavhengig av hverandre. Dette fordi klassifikasjonen bygger på skjønn, og fordi det var etsentralt element i denne studien at klassifikasjonen ble så korrekt som mulig.Det er derfor riktig som det fremgår av artiklene og avhandlingen, at pasienter hvor man varuenige i diagnosegraderingen, måtte ekskluderes. I artiklene og avhandlingen opplyses det at tilsammen 46 pasienter måtte ekskluderes av denne grunn. I Oncology 2001 er tallet 45 (se figur1), men dette forklares i avhandlingen med at en ”outlier” ble ekskludert, uten at kommisjonenkan se at det er nevnt noe om dette i artikkelen. Sudbø forklarer at det ble redigert bort avredaktøren.68
Denne re-klassifikasjonsprosessen er beskrevet i detalj i J Pathol 2001, hvor man ogsådirekte har sammenlignet den enkelte patologs klassifikasjoner.Det er på det rene at de fire patologer det siktes til er••••Gisle Bang, Gades instituttHanna Strøm Koppang, OdontologenAnne Christine Johannesen, Gades instituttBjørn Risberg, Radiumhospitalet.
Dette fremgår eksplisitt av Oncology 2001 hvor disse fire er listet med navn iacknowledgements. Samtlige er utvilsomt kvalifiserte patologer. Det er videre på det rene at deopprinnelige dysplasiklassifikasjonene på ingen måte var så sikre at de kunne brukes iinklusjonsprosessen. Det vil si at opprinnelig hadde samtlige pasienter fått en dysplasidiagnose,men så vel Gade som Odontologen var og er svært klare på at graderingen var mangelfull, ogikke direkte anvendbar for vitenskapelige formål. Det forelå med andre ord et åpenbart behov foren blindet re-klassifikasjon for vitenskapelige formål. Dette behovet ble på et tidlig stadium ogsåunderstreket uttrykkelig overfor Jon Sudbø av avdelingsleder professor Jahn Nesland, som selver patolog. Nesland opplyser overfor kommisjonen at en slik re-klassifikasjon for vitenskapeligeformål vanligvis skjer blindt med to uavhengige patologer, som etterpå har et såkaltkonsensusmøte for å sammenligne resultatene for å komme frem til en omforentdysplasiklassifikasjon. Det er således på det rene at det var tale om en re-klassifikasjon av helematerialet disse fire skulle ha foretatt. Det kan reises spørsmål om hvorfor det angivelig blebenyttet fire patologer i stedet for de sedvanlige to. Et mulig svar er at klassifikasjonen blirsikrere desto flere uavhengige patologer som klassifiserer.Kommisjonen kan imidlertid ikke se at opplysningene om at re-klassifikasjon ble foretattav fire patologer, er korrekt. Riktignok har Gisle Bang vært sentral ved innsamling av detopprinnelige materialet. Det er like fullt klart at Gisle Bang ikke har foretatt en re-klassifikasjonav hele materialet. Han kan i beste fall anses for å ha deltatt i den opprinnelige, men forvitenskapelige formål, klart mangelfulle, klassifikasjonen av deler av materialet fra Gade, menpå langt nær hele materialet.Det samme gjelder Hanna Strøm Koppang. Riktignok har Koppang vært sentral vedinnsamlingen av det opprinnelige materialet, men hun har neppe deltatt i re-klassifiseringen avmaterialet. I beste fall kan hun anses å ha medvirket til den opprinnelige, men for vitenskapeligeformål, klart mangelfulle klassifikasjonen av materialet fra Odontologen, men på langt nær helematerialet.
69
Anne Christine Johannesen har på sett og vis vært med på en re-klassifikasjon avmateriale fra Gade, det vil si 144 av pasientene. Hun har imidlertid ikke klassifisert materialet fra”alle” pasientene. Anne Christine Johannesen stiller seg imidlertid uforstående til at hun hardeltatt i en re-klassifisering også av Gade-materialet. Hun forklarer for kommisjonen at det varpå det rene at hennes oppgave var å kvalitetssikre det materiale de hadde levert til Sudbø ogReith, slik at hennes ansvar var begrenset til det. Hun mener at dette klart fremgår av detovennevnte oversendelsesbrevet datert 21. mai 1997 til Jon Sudbø med kopi til Reith. IJohannesens brev vises det bl.a. til brev fra Reith til Myking av 15. mai 1996, hvor det somnevnt vises til at koblingen mot Kreftregisteret hadde påvist en transformasjonsrate fra dysplasi(hvite flekker i munnhulen) til kreft på hele 50%. Dette oppsiktsvekkende funnet fremheves ogsåav Sudbø i brev til Anne Christine Johannesen av 9. desember 1996. Johannesen peker imidlertidpå at den høye transformasjonsraten på 50% som Sudbø og Reith hadde vist til, bygger på flereåpenbare feil, for eksempel at de som har fått dysplasidiagnose har forutgående eller samtidigkreftdiagnose, slik at ingen transformasjon kan påvises. Det fremgår videre at Johannesen ikkehar foretatt en nøyaktig re-klassifikasjon ut i fra kriteriene mild, moderat og grov dysplasi.Herunder skal det også bemerkes at Kreftregisteret i år har stilt seg meget undrende tilhvorfor at Sudbø og Reith i desember 1996, mange måneder etter Kreftregisterets kobling, berJohannesen revidere/re-klassifisere diagnoser på pasienter som skulle ha vært ekskludert pågrunnlag av den informasjonen de hadde fått fra Kreftregisteret, og på grunnlag av langt flereinformasjoner per pasient enn Johannesen hadde mulighet til å inneha.34Bjørn Risberg oppfattet heller ikke seg selv som en av de fire patologene. Risbergforklarer til kommisjonen at da han leste dette avsnittet i artikkelen, så antok han at dette dreideseg om fire patologer som han ikke kjente til, og at hans oppgave bare hadde vært åkvalitetssikre den re-klassifikasjon som andre hadde utført. Risberg husker ikke hvor mangeprøver han klassifiserte, dvs. at han kan ha klassifisert et sted mellom 150 til 242 prøver.Kommisjonen finner det påfallende at Risberg ikke har vært orientert om at han var en av dissefire patologene. I avhandlingen er det bare Risberg som takkes for å ha foretatt en re-klassifikasjon, mens Koppang takkes for histologisk klassifikasjon.I sine kommentarer til foreløpig utkast til granskningsrapport, skriver Sudbø blant annetat han stiller seg ”helt uforstående til at de opprinnelige dysplasiklassifikasjonene ikke kunnebrukes til vitenskapelig formål. Det er første gang jeg har hørt at dette poenget er brakt opp. Detble imidlertid diskutert hvorvidt man burde ha hatt konsensusmøter og kalibrering av patologerforut for klassifikasjonen. Dette motsatte jeg meg sterkt, fordi kliniker baserer sin behandling pårutinediagnostikk, ikke spesielt konstruerte diagnostiske prosedyrer og forutsetninger. Alle34
Brev fra Kreftregisteret til kommisjonen av 9. mai 2006.
70
involverte i dette prosjektet, inkludert Reith, Bryne og A.C. Johannesen var enige i at dettesynspunktet hadde mye for seg”. Videre gjør Sudbø gjeldende at begrepet ”re-klassifikasjon”konsekvent bare ble brukt til å betegne at ulike patologer, uavhengig av hverandre, haddeklassifisert og gradert dysplasiene.Kommisjonen fester ikke lit til Sudbøs forklaring på dette punkt, all den tid han iartiklene og avhandlingen så klart og entydig viser til en ”re-klassifikasjon” av fire patologer itråd med WHOs retningslinjer. Dessuten er det på det rene at Johannesen ikke var ”involvert iprosessen” gjennom å diskutere opplegg og metodologiske utfordringer, slik Sudbøs forklaringkan gi inntrykk av.Kommisjonen finner at re-klassifikasjonen ikke ble foretatt av fire patologer på denmåten som er beskrevet i en rekke artikler og doktorgradsavhandlingen.I artiklene og avhandlingen påstås det at 46 pasienter ble ekskludert fordi man ikkeoppnådde konsensus på graderingen av dysplasidiagnosen. Det kan vanskelig ha vært noekonsensusmøte eller lignende, når det i beste fall kun er en patolog som har klassifisert helematerialet. Ingen av de fire oppgitte patologer har vært med på noe konsensusmøte ellerlignende. Sudbø forklarer at det ikke fant sted noe konsensusmøte mellom disse patologene, menat det var konsensus i form av ”samsvar i meninger”. Kommisjonen holder også et slikt samsvari meninger som helt usannsynlig, all den tid det samlede materialet neppe ble vurdert av firepatologer.Påstanden om at 46 pasienter ble ekskludert pga. manglende enighet blant fire patologeromkring dysplasigraderingen fremstår dermed som ugrunnet og feilaktig.Kommisjonen har ikke funnet noen som helst holdepunkter for at tallet 46 stemmer. Noealternativt tall har imidlertid kommisjonen ikke grunnlag for å komme med, all den tid materialetikke har blitt re-klassifisert på en ordentlig måte for vitenskapelige formål, og all den tidkommisjonen mener at pasientgrunnlaget var langt mindre enn det som er oppgitt.2) Forutgående eller samtidig kreftdiagnose:I artiklene og avhandlingen oppgis det at 36pasienter ble ekskludert fra studien fordi de hadde samtidig eller forutgående kreftdiagnose.Poenget med studien var jo nettopp å studere hvilke pasienter som, etter at de hadde fått endysplasidiagnose,på et senere tidspunktfikk kreftdiagnose. Personer som hadde samtidig ellerforutgående kreft måtte følgelig ekskluderes. Kommisjonens gjennomgang av tilgjengeligedatafiler viser imidlertid at antallet pasienter med samtidig eller forutgående kreftdiagnose må havært langt høyere enn det som angis i artiklene og avhandlingen. Igjen vises det til Johannesensbrev av 21. mai 1997 til Sudbø og Reith, hvor nettopp dette poenget fremheves, dvs. at langtflere pasienter hadde forutgående eller samtidig kreftdiagnose, og at det var noe Sudbø og Reithåpenbart hadde oversett. Av Johannesens datafil vedlagt det nevnte brevet fremgår det at minst71
47 av 144 personer skulle vært ekskludert av denne grunn. Kreftregisterets egne undersøkelserslår også fast at dette tallet skulle vært langt høyere. Kreftregisteret mener at minst 12 av 63personer fra Odontologen og 76 av 156 personer fra Gade skulle vært ekskludert av denne grunn.Sudbø forklarer at disse opplysningene er nye for ham, og han stiller seg noe undrende tildem. Han reiser spørsmål om alle forutgående eller samtidige kreftdiagnoser refererer seg tilmunnhulekreft eller relatert (tobakksbetinget) kreft . Han påpeker at det har begrenset interesseom en pasient har hatt kolorektalkreft, livmorhalskreft, eller melanom forut for munnhulekreft.Endelig reiser han spørsmål om det har skjedd en oppdatering av Kreftregisterets database medhensyn til registrerte krefttilfeller siden 1995/96.Kommisjonen viser her til brevet fra Johannesen, som viser at man allerede i 1996/97 varklar over alle tilfellene av forutgående eller samtidig kreft. Kommisjonen har dessuten for ordensskyld foretatt en kobling av Kreftregisterets liste fra 1996 med Kreftregisterets data av i år.35Idet store og hele er det overensstemmelse både når det gjelder kreftdatoer og lokalisasjon (typenkreftdiagnose). Det er noen få avvik på remissedato, men ingenting av vesentlig betydning.Dermed er det også klart at det her er tale om forutgående eller samtidig munnhulekreft, og ikkeandre kreftformer. Kommisjonen har herunder kontrollert lokalisasjonskode som står oppført påhver pasient for å se at sistnevnte er tilfelle.Kommisjonen legger etter dette til grunn at antallet personer med forutgående ellersamtidig kreftdiagnose var langt høyere enn det antallet som oppgis i artiklene og avhandlingen.Dette er et meget alvorlig forhold, som klart og isolert sett medfører at forskningsresultateneikke kan anses valide.3) Mangelfullt datamateriale:I figur 1 opplyses det endelig at 10 pasienter ble ekskludertfordi man ikke hadde fyllestgjørende data eller materiale fra disse pasientene. Ut i fra drøftelseneovenfor må det antallet anses som usannsynlig lavt. Det vises her til at materialet fraOdontologen (63 pasienter) ikke ble koblet av Kreftregisteret, og derfor skulle ha vært ekskludertav denne grunn, om ikke før. Videre vises det til at man bare hadde materiale fra 144 pasienterfra Gade.Det er klart at langt flere pasienter skulle ha vært ekskludert fordi man ikke haddetilstrekkelig materiale for å inkludere dem i studien.Herunder finner kommisjonen grunn til å påpeke at Johannesen i brev av 21. mai 1997bemerker at ”det ikke er samsvar mellom opprinnelig diagnose og biopsisvar og at sistnevnte mågjelde”. Det er videre bemerkelsesverdig at Jon Sudbø i en e-post til Johannesen den 11. des.2000 skriver at ”Det dysplastiske materialet er rendyrket, i den forstand at det ikke inkluderer35
Liste: ”Sammenlign_kreft96_og_06.xls”
72
pasienter med samtidig eller forutgående carcinomer, verken i munnhulene eller UADT forøvrig. Det ikke dysplastiske materialet er begrenset, 46 casus.”Kommisjonen kommer etter dette til at det hefter så store feil og mangler ved inklusjons-og re-klassifikasjonsprosessen at påfølgende resultater ikke er troverdige. Kommisjonen menerat feilene i rapporteringen er grove.
Inklusjon av 150 pasienter i ploiditetsstudienI henhold til artiklene og avhandlingen ble til sammen 150 pasienter inkludert i selve studien.Denne ploiditetsstudien, som er selve eksperimentet i doktorgradsprosjektet, kom i stand i 1998-99.Sudbø hadde på dette tidspunkt brukt opp sine fire år som stipendiat, og også et sistetilleggsår. Han sto dermed uten stipendiatlønn. Hans nærmeste overordnede, professor dr.philos,Håvard Danielsen, foreslo da at Sudbø kunne bruke en metode utviklet av Danielsen til åanalysere det materialet som Sudbø satt med. Dette godtok Sudbø, og Danielsen ordnet med 6måneders lønnsmidler fra Radiumhospitalet samt hjelp fra en laboratorietekniker. Sudbø anførerat han selv hadde tatt initiativ til denne bildeanalysen allerede i 1998, men ikke fått tilgang tilutstyret fordi hans munnhuleprosjekt ikke var et prioritert prosjekt ved avdelingen.Selv om det ut fra foregående drøftelser er usannsynlig at man hadde 150 pasienter somoppfylte inklusjonskriteriene, har kommisjonen likevel funnet grunn til å undersøkeploiditetsanalysen nærmere. Dette har betydning for å klargjøre om de åpenbare feilene somhittil er avdekket skyldes slurv og inkompetanse, eller vitenskapelig uredelighet.Kreftregisterets undersøkelse:Kreftregisteret viser i sin undersøkelse til at det avJohannesens ”begrensede re-klassifikasjon” fremgår at man bare satt i igjen med maksimalt 85pasienter som oppfylte inklusjonskriteriene, fordelt på mild dysplasi (58), moderat dysplasi (18)og alvorlig dysplasi (9). (I tillegg var 8 tildelt diagnosen dysplasi, 4 hyperplasi, 4 forutgåendekreft, 43 samtidig kreft – til sammen 144). Tilsvarende viser tabell 1 i New England Journal ofMedicine 2001 en fordeling på mild dysplasi (49), moderat dysplasi (57) og alvorlig dysplasi(44) – til sammen 150. Antallet som er oppgitt i artikkelen samsvarer med andre ord på ingenmåte med Johannesens klassifikasjon. Graderingen som oppgis i New England Journal ofMedicine 2001 stemmer heller ikke med den listen Jon Sudbø ifølge Kreftregisteret fikk fraKreftregisteret i 1996, og som hadde følgende inndeling: dysplasi 4, mild 38, moderat 22 ogalvorlig 99, til sammen 163.Kreftregisteret mener at dette antallet inkluderbare pasienter maksimalt kunne vært 79,særlig pga. av forutgående eller samtidig kreftdiagnose (77 av 156). Det vil si nær halvparten avdet som oppgis i artiklene og avhandlingen.73
Til tross for Kreftregisterets uttvetydige funn, basert på egne undersøkelser ogJohannesens uavhengige klassifikasjon, har likevel kommisjonen funnet grunn til å foreta noenegne undersøkelser. Det har sammenheng med at Kreftregisterets konklusjon om at det herutvilsomt forelå manipulasjon og fabrikasjon av data var så vidt oppsiktsvekkende og alvorlig.Kommisjonens egne undersøkelser av pasientlister og ploiditetsanalysen:Kommisjonenhar fått tilgang til flere lister som tilsynelatende inneholder data fra 150 pasienter som trolig bleinkludert og studert i ploidietsanalysen som fant sted i 1999. Det er på rene at listene inneholder150 observasjoner, dvs. registreringer. Videre er det sannsynlig at noen (se nærmere om dettenedenfor) har analysert minst 150 blokker/prøver/preparater/monolayers. På bakgrunn av deovennevnte undersøkelser og funn, reiste kommisjonen to helt sentrale og konkrete spørsmål:1. Ble ploiditetsanalysen utført på 150 forskjellige personer, eller kan det være slik at flereanalyser stammer fra samme person?2. Oppfyller de personene som er inkludert og studert virkelig inklusjonskriteriene?Ved hjelp av tilgjengelig datalister og koblinger dem imellom, og koblinger med bl.a.data fra Kreftregisteret, har det vært mulig å tilveiebringe nøyaktig dokumentasjon på hvilkepasienter som faktisk ble inkludert, herunder disse pasientenes sykdomsforløp (dvs. om deoppfylte inklusjonskriteriene).Listene og pasientene ligger til grunn for de tre nevnte artiklene, avhandlingen og fleresenere publikasjoner, bl.a. New England Journal of Medicine 2004, og har derfor stått heltsentralt for kommisjonen, se vedlegg 3.Kommisjonen vil her gå nærmere inn på disse listene. Det er særlig tre lister som er avinteresse:•L-29.Denne listen antas å være den opprinnelige listen som ble brukt i studien,og som kommisjonen har fått fra Danielsen. Danielsen har som seksjonssjefhentet den ut fra arkivet i 2006 på forespørsel fra kommisjonen. Det står på listenat den er produsert i april 1998. Listen antas å ligge til grunn fordoktorgradsprosjektet, herunder New England Journal of Medicine 2001.•Rawdata.Denne listen har kommisjonen fått fra Reith. Reith har opplyst at hanikke har sett denne listen før 2006, da han ba Ruth Puntervold om denne iforbindelse med denne saken. Puntervold skal ha fått listen fra Sudbø i 2005 iforbindelse med Bjørn Risbergs ønske om å måle preparatene på nytt, se 5.3. Denharmonerer med, og bygger trolig på, L-29. Rawdata-listen ligger ifølge Reith tilgrunn for New England Journal of Medicine 2004, som igjen i det alt vesentligebygger på New England Journal of Medicine 2001.
74
•
Sudbø8.Denne listen har kommisjonen fått fra J.Jack Lee ved MD Anderson,som igjen har fått den fra Sudbø. Lee er biostatistikeren som kjørte analysen somligger til grunn for New England Journal of Medicine 2004. Ifølge Lee liggerdenne listen til grunn for New England Journal of Medicine 2004.
Disse tre listene harmonerer med hverandre, dvs. at det er overveiende sannsynlig at de utgår frasamme pasientmateriale. De enkelte listene inneholder imidlertid flere eller andre registreringer.Kommisjonen har ikke funnet holdepunkter for at detikkeer disse listene som ligger til grunn foranalysene som igjen ligger til grunn for publikasjonene i bl.a. New England Journal of Medicine2001 og 2004. Sudbø eller andre har heller ikke fremlagt andre pasientlister som avvikervesentlig fra disse listene.Rawdata-listen inneholder preparat-/blokk-/prøvenummer som gjør det mulig å innhenteinformasjon fra Kreftregisteret. Denne listen er, bortsett fra blokknummer, identisk med Sudbø8.Tabellen i vedlegg 4 viser de 150 observasjoner (records) som kommisjonen har antatt låtil grunn for artikkelen i New England Journal of Medicine 2004. Første kolonne er enfortløpende nummerering av observasjoner slik slik de lå på Rawdata og Sudbø8. Annen kolonneteller unike personer. Hver observasjon på Sudbø8 inneholdt en eller flere preparanummer(blokknummer). Disse preparatnumrene var knyttet til samme person bortsett fra to nummer iobservasjon 51 som viste seg å tilhøre to forskjellige personer. Derfor står denne observasjonento ganger. Tredje kolonne er selve preparatnummeret. Dette er blanket ut av personvernhensyn.Det var 8 observasjoner på Rawdata filen hvor det ikke var preparatnummer. For disse åtte stårdet ”missing” i kolonnen. Så følger en kolonne som viser året da preparatet (prøven/biopsien) ertatt. De tre neste kolonnene er fra den filen som Kreftregisteret leverte til Sudbø i 1996. Deretterfølger to kolonner fra Sudbø8. Kolonnen ”år leukoplaki” skulle være tilsvarende kolonnen ”årprep”. Til slutt er det en kolonne som viser hvorvidt det er laget preparat for ploidiklassifikasjon.Kommisjonen har hatt tilgang til datoer for leukoplaki-diagnose og datoer for kreft.Disse stemmer helt overens på Rawdata og Sudbø8. Videre nevnes at opplysninger om alder ogtobakk er helt overensstemmende på de to filer. Dette dokumenter at disse to filer må stamme frasamme pasientgrunnlag.Videre dokumenterer denne koblingen hvilke personer som ikke oppfylteinklusjonskriteriene, siden dato for munnhulekreft ligger før prøven (blokk-/prepnr) ble tatt.Koblingen viser at 69 av 150 observasjoner skulle vært ekskludert av denne grunn. Koblingenviser videre at det kun er 64 ulike personer på listen som vi kunne dokumentere ikke var i stridmed det inklusjonskriteriet. Det bemerkes at årstallet er fjernet fra blokknummer på rawdata-
75
listen. Årstallet kunne bidratt til at noen hadde oppdaget den sistnevnte feilen. Årstallet stårderimot på L29, uten at noen likevel har oppdaget uoverensstemmelser med inklusjonskriteriet.Koblingen viser at ingen datoer på Sudbø8 overensstemmer med data fra Kreftregisteret.Det betyr at datoene på Sudbø8 er fiktive. Kommisjonens kobling av Kreftregisterets liste fra1996 og Kreftregisterets liste fra 2006 er i det alt vesentlige sammenfallende, slik at en feil hosKreftregisteret er utelukket. Kreftregisteret har da også foretatt en inngående egen undersøkelseav bl.a. alle aktuelle remisser osv.I alt er det referanse til ploidipreparat for 69 av 150 observasjoner (65 forskjelligepersoner) på rawdata-listen. Observasjon nr 51 på rawdata (patnid_re =51) står to ganger dadenne observasjonen på rawdata hadde to prepnr som viste seg å være to personer.Kommisjonens koblinger viser følgende:••••Rawdata-listen og Sudbø8 inneholder 150 observasjoner som utgjør maksimum 140personerAv de 150 observasjonene er det maksimalt 81 observasjoner som oppfyllerinklusjonskriterietAv de 150 observasjonene er det bare 69 observasjoner hvor det er referanse tilploidipreparat,Av de 150 observasjonene er det 23 observasjoner hvor dødsår er før årstallet forleukoplakia (årstallet i dateopl). Det vil si at pasienten var død før diagnosen angiveligble stilt.•Ingen observasjoner med blokknummer stammer fra Odontologen i Oslo.
Listen ”Alle originale blokker og HE snitt korrelert til ploidprep og L29 serien” viser dessuten ensammenheng mellom blokknummer og listenummer (L31 osv) for de observasjoner hvor det erploidipreparat (trolig ploidiklassifikasjon). I alt er det 167 observasjoner. Kommisjonen har enliste med en variabel/kolonne, ”sted”, som viser om blokken er fra Gade eller Odontologen.36Dette er definert ut fra blokknummer eller listenummer. For lista L47 er det verifisert medblokknummer. Kommisjonens liste er viser følgende:Observasjoner Unike blokknrMissingGadeOdontologenTotalt36
49766167
48042126
Liste: “Alle_ploidi_060606.xls”
76
Det er følgelig 167 ploidprep, hvorav kun 126 er unike blokknr. Det vil si at det er unike ogdermed gyldige ploidiprep for maksimalt 126 personer. Dette kan sammenholdes med at manifølge Sudbø selv behandlet statistisk 196 personer hvor det forelå ploidiklassifikasjon i J Pathol2001. Den påstanden stemmer med andre ord neppe med de faktiske forhold.Det er verdt å merke seg at bare 69 av 167 ploidinummer kan lenkes til L-29/rawdata/Sudbø8. Det betyr at det bare er gjort ploidianalyse på 69 (og ikke 150) av deblokknumrene som finnes på rawdata-listen, som altså ligger til grunn for New England Journalof Medicine 2004.Av denne grunn har det ikke vært noe poeng for kommisjonen å foreta en nyploiditetsanalyse av grunnlagsmaterialet, i og med at grunnlagsmaterialet er så åpenbart feilaktig.Dette har Sudbø reagert på, og har blant annet vist til at en av dem som klassifisertehusker å ha mottatt rundt 150 blokker. Danielsen mener også å ha sett et brett med ca. 150blokker. Til det vil kommisjonen si at man trolig har klassifisert ca 150 blokker, slik at de somhar klassifisert, bl.a. Wanja Kildal, nok har trodd at det dreide seg om det antall personer som detopereres med i artiklene. Men faktum er at det dreide seg om mange dubletter, og mangepersoner som skulle vært ekskludert bl.a. pga. forutgående og samtidig kreftdiagnose.Kommisjonen har beregnet en aldersfordeling av filen Sudbø8 (som lå til grunn for NewEngland Journal of Medicine 2004) og sammenholdt denne med aldersfordelingen fororiginaldata fra Gade og Odontologen. For Gade er det gjort to oppstillinger: 1) Basert på enliste produsert av AC Johannesen, og som via blokknummer er koblet til Kreftregisteret, og 2)Basert på den filen som Kreftregisteret leverte til Sudbø i 1996. Tabell 2 viser resultatet for trealdersgrupper. Alder for Gade og Odontologen er alder da biopsien ble tatt. Alder på Sudbø8 erikke nærmere definert på selve filen, men i en e-post til J.Jack Lee ved MD Anderson (somgjorde analysene) skriver Sudbø at det er alder ved ”time at initial diagnosis”. Vi kan altså gå utfra at det er samme aldersdefinisjon på filene da alder for diagnose settes til alder da biopsien ertatt. Det er for øvrig vanskelig å se hvilken annen alder det kan være på Sudbø8. Tabellen viserat det er langt flere personer i aldersgruppen 65-78 på Sudbø8 enn på de andre filene, også når deslås sammen. Det er altså en distinkt uoverensstemmelse mellom filen som ligger til grunn forNew England Journal of Medicine 2004 og de filer som har dannet grunnlaget for denne.
77
Tabell 2: Aldersfordeling på datafil for New England Journal of Medicine 2004 (Sudbø8) sammenholdt medaldersfordeling på datafil som ble levert fra Kreftregisteret i 1996 (Oslo-odontologen [62 personer] og Gade[163 personer]) og lister fra Gade [142 personer].
Grunnlag
Kreg06
Kreg96
(Kreg06/Gadeliste98)
JJL06
OsloAlder*30-6465-7879-95SumManglerTotal4013457562
Gade1
Gade2
Oslo+Gade1
Oslo+Gade2
Sudbø8
795925163
6853191402
10866231977204
11972292206226
3211261500150
163
142
Gj.snitt alder
56.8
63.5
63.3
61.4
61.8
68.9
New England Journal ofMedicine 2001New England Journal ofMedicine 2004
68.9
68.9
*Alder for Oslo og Gade: Remisseår minus fødselsår; Alder for Sudbø8: alder på fil
78
Kommisjonen har også fått tilgang til den første filen som ble oversendt til USA for NewEngland Journal of Medicine 2004 og sammenholdt denne med den siste filen. Tabell 3 girresultatene for noen observasjoner.Tabell 3. De 28 siste records fra første og siste fil som lå til grunn for artikkelen i NEJM 2004.Begge filene inneholder 150 records (linjer) fortløpende nummerert ved patnid fra 1 til 150.Updated rawdata (første fil)123124125126127128129130131132133134135136137138139140141142143144145146146148149150807474657655667275766573665169697867786378646374677465813332332343134331332332343212199319931993199419911985198219941989198519901997198719951989199119941997198919951991199419931993199619851990199419952000198619931998198819971990199219961998198919971995200219952002199819891992200020002001199420001993198912312412512612712812913013113213313413513613713813914014114214314414514614714814915080747465765566727576657366516969786778637864637467746581Sudbø8 (siste fil)33323323431343313323323432121993199319901994198919851982199119891983198719941984199019861983199119941986199319881994198819931994198319871994199220001984198819951985199419871988199319951988199419902002199119951997198519881994200020011991200019901986patntid alder tobakk år leukoplaki år kreft patnid alder tobakk år leukoplaki år kreft
Påfallende mange datoer er endret fra første til siste fil. Enda mer påfallende er at årstallet forleukoplaki-diagnosen er endret, mens alder ved leukoplaki-diagnosen er uendret.Kommisjonen er etter dette kommet til at listene som kommisjonen har hatt tilgang til, ogsom ligger til grunn for doktorgradsprosjektet, ikke stemmer. Verken datoer, pasientantall ellerandre etterprøvbare observasjoner stemmer i noe rimelig grad med de publiserte data ogresultater. Kommisjonen har forsøkt forskjellige innfallsvinkler og foretatt en rekke andrekoblinger av lister, prøvenummer og pasientidentiteter mv, men konklusjonen har alltid vært den79
samme. Verken datoer for leukoplaki-diagnosen eller dato for kreft stemmer med de tilsvarendedatoer i Kreftregisteret, og det er vanskelig å finne annen forklaring enn at datoer og lister i storgrad er fabrikkert. Dette funnet harmonerer med Kreftregisterets uavhengige interngranskning.Dette funnet harmonerer videre med kommisjonens påpekninger av svikt i pasientgrunnlaget.
PloiditetsanalysenEtter å ha avgjort hvilke pasienter som skulle inkluderes i studien (angivelig 150) og hvilke sommåtte ekskluderes (angivelig 113) gjennom dysplasiklassifiksjonen, var det neste trinnet ågjennomføre selve eksperimentet. Dette besto i å klassifisere prøvene/blokker/monolayers frapasienter inkludert i studien, for å se hvilken dysplasigrad (mild/moderat/alvorlig) og hvilkentype lesjon pasienten hadde ved hjelp av en genetisk analyse – en såkalt ploiditetsananalyse;gradert etter diploid/tetraploid/aneuploid. Poenget var å finne fram til om en relativt enkel DNA-analyse av de hvite flekkene, kunne forutsi sannsynligheten for senere kreftutvikling.På denne tiden gjorde man på Radiumhospitalet en ploiditetsklassifikasjon, dvs. enmåling av mengden av DNA (arvestoff) skulle gjøres med en bildeanalytisk maskin.Analysemaskinen lager så et DNA-histogram som tegner en personlig klassifikasjon.Klassifikasjonen er subjektiv, selv om hensikten med maskinanalysen er å gjøre den mest muligsikker og dermed objektiv.I New England Journal of Medicine 2001 oppgis det på side 1272 at ”all specimens werecoded, and DNA histograms were classified in a blinded manner by four observeres.” I J Pathol2001 er det tre. Dette til tross for at rutinen ved sykehuset var at klassifiseringen skulle skjeblindt av bare to uavhengige personer.For kommisjonen har det vært noe uklart hvem disse fire uavhengige personene har vært.Jon Sudbø forklarer at dette har vært Wanja Kildal, Håvard Danielsen, Jon Sudbø selv, og delvisAlbrecht Reith. Bjørn Risberg var ikke med på denne klassifikasjonen, selv om han åpenbart varkvalifisert til det. Risberg har selv stilt seg noe undrende til at han ikke ble inkludert i denneklassifikasjonen. Reith forklarer at han har oppfattet det slik at Wanja Kildal og HåvardDanielsen foretok klassifikasjonen. Reith opplyser videre at han selv noe senere foretok enanalyse av histogrammene for å se om han ”lå på linje med WK og HEDs analyser”, men hanoppfatter tydeligvis ikke seg selv som en av fire observatører, i det han viser til at det iavhandlingen ikke står noe om ”fire” observatører.Det må antas at Wanja Kildal, som var opplært av Håvard Danielsen, var kvalifisert til åklassifisere prøvene, på samme måte som Håvard Danielsen. Wanja Kildal forklarer at hunklassifiserte samtlige prøver som hun fikk fra Jon Sudbø. Etter at Wanja Kildal hadde klassifisertprøvene, viste hun Håvard Danielsen de første 30 klassifikasjonene, slik at han kunne kontrollere80
om hun hadde gjort det riktig. Det gjorde Danielsen. Sudbø mener bestemt at Danielsen ogsåklassifiserte resten av prøvene. Han hevder også at et konsensusmøte fant sted mellomDanielsen, Kildal og ham selv. Danielsen er på sin side sikker på at han ikke klassifiserte deøvrige 120 prøver, og at noe konsensusmøte aldri fant sted. Basert på Reiths egen forklaringlegger kommisjonen til grunn at Reith neppe kan anses som en av de angivelig fireobservatørene. Hvorvidt og i hvilken grad Jon Sudbø har klassifisert materialet, fremstår forkommisjonen som uklart. Dersom Sudbø har klassifisert, er det tvilsomt om klassifikasjonen varblindet, i og med at både Jon Sudbø og Albrecht Reith trolig hadde tilgang til og kjente tilpasientenes identitet og diagnose. Sudbø bestrider prinsipalt dette med manglende blinding.Subsidiært hevder han imidlertid at siden både ham selv og Reith ”hadde hatt tilgang til og godkjennskap til innholdet i bakgrunnsfilen fra Kreftregisteret … må den manglende blinding i såfall gjøres gjeldende for ham [Reith] også.” Reith bestrider imidlertid at han hadde slik tilgang tildatamaterialet, og har gjort rede for dette på en måte som kommisjonen finner troverdig. På dettepunktet vil Kommisjonen bemerke at i de fleste observasjonsstudier kan og blir en ”blindet”klassifikasjon utført selv om de som utfører klassifikasjonen kunne ha fusket ved å åpneblindingen. Under normale omstendigheter har man tilstrekkelig tillit til de forskere somgjennomfører studien.Kommisjonen finner etter dette at ploiditetsanalysen neppe har skjedd slik som beskreveti New England Journal of Medicine 2001. På den annen side er ikke dette et punkt av avgjørendebetydning for resultatenes gyldighet, all den tid kommisjonen er overbevist om at de prøvenesom ble analysert besto av flere dubletter, samt at flere blokker stammet fra pasienter som skullevært ekskludert fra studien. Selve ploiditetsanalysen fremstår dermed for kommisjonen somskinngyldig, siden resultatene ikke er koplet mot det korrekte antall inkluderbare pasienter.
ForskningsresultatetResultatene av ploiditetsanalysen sammenholdt med kreftutvikling, altså selveforskningsresultatet, var oppsiktsvekkende. Spørsmålet var i hvilken grad ploiditeten i celler frahvite flekker kunne benyttes som et tegn (en prediktiv indikator) på fremtidig kreft i munnhulen,som er en meget alvorlig kreftform.Sudbø et al kunne fremvise at pasienter med aneuploide lesjoner hadde en særdeles dårligprognose, ved at ca 90% utviklet kreft i munnhulen i løpet av 5 års oppfølgning. Samtidig haddepasienter med diploide lesjoner en meget god prognose, ved at bare ca 5% fikk senere kreft. Forpasienter med tetraploide lesjoner var sannsynligheten for omslag til kreft litt over 50%. Dermedhadde Sudbø bekreftet sin hypotese og funnet fram til en meget god metode for å forutsi kreft imunnhulen for personer med hvite flekker.81
På bakgrunn av ovenstående kan ikke dette oppsiktsvekkende forskningsresultatet lengerha troverdighet.
4.2.8 Andre feil og manglerI det følgende vil kommisjonen summarisk peke på enkelte andre feil og mangler som samlet ogalene gjør at troverdigheten til de tre nevnte artiklene og doktorgradsavhandlingen svekkesbetydelig.
Mangelfull blindingEn svakhet i denne studien er at den forskeren som sto for studien (dvs. Jon Sudbø), har hatt fulltilgang til alle pasientdata. Det er en svakhet fordi dette ifølge artiklene og avhandlingen skullevære en blindet historisk prospektiv studie, dvs. en studie hvor man ved å gå tilbake i tid kanfølge pasienters utvikling fremover. Blindet betyr at de som gjorde ploiditetsanalyser ogdysplasiklassifikasjon ikke skulle kjenne til om pasienten fikk senere kreft eller ikke. I dettetilfelle om pasienter som først hadde fått diagnosen hvite flekker i munnhulen (dysplasi) på etsenere tidspunkt utviklet kreft. En slik overgang (transformasjon) og hyppigheten av den, villekunne si noe om i hvor stor grad ploiditeten i celler fra hvite flekker kunne benyttes som et tegn(en prediktiv indikator) på fremtidig kreft i munnhulen. Men i og med at studien var historiskprospektiv så satt man faktisk på fasiten, ved at man visste hvor mange av pasientene somutviklet kreft. Derfor burde ikke den som foresto selve forskningen, Jon Sudbø, hatt tilgang påpasientinformasjonen før klassifikasjonen av dysplasi og ploiditet var fullført, noe både han ogReith ifølge Sudbø selv hadde.Som nevnt tidligere, vil kommisjonen på dette punktet anføre at i de flesteobservasjonsstudier kan og blir en ”blindet” klassifikasjon utført, selv om de som utførerklassifikasjonen kunne ha fusket ved å åpne blindingen. Under normale omstendigheter har mantilstrekkelig tillit til de forskere som gjennomfører studien til at kravene for blinding ikke er likestrenge som i for eksempel randomiserte studier.Kommisjonen vil imidlertid påpeke at en manglende blinding for Sudbøs vedkommende,kan bidra til å forklare hvordan han har klart å manipulere for eksempel ploiditetsanalysen til åfremvise positive forskningsresultater, for eksempel ved å inkludere pasienter som har hatt kreft imunnhulen (og som av den grunn skulle vært ekskludert). Her skal det bemerkes at en annenalternativ forklaring er at analyseresultatene er manipulert i ettertid.
Misvisende rapporteringI New England Journal of Medicine 2001 side 1271 heter det:82
”all 150 patients had been … enrolled in a follow up-program, which, through an updated national register,had hospital-based access to the place of residency of Norwegian citizens. No upper limit was set for theduration of follow-up. Patients who were given a diagnosis of dysplasia were scheduled to have an annualexamination, which included inspection of the oropharyngeal mucosa and palpation of cervical lymphnodes. Biopsies were performed at these follow-up visits if previously unrecognized white patches weredetected, white patches recurred after excision, or previously recognized patches had increased in size. Nopatients were lost during follow-up, although data on seven patients who died of unrelated causes werecensored at the time of death.”
Det fantes ikke et fast oppfølgningsprogram for personer med dysplasidiagnose og som ikkehadde kreft på denne tiden. Riktignok ble trolig enkelte av pasientene innkalt til etterkontroll,men dette skjedde ikke systematisk, og det var heller ikke nødvendigvis tale om en årligoppfølgning innenfor rammen av et ”program” slik det klart gis inntrykk av i artikkelen. Det erogså på rene at en slik oppfølgning ikke omfattet alle pasientene. Sudbø hevder imidlertid atprogrammet ikke var et ledd i hans vitenskapelige prosjekt, men at det på den tiden var rutineved både Haukeland og Klinikk for oral kirurgi og oral medisin å sette opp enoppfølgningsavtale om ett år dersom man hadde fått utført en biopsi. Siden denne rutinen varinstitusjonalisert, mener Sudbø det er berettighet å kalle det et ”program”.Kommisjonen stiller seg imidlertid tvilende til denne argumentasjonen. Kommisjonenstiller seg videre meget tvilende til at ingen pasienter falt ut av oppfølgingsprogrammet.Kreftregisteteret stiller seg også uforstående til det som er beskrevet i artikkelen, og girklart uttrykk for at dette ikke kan stemme, siden det ikke er slik ting fungerer i virkeligheten. Påden annen side er det tydeligvis ingen andre, for eksempel medforfattere, som har reagerte pådenne beskrivelsen.Kommisjonen har på den bakgrunn kommet til at måten dette er beskrevet på i artikkeleni beste fall er misvisende.
Feil om røyke- og alkoholvanerI tabell 1 og i teksten i New England Journal of Medicine 2001 vises det til røyke- ogalkoholvaner samt oppfølgningsprogram for dysplasipasienter. I New England Journal ofMedicine 2001 heter det på side 1272:“Patients with confirmed use of tobacco or alcohol were given standard oral and written information on riskfactors for oral cancer, and this information was repeated at each follow-up visit. Data on tobacco use werereconstructed from the medical records or by the use of telephone interviews, in which the patients were
83
asked about their use of tobacco at the time of the initial diagnosis of oral leukoplakia (no history oftobacco use, former use of tobacco, or use of tobacco at the time of the initial diagnosis.”
Kommisjonen har drøftet disse opplysninger med fagpersoner som har kjennskap til dette. Herbemerkes det at Kreftregisteret har hatt tilgang tilog har gjennomgåttsamtlige remisser.Materialet fra Gade stammer fra sykehus over hele Vestlandet, fra Møre og Romsdal inord, til Rogaland i sør. Det foreligger ingen opplysninger om at de klinikerne som har sendtbiopsier til Gades institutt deltok i noen form for vitenskapelig undersøkelse som omhandlerrøyke- og alkoholvaner eller lignende. Detaljerte opplysninger om røykevaner er derfor sjeldennedtegnet på remissene til patologene, noe Kreftregisterets gjennomgang bekrefter.I likhet med disse fagpersoner, mener kommisjonen at opplysningene om at alle pasientersom røykte eller brukte alkohol fikk råd, enten muntlig eller skriftlig, om de farene de utsatte segfor, er feilaktige. Det kan hende at klinikere – i større eller mindre grad – opplyste om slikeforhold til sine pasienter. Sudbø eller andre involverte i forskningsprosjektet har klart nok ikkedrevet med den typen rådgivning, og de kan umulig ha hatt tilgang til disse opplysningene, oghadde heller aldri personlig kontakt med pasientene.I New England Journal of Medicine 2001 hevedes det på side 1274 at informasjonen omrøykevaner ble hentet fra journalene til 100 pasienter. Ytterligere 37 pasienter ble oppringt og gaslik informasjon til Sudbø et al. Det er ingen ting som tyder på at slike opplysninger kan ha værthentet fra pasientjournalene, slik det hevdes. Det er ingen holdepunkter for at for eksempel JonSudbø har hatt tilgang til de medisinske journalene til disse pasientene. I så fall måtte Sudbø hafått kopier av journalen tilsendt, eller eventuelt reist omkring på Vestlandet og hentet framopplysningene på den måten. I alle fall ville medisinske journaler ofte mangle systematiskeopplysninger om røyking (ikke-røyk, nåværende røyker, tidligere røyker). Tilsvarende er detliten grunn til å tro at opplysninger om alkoholbruk har vært tilgjengelig på noen systematiskmåte.Sudbø opplyser at han selv, sammen med Puntervold og Reith, ringte rundt til de 37pasienter man angivelig manglet røykedata på, for å få supplert datagrunnlaget. Det finnesimidlertid ingen logg for gjennomføring av slike telefonintervjuer. Sudbø har forklart atopplysninger som fremkom i slike telefonsamtaler ble notert på løse lapper og/eller plottetdirekte inn i datafilen. Puntervold og Reith forklarer imidlertid at de ikke har ringt noen pasienterom dette. Kommisjonen anser det dessuten som usannsynlig at man har ringt til tilstrekkeligantall pasienter som det må ha vært behov for supplerende opplysninger om. Videre bemerkesdet at 48 personer var døde i 1995, altså før det tidspunktet opplysninger angivelig skulle ha blitt
84
innhentet (se tabell i vedlegg 4). Kommisjonen fester med andre ord ikke lit til Sudbøs forklaringpå dette punkt.Herunder skal det bemerkes at Sudbø som hovedveileder bidro med røykedata til en avsine stipendiater i 2004/2005. Stipendiaten har imidlertid i år, like etter atdoktorgradsavhandlingen var innlevert, på bakgrunn av denne saken revurdert dataene.Stipendiaten har funnet at det ikke er samsvar mellom de røykedatene vedkommende fikk, og derøykedataene som oppgis i New England Journal of Medicine 2001, selv om grunnlagsmaterialeter det samme. Stipendiaten fant bl.a. atallepasientene i det materialet vedkommende fikk fraSudbø, røyker, mens det i New England Journal of Medicine 2001 finnes pasienter (27/150) somikke har hatt noe forbruk av tobakk. Stipendiatens avhandling er bl.a. av den grunn holdt tilbake,og vil trolig bli trukket tilbake.Dataene man opererer med i New England Journal of Medicine tabell 1 er uforenligemed data man med rimelighet kan forvente at man hadde tilgang til på den tiden. Kommisjonenstiller seg sterkt tvilende til at Sudbø har hatt tilgang til fullstendige datasett om røykevaner slikhan har gitt inntrykk av i bl.a. New England Journal of Medicine 2001 og overfor sin stipendiat.Opplysningene om røyke- og alkoholvaner fremstår for kommisjonen som delvis fabrikkerte.Herunder finner kommisjonen grunn til å bemerke at, til tross for mangelfulle data, oppgis det iNew England Journal of Medicine 2001 side 1277 at røykeopplysningene ble tatt hensyn til i denmultivariate analysen, men at de ikke påvirket resultatene. Samtidig sies det at pålitelige data foralkoholbruk ikke var tilgjengelige for mer enn halvparten av pasientene, og at bruk av alkoholderfor ikke ble inkludert i analysen. Begge disse punktene er det gjort rede for på en elegant ogoverbevisende måte, og gjør at leseren får forsterket tro på denne forskeren. Dels fordi forskerenframstår som ærlig og grundig, og dels fordi han påpeker mulige svake sider ved sin egenundersøkelse. Denne elegansen i formidlingen av forskningsresultater kan være en muligforklaring på hvorfor ingen har funnet større grunn til å sette spørsmålstegn ved og kritisketterprøve publikasjonene, enn det som tidvis er gjort.
Dobbeltpublikasjon?Kommisjonen har reist spørsmål om de to artiklene i New England Journal of Medicine 2001 ogJ Pathol 2001 har så store likhetstrekk at de må anses som en dobbeltpublikasjon av sammeforskningsresultater i strid med god forskningsskikk. Hovedresultatene i New England Journal ofMedicine 2001 og J Pathol 2001 er sammenfallende, men likevel slik at J Pathol-artikkelen går imer detalj når det gjelder de fire patologenes dysplasiklassifikasjon.
85
Kommisjonen har forelagt spørsmålet og dobbeltpublikasjon for Reith og Sudbø. Reitherkjenner at det er en mangel at det ikke foreligger noe krysshenvisning. Han viser imidlertid tilat artikkelen i J Pathol 2001 i langt større grad enn New England Journal of Medicine 2001 går idybden på metodologiske og begrepsmessige forhold, av særskilt interesse for patologer. Reithmener således at artikkelen har en egenverdi, og at dette ikke var mulig å ta med i den artikkelensom skulle inn i New England Journal of Medicine. Sudbø viser til at temaet dobbelpublikasjonvar en aktuell problemstilling på publikasjonstidspunktet som ble drøftet, men at de kom til atdette var innenfor det akseptable. Reith har også vist til at manglende kryssreferanse har sinforklaring i at begge manuskriptene ble sendt inn parallelt, og at New England Journal ofMedicine ikke tillater kryssreferanser til artikler som bare er ”submitted”. En kryssreferanse bleifølge Reith beklageligvis glemt på det senere tidspunkt da manuskriptene etter flere runderendelig ble akseptert og var klar for publisering.Kommisjonen er i tvil på dette punktet, men har konkludert med at det ikke foreligger enåpenbar dobbeltpublikasjon. Kommisjonen har likevel valgt å kommentere dette punktet for åsynliggjøre at spørsmålet har vært vurdert.
Sammenblanding eller manipulasjon av bilder?Media har viet stor oppmerksomhet rundt det forhold at samme bilde forekommer to ganger,men oppgis å være av to forskjellige pasienter, i New England Journal of Medicine 2001. Detteer grunnlaget for den bekymringsmeldingen som tidsskriftsredaksjonen har lagt ut. Det er på detrene at det er tale om samme bilde, men i ulik størrelse. Dette er en åpenbar feil. Jon Sudbø haroverfor kommisjonen erkjent dette, men mener at det skjedde en unnskyldelig forveksling.Kommisjonen har ikke ansett dette som et vesentlig punkt, og har av den grunn ikkeforfulgt dette nærmere.
4.2.9 OppsummeringDet er på rene at det har vært en meget vanskelig prosess å foreta en grundig og etterprøvbargranskning av de faktiske forhold. Dels fordi forskningen er avansert og bygger på et storttallmateriale som kun kan forstås med innsikt om teknikaliteter knyttet til spesialisertpasientutredning.En annen årsak til at denne type gransking er svært vanskelig, er manglende presisdokumentasjon av alle ledd i forskningsprosessen. Dette problemet er stort og vanligforekommende og ikke enestående for denne saken. Videre vil datasett og lister forekomme iflere versjoner med forskjellige navn og det vil kunne være vanskelig å vite hvilke endringer somer gjort, av hvem og når. Granskningen vanskeliggjøres ytterligere av at man av personvern og86
konfidensialitetshensyn ikke opererer med personentydig identifikasjon av opplysningene, menmed prøvenummer, preparatnummer eller blokknummer, og på mange datafiler helt utenidentifikasjon. I dette avsnittet vil kommisjonen forsøke å oppsummere punkt 4.2.7.Kommisjonen har som nevnt konsentrert sin granskning rundt artikkelen i New England Journalof Medicine 2001, fordi den er den desidert viktigste publikasjonen i Jon Sudbøsforskningskarriere. Den danner grunnlaget for flere samtidige og senere originalartikler, bl.a. entilsvarende artikkel publisert i samme tidsskrift i 2004 (New England Journal of Medicine 2004).Hovedanalysene og hovedfunnene både 2001 og 2004 artiklene i New England Journal ofMedicine er basert det samme pasientmaterialet bestående av 150 pasienter. Prøver fra disse 150pasientene er blant annet klassifisert etter DNA-ploiditet i prøver fra dysplasier i munnhulen.Denne ploidiklassifikasjoen ble i 2001-artikkelen vist å være en sterk prediktor for fremtidligkreftutvikling. Funnet ble styrket i 2004-artikkelen med videre oppfølgning og 11 nyekrefttilfeller.Kommisjonen har fått datafilen (Sudbø8) fra MD Anderson, og har fått bekreftet at denligger til grunn for New England Journal of Medicine 2004 artikkelen ved blant annet åreprodusere Figur 3B.Denne filen stemmer overens med en liste som kommisjonen har fått fra Reith. Dennelisten stemmer igjen overens med en liste (L29) som Kommisjonen har fått fra seksjonssjefDanielsen og som er produsert i 1998.Etter grundig vurdering basert på kommisjonens egen gjennomgang av et stort antalllister og datafiler (Vedlegg 3: Filer_lister.doc), og Kreftregisterets omfattende innhenting av alleremisser med aktuelle dysplasidiagnoser, og rekonstruksjon av Sudbøs datamateriale medutgangspunkt i koplingen som Kreftregisteret gjorde i 1996 på en fil med 226 personer (63 av226 pasienter som stammet fra Oslo ble ikke koplet den gangen fordi de mangletfødselsnummer), har Kommisjonen funnet følgende fundamentale problemer med det sentralepasientmaterialet på 150 pasienter som er benyttet i blant annet New England Journal ofMedicine 2001 og 2004 artiklene, og i en rekke andre artikler:
Samme pasient forekommer flere gangerDe 150 pasientene finnes ikke, i den forstand at det så langt kommisjonen kan se, dreier seg ommaksimalt 141 pasienter. Grunnen til dette er at noen pasienter er representert med flere prøversom til sammen gir tallet 150. Å la en pasient gå igjen med flere dysplasi-prøver er i strid medbeskrivelsen i artiklene, og gir i denne sammenhengen ingen vitenskapelig mening. Dissereplikatene av personer er derfor ugyldige, og skulle ha vært ekskludert fra filen. Kommisjonenhar ikke kunnet anslå det nøyaktige antall replikater (dette på grunn av at 8 av de 150 mangler87
blokknummer på Reith-listen), men er kommet frem til at antallet forskjellige personer på filener maksimalt 141.
Manglende eksklusjon på grunn av samtidig eller tidligere kreftBlant de pasientene som kommisjonen har kunnet identifsere på Sudbø-8 filen finnes det et stortantall pasienter som skulle ha vært ekskludert fordi de hadde hatt munnhulekreft før ellersamtidig med den aktuelle dysplasien. Kommisjonen har funnet at minst 69 personer ikke erinkluderbare, da de på remissetidspunkt allerede hadde munnhulekreft.
Ploiditetsanalyser er ikke gjort på alle pasienterKommisjonen har bare kunnet finne igjen ploiditetsanalyser på 69 av observasjonene (65forskjellige personer) på Sudbø8-filen. Dette er basert på lister over ploiditetsanalyser somPuntervold har fremskaffet fra Sudbø-materialet (Gade/Ondontologen). Et langt større antallploiditetsanalyser (> 150) er gjort, men samme pasient går igjen flere ganger.
Aldersfordeling stemmer ikkeAldersfordelingen i originalmaterialet fra Gade og Odontologen stemmer ikke overens medaldersfordelingen i det materialet som lå til grunn for New England Journal of Medicine 2004Av disse fire fundamentale problemene, er det nummer 2 som fremstår som mest alvorlig, ogsom Kommisjonen med høy grad av sikkerhet kan fastslå, fordi den er underbygget meduavhengig informasjon fra flere hold. Når over halve det sentrale pasientmaterialet faller bort,faller også alle resultater i begge New England Journal of Medicine-artiklene samt all videreforskning som bygger på disse.
4.2.10
Hovedkonklusjon
Kommisjonen legger til grunn at Jon Sudbø ikke har hatt tilgang til det antall pasienter som hanangir å ha hatt, herunder at dysplasiklassifikasjon og inklusjonsprosessen ikke har skjedd på enredelig måte slik det er beskrevet. Kommisjonen viser spesielt til det forhold at av de 150 avangivelig 263 pasienter som ble inkludert i studien, så skulle over halvparten av de inkludertepasientene vært ekskludert pga. forutgående eller samtidig kreftdiagnose i munnhulen.Dermed er det klart at begge artiklene i New England Journal of Medicine og all videreforskning som bygger på det samme materialet ikke kan stemme eller har grunnlag ivirkeligheten, utover at de bygger på kvalifiserte gjetninger. Publikasjoner som bygger på dettegrunnlagsmaterialet må av den grunn trekkes tilbake, se videre punkt 4.4.88
De avdekkede feil kan ha to forklaringer:••En uheldig kombinasjon av unnskyldelige feil og misforståelser, samt manglendekompetanse, årvåkenhet og grundighet.Vitenskapelig uredelighet, dvs. fabrikasjon og manipulasjon av forskningsdata og bevisstvilledende forskningsrapportering.Kommisjonen finner at de feil og mangler som er avdekket er for mange, for store og foråpenbare til at de kan tilskrives unnskyldelige feil, inkompetanse eller lignende. Kommisjonenlegger til grunn at data er manipulert og fabrikkert, og trolig tilpasset de funn man ønsket å finnefram til.Kommisjonen legger til grunn at Jon Sudbø har vært alene om manipulering ogfabrikasjon av data. Kommisjonen vil imidlertid komme nærmere tilbake til dette, herunderandre aktørers rolle i fortsettelsen, se særlig kapittel 5.Kommisjonen legger på bakgrunn av redegjørelsen ovenfor til grunn at det foreliggervitenskapelig uredelighet fra Jon Sudbøs side ved doktorgradsavhandlingen, New EnglandJournal of Medicine 2001, Oncology 2001 og J Pathol. 2001.
4.3
Etter disputasen
Etter å ha gjennomført disputas ved Universitetet i Oslo 9. mars 2001 fortsatte Jon Sudbø sinvitenskapelige virksomhet, innenfor det samme området, dvs. munnhulekreft. Dette resulterte ien rekke vitenskapelige originalartikler, reviews (oversiktsartikler), leserinnlegg og lignende,som ble publisert fortløpende i flere anerkjente medisinske tidsskrifter.I forbindelse med publikasjon av forskningsresultatene i New England Journal ofMedicine 2001 skrev Reith og Sudbø til Statens helsetilsyn hvor de ga uttrykk for atforskningsresultatene må føre til endret praksis når det gjelder screening og behandling avpasienter med hvite flekker i munnhulen i Norge. På den måten vil mange pasienter kunnereddes, hevdes det. De nevnte også behovet for en prospektiv studie. Statens helsetilsyn svarte atde ikke hadde mulighet til å legge om behandlingspraksis i Norge, bl.a. pga. manglenderessurser. Helsetilsynet viste videre til at støtte til en prospektiv studie måtte søkes fra annethold.37Samtidig med publiseringen av New England Journal of Medicine 2001 rapporterteDagens medisin den 26. april 2001 om ”Gjennombrudd i kampen mot oral kreft.” ”Mellom åtti37
Brev fra Reith til Konstituert helsedirektør av 11. januar 2001. Brev fra Statens helsetilsyn til Reith av 17. april2001. Brev av 23. april 01 Fra Reith og Sudbø til Statens helsetilsyn.
89
og nitti prosent av alle kreftutviklinger kan forutsies ved kromosomanalyse” skal Sudbø ha uttalttil avisen.I en leder skrevet av Scott M. Lippman og Waun Ki Hong (som Sudbø senere innledet etsamarbeid med) i New England Journal of Medicine 2001 i samme tidsskriftutgave, ble studienkalt et viktig fremskritt når det gjelder vurderingen av risiko for munnhulekreft hos pasientermed leukoplaki. I lederen heter det:“The new molecular data have important implications for the standard of care of patients with oralleukoplakia. Local management ranges from watchful waiting to resection with widely varying marginwidths, depending on histologic and clinical features. Molecular information can redefine the assessment ofthe risk of oral cancer and even guide treatment, with the one important caveat that the molecular resultsinvolving patients with severe dysplasia in the studies we have discussed may have been confounded by thesmall numbers of such patients and the likelihood that they underwent more rigorous surgical proceduresthan did the patients with mild or moderate dysplasia. It is time to establish standard molecular assays tohelp plan the management of oral leukoplakia. … Confirmation of the completeness of resection, closemonitoring, and chemoprevention trials would be appropriate approaches for patients deemed at high riskon the basis of molecular assays, including patients with hyperplasia.”38
I 2001 søkte Jon Sudbø Kreftforeningen om penger til prosjektet ”Tidlig diagnose og behandling(kjemoprevensjon) av forstadier til munnhulekreft” for 3 år. Søknaden ble avslått.Samtidig søkte han også Helse og rehabilitering via Kreftforeningen om midler tilprosjektet ”Protocol – forebygging av kreft i munnhulen”. Han fikk bevilget midler til detteprosjektet for årene 2002-2004. Han fikk senere bevilget midler også for 2005.I 2001-2002 fikk Jon Sudbø også kontakt med amerikanske forskere innenfor det sammefagfeltet. Reith og Sudbø traff Scott Lippman fra MD Anderson personlig første gang inovember 2002 under en konferanse i Frankfurt. Ifølge Reith var det Lippman som foreslo detsamarbeid som ble innledet. Dette samarbeidet ledet til flere publikasjoner i de fremstemedisinske tidsskrifter, som for eksempel New England Journal of Medicine i 2004 og TheLancet i 2005, se punkt 5.3.I 2001 hadde således Jon Sudbø startet arbeidet med det som skulle bli en del av en storprosjektsøknad til National Cancer Institute (NCI) i USA. Prosjektet ble innvilget 10 millionerdollar, hvorav mesteparten gikk til MD Anderson i USA.Kommisjonen vil komme nærmere tilbake til denne PROTOCOL-studien under punkt5.3, men vil først redegjøre for konsekvensen av hovedkonklusjonen i 4.2.10 for øvrigepublikasjoner.
38
Lippman S. M., Hong W. K. Molecular Markers of the Risk of Oral Cancer. N Engl J Med 2001; 344:1323-1326.
90
4.4
Øvrige publikasjoner
Kommisjonen vil i det følgende ta for seg de artikler som er beheftet med så store mangler ogtvil at de ikke kan anses som valide, og som av den grunn bør trekkes tilbake. Kommisjonen hartatt for seg de 38 publikasjonene som fremkom ved et enkelt søk på Jon Sudbø i januar 2006 idatabasen PubMed39, se vedlegg 1. Kommisjonen er kjent med at denne publikasjonslisten ikkeer uttømmende, men har likevel funnet å legge listen til grunn da den etter all sannsynlighetinneholder de viktigste arbeidene. Sudbø har ikke kommentert utkastet til dette avsnitt særskilt,men viser til de kommentarer som er referert tidligere.Kommisjonen viser til hovedkonklusjonen i punkt 4.2.10, og til den generelle redegjørelsenfor tilbaketrekking av vitenskapelige publikasjoner i punkt 3.6.I det følgende vil kommisjonen ta for seg de publikasjonene som kommisjonen har funnetfeil ved og lignende. Av størst interesse er Sudbøs originalartikler, totalt 12. Med originalartikkelmenes at artikkelen inneholder originale forskningsresultater som ikke er presentert tidligere. Deter slike artikler som er viktigst og mest meritterende innenfor forskningsmiljøene. Kommisjonenhar ved gjennomgangen av doktorgradsavhandlingen som inneholder 6 originalartikler, tidligerelagt til grunn at tre originalartikler må trekkes tilbake, mens det ikke er funnet feil ved treoriginalartikler, jf. punkt 4.2. I dette avsnittet legges det til grunn at ytterlige 5 originalartiklermå trekkes tilbake eller i det minste uttrykkes bekymring for deres validitet. Det vil si at 8 av 12arbeider fremstår som mer eller mindre ugyldige. Av Sudbøs originalartikler er det bare de treførste artiklene i doktorgradavhandlingen det ikke er funnet feil ved, se punkt 4.2.5, samt enmindre oppsiktsvekkende artikkel publisert i Oral Disease 2003.40Etter dette er det grunnlag forå si at det vesentligste av Jon Sudbøs vitenskapelige produksjon er beheftet med feil og manglerpga. vitenskapelig uredelighet.De publikasjonene som det ikke er funnet feil ved dreier seg, bortsett fra fire originalartikler,hovedsakelig om mindre reviews og brev av mindre vitenskapelig verdi, samt arbeider hvor JonSudbø bare har vært medforfatter, det vil si publikasjoner som hovedsakelig er utarbeidet avandre.•Sudbø J, Warloe T, Aamdal S, Reith A, Bryne M. Diagnostikk og behandling avforstadier til munnhulekreft [Diagnosis and treatment of oral precancerous lesions]Tidsskr Nor Laegeforen 2001;121:3066-71. Oversiktsartikkel.
3940
www.pubmed.govSudbø J, Reith A, Florenes VA, Nesland JM, Ristimaki A, Bryne M. COX-2 -expression in striated muscle underphysiological conditions. Oral Dis 2003:313-6.
91
Artikkelen er en oversiktsartikkel som oppsummerer resultater fra Sudbøs artiklersom inngikk i hans doktorgrad. Artikkelen bygger dermed på grunnlagsdata somkommisjonen har lagt til grunn er manipulert og dels fabrikkert, jf. punkt 4.2.Artikkelen må derfor trekkes tilbake.•Sudbø J, Kildal W, Johannessen AC, Koppang HS, Sudbo A, Danielsen HE, Risberg B,Reith A. Gross genomic aberrations in precancers: clinical implications of a long-termfollow-up study in oral erythroplakias. J Clin Oncol. 2002;20:456-62. Originalartikkel.Artikkelen gjør gjeldende at den bygger på analyser av et materiale som ikke harblitt brukt i tidligere publikasjoner. Av doktorgradsavhandlingen fremgår det atman samlet inn materiale fra 263 personer, og at 21 av disse ble ekskludert fraden opprinnelige studien på grunn av at de hadde røde flekker i munnhulen(erythroplakier). Det er personer med erythroplakier som er studert i dennestudien. I metodedelen fremgår det at materialet består av 57 prøver med humantbiologisk materiale fra 37 pasienter med erythroplakier samlet inn i perioden1988-2000. Kommisjonen viser her til at vi ikke har funnet noen holdepunkter forat dette grunnlagsmaterialet eksisterer.I kommisjonens øvrige funn, har kommisjonen kommet frem til at dethefter så stor tvil ved om dette grunnlagsmaterialet faktisk eksisterer, at det errimelig å sette et stort spørsmålstegn ved denne artikkelen.•Sudbø J. [DNA ploidy analysis--a possibility for early identification of patient with riskof oral cancer] Läkartidningen. 2001;98:4980-4. Review.Artikkelen er en review av Sudbøs egne forskningsresultater. Det vil si at denbygger på det datagrunnlaget som kommisjonen har lagt til grunn er manipulertog delvis fabrikkert, jf. punkt 4.2. Artikkelen må av den grunn trekkes tilbake.•Reith A, Sudbø J. Impact of genomic instability in risk assessment and chemopreventionof oral premalignancies. Int J Cancer. 2002;101:205-9. Review.Artikkelen er en review som bygger på Jon Sudbøs tidligere forskningsresultater,som igjen bygger på grunnlagsdata som er manipulert og delvis fabrikkert, jf.punkt 4.2. Artikkelen må av den grunn trekkes tilbake.92
•
Sudbø J, Reith A. Which putatively pre-malignant oral lesions become oral cancers?Clinical relevance of early targeting of high-risk individuals.J Oral Pathol Med. 2003;32:63-70. Review.Artikkelen er en review som bygger på Jon Sudbøs tidligere forskningsresultater,som igjen bygger på grunnlagsdata som er manipulert og delvis fabrikkert, jf.punkt 4.2. Artikkelen må av den grunn trekkes tilbake.
•
Sudbø J, Reith A. When is an oral leukoplakia premalignant?Oral Oncol. 2002;38:813-4; author reply 811-2. Debatt innlegg.Artikkelen er en review som bygger på Jon Sudbøs tidligere forskningsresultater,som igjen bygger på grunnlagsdata som er manipulert og delvis er fabrikkert, jf.punkt 4.2. Artikkelen må av den grunn trekkes tilbake.
•
Sudbø J, Ristimaki A, Sondresen JE, Kildal W, Boysen M, Koppang HS, Reith A,Risberg B, Nesland JM, Bryne M. Cyclooxygenase-2 (COX-2) expression in high-riskpremalignant oral lesions. Oral Oncol. 2003;39:497-505. Originalartikkel.Studien bygger på en analyse av de grunnlagsdata som ligger til grunn for delerav doktorgradsarbeidet, og som er manipulert og delvis fabrikkert, jf. punkt 4.2.Artikkelen må derfor trekkes tilbake.
•
Sudbø J, Bryne M, Mao L, Lotan R, Reith A, Kildal W, Davidson B, Soland TM,Lippman SM. Molecular based treatment of oral cancer.Oral Oncol. 2003;39:749-58. Review.Artikkelen er en review som bygger det grunnlagsmaterialet som ble samlet innved doktorgradsarbeidet, og som er manipulert og delvis fabrikkert, jf. punkt 4.2.Artikkelen må derfor trekkes tilbake.
•
Sudbø J, Lippman SM, Lee JJ, Mao L, Kildal W, Sudbo A, Sagen S, Bryne M, El-NaggarA, Risberg B, Evensen JF, Reith A. The influence of resection and aneuploidy onmortality in oral leukoplakia. N Engl J Med. 2004;350:1405-13. Originalartikkel.93
Artikkelen bygger dels på det materialet som ble samlet inn i forbindelse meddoktorgradsmaterialet, og som kommisjonen har funnet er manipulert og delvisfabrikkert, jf. punkt 4.2. Se særlig under punkt 4.2.7 hvor kommisjonen redegjørfor sammenligningen av den datalisten som ligger til grunn for New EnglandJournal of Medicine 2001 og New England Journal of Medicine 2004. I tilleggbygger artikkelen på en oppfølgning av de samme pasientene, som ikke funnetsted. Det sistnevnte forhold er delvis innrømmet av Sudbø overfor kommisjonen.Artikkelen må derfor trekkes tilbake.•Sudbø J, Reith A. The evolution of predictive oncology and molecular-based therapy fororal cancer prevention. Int J Cancer. 2005;115:339-45. Review.Artikkelen er en review av tidligere forskning, og som støtter seg på materialebrukt i både i New England Journal of Medicine 2001 og New England Journal ofMedicine 2004. Kommisjonen har slått fast at dette materialet er manipulert ogdelvis fabrikkert, jf. punkt 4.2. Artikkelen må derfor trekkes tilbake.•Sudbø J, Samuelsson R, Risberg B, Heistein S, Nyhus C, Samuelsson M, Puntervold R,Sigstad E, Davidson B, Reith A, Berner A. Risk markers of oral cancer in clinicallynormal mucosa as an aid in smoking cessation counseling. J Clin Oncol. 2005;23:1927-33. Originalartikkel.Artikkelen bygger på angivelig nytt innsamlet materiale fra 275 personer. Dettematerialet skal ha vært samlet inn via tannlegeklinikker. Kommisjonen har forsøktå skaffe til veie dokumentasjon som viser at dette grunnlagsmateriale faktiskeksisterer. Kommisjonen har blant annet vært i kontakt med de tannlegene somstår som medforfattere fordi det var med på å samle inn materiale fra sinepasienter. Disse tannlegene bekrefter at de ble bedt av Jon Sudbø om å samle innavskrapninger fra pasienter. De samlet imidlertid inn kun 10-20 prøver hver. Forkommisjonen fremstår det derfor som lite sannsynlig at Sudbø skal ha hattkomplett datamateriale fra 275 pasienter. Videre finner kommisjonen det litesannsynlig at disse pasientene skal ha blitt innrullert i et røykeavvenningsprogrammed videre oppfølgning. Det er ikke funnet holdepunkter for at et slikt programble gjennomført. De nevnte tannlegekollegaene stiller seg uforstående til et slikt94
program. Kommisjonens vurdering må også ses i lys av øvrige avvik fra godvitenskapelig praksis som kommisjonen har funnet.Jon Sudbø har innrømmet at det ikke er målt kotinin-nivå på alle pasientersom deltok i studien. Det sistnevnte forholdet alene, gjør at publikasjonen ikkelenger kan anses som valid. Tidsskriftet har publisert en bekymringsmelding omdenne artikkelen og det opplyses fra redaksjonen at med unntak av Sudbø ogReith har ingen av medforfatterne deltatt i manuskriptutarbeidelsen og såledesikke tilfredsstiller for forfatterkriteriene. Artikkelen må etter kommisjonensoppfatning trekkes tilbake.•Sudbø J. Novel management of oral cancer: a paradigm of predictive oncology. Clin MedRes. 2004;2:233-42. Review.Artikkelen er en review av tidligere forskning hvor det vises til det opprinneligegrunnlagsmaterialet som ble samlet inn ved doktorgradavhandlingen, og som ermanipulert og delvis fabrikkert, jf. punkt 4.2. Artikkelen må av den grunn trekkestilbake.•Sudbø J, Lee JJ, Lippman SM, Mork J, Sagen S, Flatner N, Ristimaki A, Sudbo A, MaoL, Zhou X, Kildal W, Evensen JF, Reith A, Dannenberg AJ. Non-steroidal anti-inflammatory drugs and the risk of oral cancer: a nested case-control study. Lancet.2005;366:1359-66. Originalartikkel.Artikkelen bygger i sin helhet på et fabrikkert datamateriale, og er av den grunnallerede trukket tilbake. Disse forholdene er erkjent av Sudbø. Kommisjonen harav den grunn ikke brukt mye tid på å granske denne artikkelen. Kommisjonenfikk imidlertid tilgang til korrespondansen mellom Jon Sudbø og J.Jack Lee vedMD Anderson. Dermed fant kommisjonen frem til hvordan dette nyedatagrunnlaget ble til, se punkt 5.3.
95
55.1Innledning
Mulige forklaringer
I kapittel 4 legger kommisjonen til grunn at det grunnlagsmaterialet som ligger til grunn forhoveddelen av doktorgradsprosjektet, er manipulert og fabrikkert. Det bidrar til at en rekkesenere publikasjoner må ses bort fra. Kommisjonen har også funnet flere andre tilfeller avdatamanipulasjon og -fabrikasjon i den senere vitenskapelige karrieren til Jon Sudbø.Kommisjonen har lagt til grunn at dette skyldes vitenskapelig uredelighet fra Jon Sudbøs side.De kommentarer som Sudbø har gitt til utkastet til rapport, har ikke gitt kommisjonengrunnlag for å foreta vesentlige endringer i de foreløpige konklusjoner man har trukket underveisi granskningen.Kommisjonen har ikke funnet holdepunkter for at andre har vært med på manipulasjon ogfabrikasjon av forskningsdata eller på annen måte gjort seg skyldig i vitenskapelig uredelighet,slik dette er definert i den nylig vedtatte forskningsetikkloven § 5 andre avsnitt (ikke trådt ikraft).I mandatet er kommisjonen bedt om å søke en forklaring på de avdekkede forhold.Kommisjonen har da også stilt seg spørsmål om hvordan disse – i ettertid – åpenbare og groveforholdene kunne finne sted, i samarbeid med en rekke velkvalifiserte medforfattere ogsamarbeidspartnere, og ved en velrenommert forskningsinstitusjon.Innledningsvis vil kommisjonen fremheve det åpenbare, nemlig at det alltid vil være enmulighet for den uredelige å lure og bedra andre. Intet system er vanntett i så måte, ei hellernorsk forskning. Spørsmålet her er i første rekke om det er mulig å identifisere medvirkendefaktorer til de forhold som granskningen har avdekket.Kommisjonen har på ingen måte grunnlag for å trekke sikre slutninger om hva som harforårsaket disse forhold. Kommisjonen finner imidlertid grunn til å peke på enkelte forhold somkan bidra til å kaste lys over hvordan og hvorfor ”ting ble som det ble”. For kommisjonen er endel av forklaringen at en rekke ”uheldige” forhold har opptrådt samtidig, og disse må ses isammenheng for å kaste lys over saken.Kritikkverdige forhold er oppsummert i kapittel 7.
5.2
Doktorgradsprosjektet og videre forskning
Kommisjonen sitter med et klart inntrykk av at Jon Sudbø har operert relativt fritt og selvstendigbåde som forskerrekrutt (stipendiat) og forsker. Dette inntrykket bekreftes av flere av Sudbøs96
kolleger. Reith forklarer dette med at Jon Sudbø fremsto som en usedvanlig flinkdoktorgradskandidat, og at han også var relativt erfaren og ikke så ung som mange av de andrestipendiatene. Sudbø har i kommentarer til utkastet til rapport tatt avstand fra Reiths beskrivelseav Sudbø sin relativt frie rolle, og har i denne forbindelse pekt på at han hadde liten eller ingenforskererfaring på det tidspunkt han påbegynte sitt doktorgradsprosjekt. Sudbø opplever dettesom et forsøk på ansvarsfraskrivelse fra Reiths side.Kommisjonens samlede inntrykk av de opplysninger som er kommet fram undergranskningen er likevel at Reith synes å ha hatt en aktiv, men like fullt relativt overflatisk rollesom veileder. Reith synes å ha observert hva som har foregått og diskutert forløpende medSudbø, uten å være involvert i selve analysene og behandlingen av data. Han kan heller ikke hagjennomført stikkprøver eller lignende for å sikre kvaliteten. Det virker som om Reith har svartpå spørsmål fra Sudbø, men ikke selv stilt kontrollspørsmål eller lignende. Reith har imidlertidformidlet kontakt med både Kreftregisteret og Gade, og således vært en sentral initiativtaker ogdøråpner. Deretter har han latt Sudbø arbeide selvstendig med selve dataanalysene.Kommisjonen viser her til at Sudbø som nevnt fikk tilgang til både materialet og pasientdataene.Dermed kunne datalister, blokker og analyseresultater manipuleres og byttes om, uten at noenoppdaget det. Kommisjonen finner i lys av faktabeskrivelsen i kapittel 4 grunnlag for å si atReith burde vært mer aktpågivende som veileder og fulgt bedre med på Sudbøs behandling avdatamaterialet og ikke minst etterprøvd i større grad enkelte forhold som er feilaktig beskrevet ipublikasjoner hvor han står som seniorforfatter.Et annet moment som kan gi en viss forklaring på de forhold som er avdekket undergranskningen, er at det ikke foreligger noen som helst formell godkjenning eller gjennomgang avprosjektet. Det er ikke innhentet tillatelser/vurderinger fra Statens helsetilsyn (nå: Sosial- oghelsedirektoratet), Datatilsynet/Norsk samfunnsvitenskapelig datatjeneste (NSD) eller Regionalkomité for medisinsk forskningsetikk (REK), noe som også er med på å unndra prosjektetnærmere undersøkelser og kvalitetssikring. Som nevnt ovenfor er denne mangelen noe Sudbøselv, Reith og Radiumhospitalet må ta ansvaret for.Kommisjonen vil imidlertid understreke at det ikke foreligger holdepunkter for at slikmanglende overholdelse av formalia har vært en bevisst strategi for å kunne drive uredeligforskning. Disse forhold synes hovedsakelig å kunne forklares ut fra at det ikke synes å haeksistert effektive og gode nok rutiner hva gjelder kontroll og tilsyn med forskningsprosjekterved Radiumhospitalet. At Sudbø ikke hadde et formelt ansettelsesforhold til Radiumhospitalet, erklart nok ingen akseptabel forklaring. Kommisjonen har da også lagt til grunn (punkt 4.2.3) atforskningen foregikk i regi av Radiumhospitalet, og at institusjonen satt med det overordnedeansvaret for Sudbøs forskningsvirksomhet. Selv om det eksisterte instrukser og kontrollorganer97
ved institusjonen, så virker det ikke som om disse var tilfredsstillende implementert. Prosjektetble for eksempel ikke fremlagt for protokollutvalget, og ingen fant grunn til å stille spørsmål veddet. Forskere tilknyttet avdelingen synes da også å ha hatt et relativt lemfeldig forhold tilformalia. Dette gjelder i forhold til innsamling, utlevering og omgang med humant biologiskmateriale og sensitive pasientopplysninger, tilrådninger fra Regional komité for medisinskforskningsetikk, konsesjoner for databehandling og dispensasjon fra taushetsplikt. Kommisjonenhar også funnet grunn til å reise tvil om organiseringen av dette forskningsprosjektet har værtforsvarlig. Organiseringen er et institusjonelt ansvar.Videre kan det synes som at når noen har vært bekymret for om kvalitetsrutiner har værtfulgt, så har dette verken blitt fulgt opp av ledelsen eller kolleger, kanskje fordi man ikke har hattsystem eller tradisjon for denne typen varsling. Her skal det bemerkes at en person tok vare påall dokumentasjon i kontakten med Sudbø, nettopp fordi vedkommende hadde mistanker. Dettevar på slutten av 90-tallet. Vedkommende ønsket imidlertid ikke å komme i en belastende”varslerposisjon”, og avsto derfor fra nærmere undersøkelser.Når det gjelder forholdet til medforfatterne, så er det som trolig har skjedd rundtpublikasjonen av New England Journal of Medicine 2001 tilsynelatende karakteristisk forSudbøs valg av og samarbeid med medforfattere i senere arbeider. Her bygger kommisjonen påskriftlige og muntlige tilbakemeldinger fra nesten 60 medforfattere. En mulig forklaring på atforskningsjukset ikke har blitt avdekket tidligere, kan delvis ligge i at medforfatterne i detvesentlige fremstår som underleverandører eller som overordnede garantister (dvs.seniorforskere som først og fremst har spilt en sentral rolle på det overordnede plan (idé,planlegging, sammenskriving og lignende), og som ved hjelp av sin faglige tyngde har bidratt tilå gi arbeidene faglig legitimitet). Forfatterne har videre i hovedsak forholdt seg til Sudbø. Dethar med andre ord vært tilsynelatende liten kommunikasjon ”horisontalt” mellom de ulikemedforfatterne eller forskergruppene. Det vesentlige av kommunikasjon har skjedd via Sudbø.Sudbø har riktignok fremholdt at han ikke har hindret kommunikasjon medforfatterne imellompå noen måte. Men kommisjonen kan heller ikke se at han har bidratt eller oppfordret til slikkontakt medforfatterne imellom. Sudbø har på den måten hatt kontroll med hvilke datasett,hvilken informasjon og lignende den enkelte medforfatter har sittet med. Det er verdt å påpeke atdenne informasjonen trolig har vært begrenset. Ingen av medforfatterne synes å ha hatt tilgang tildet underliggende datamaterialet og pasientdata. Dermed har medforfatterne hatt liten mulighettil å føre kontroll med grunnlagsmaterialet. De har vel heller ikke ansett dette som en naturligeller nærliggende del av det oppdraget de var blitt tildelt. En slik arbeidsfordeling er imidlertidikke et uvanlig fenomen ved medisinske publikasjoner – et forhold som det åpenbart må tashensyn til i vurderingen av hvorvidt det er grunnlag for å rette kritikk mot medforfattere. Som98
eksempel på dette vises det til samarbeidet mellom Jon Sudbø og J.Jack Lee i forbindelse medartikkelen som ble publisert i New England Journal of Medicine 2004:På et tidspunkt sender Sudbø en radikalt endret fil til J.Jack Lee ved MD Anderson.41Filen viser "datacleaning along the way" som Lee uttryker det i en e-post til Gunnar Sæter 13. januar 2006 etter at dennesaken ble kjent. Kommisjonen har koblet sammen to filer: a) ”sudbo8” som er den filen som ble brukt iNew England Journal of Medicine 2004 artikkelen og b) ”updated rawdata” som iflg Lee er den første filenhan mottok fra Sudbø for 2004 artikkelen. Koblingen har skjedd ved variabelen patnid (pasientnummer)som er på begge filer. Kommisjonen har tatt med følgende variable: alder, tobakk, år leukoplaki og år kreft.Et utdrag av de 150 observasjonene er gitt i tabell 3 i rapporten. Som tidligere nevnt er det påfallende at”år leukoplaki” har endret seg fra første til siste fil uten at alder har endret seg. Dette er matematikk somikke stemmer hvis alder er alder ved leukoplaki. I e-post fra Sudbo til Lee av 8/8-2003 skriver Sudbø: "Onepoint: the age of the subjects have been recalculated to what they were at the time of initial diagnosis". Detsiste skulle bety at det er alder ved leukoplaki det er tale om, se punkt 4.2.7.
På generelt grunnlag finner kommisjonen grunn til å bemerke at mange stipendiater ogforskere vil ha anledning til å manipulere med, og til og med fabrikkere grunnlagsmateriale, utenat verken veiledere eller medforfattere vil kunne oppdage det. Forskning er da også i stor gradbasert på tillit, slik det nødvendigvis må være. Det er viktig og nødvendig at forskere har tillit tilhverandre, at man kan stole på at det andre leverer er etterrettelig. Arbeidsgiver må kunne hatillit til sine ansatte, og tidsskrifter må kunne ha tillit til forskere. Forskningsdeltakere ogallmennheten generelt må også ha tillit til forskere. Men tilliten kan ikke være grenseløs. Det måvære en viss kontroll og sunn skepsis, for på et eller annet tidspunkt bør varsellamper begynne ålyse, noe som foranlediger nærmere ettersyn og kontroll. Men det at de færreste forskere holderdet som nærliggende at noen av deres samarbeidspartnere vil fabrikkere forskningsdata, kanforklare noe av det som i ettertid lett kan fremstå som manglende aktpågivenhet.På den annen side er det, slik kommisjonen ser det, enkelte beskrivelser i artiklene somflere burde ha reagert på. Det være seg medforfattere, veiledere, overordnede, opponenter,kolleger og andre. Kommisjonen viser spesielt til redegjørelsen for re-klassifikasjonen avdysplasiene som angivelig ble foretatt av fire uavhengige patologer,42samt ploididitetsanalysensom angivelig også ble foretatt av fire uavhengige observatører.43Dette var verken vanlig ellertilfelle. Kommisjonen viser også til påstandene om rapportering til Kreftregisteret,oppfølgningsprogram for pasientene og påstanden om at man satt med nær fullstendigerøykedata. Dette er forhold som man kanskje i ettertid må kunne si at noen burde ha oppdaget,4142
Dataliste: ”updated_rawdata_renamed_sudbo8.xls”: ”All histologic sections were subsequently reevaluated by four pathologists according to the guidelines of theWorld Health Organization”;NEJM 2001 side 1272.43: ”All specimens were coded, and DNA histograms were classified in a blinded manner by four observers”; NewEngland Journal of Medicine 2001
99
eller i det minste satt spørsmålstegn ved – både i og utenfor fagmiljøet ved institusjonen. Dettetatt i betraktning av at disse opplysningene ble publisert i det internasjonalt mest anerkjentmedisinske tidsskriftet, nemlig New England Journal of Medicine, noe som er uvanlig for norskeforskere. Samtidig skal det i medforfatternes forsvar medgis at så vel veileder som medforfatterei samtaler med kommisjonen har hatt vanskeligheter med og brukt lang tid på å ta inn over seg atartikler, som de selv har vært med på og følt eierskap til, faktisk er basert på fabrikkerte data. Detsiste viser hvor utenkelig og uvanlig fabrikasjon av forskningsdata i norske forskningsmiljøeroppfattes å være av forskere.
5.3
Særlig om NCI-søknaden og Lancet-artikkelen
I perioden 2000-2001 fikk som nevnt Jon Sudbø og Albrecht Reith ideen til en ny og størrestudie. Også denne studien var knyttet til forebygging av kreft i munnhulen, men denne gangenskulle det være en prospektiv studie, hvor de skulle følge pasienter fremover i tid. Studien fikknavnet PROTOCOL, som står forProspective randomized trial on preventing oral carcinomasfrom oral leukoplakia.Jon Sudbø utarbeidet i 2000/2001 en protokoll. Etter interne diskusjoner vedRadiumhospitalet ble det foreslått at protokollen skulle oversettes til engelsk, da potensialet bleansett som stort, og at det burde bli en multinasjonal studie. Jon Sudbø oversatte protokollen selvsommeren 2001.Samtidig søkte Sudbø og Reith om støtte til prosjektet fra Helse og Rehabilitering(Ekstra-Lotto) via Kreftforeningen. De fikk bevilget midler for årene 2002 til 31. desember2005.I 2002-2003 var Jon Sudbø og Albrecht Reith relativt ofte i USA på seminarer oglignende. De kom i den forbindelse i kontakt med Scott Lippman og fagmiljøet rundt MDAnderson, samt Andrew Dannenberg fra Weill Medical College ved Cornell University. Dennekontakten utviklet seg etter hvert til et faglig samarbeid. Dette samarbeidet resulterte i at man bleenige om å søke National Cancer Institute (NCI) om midler til en stor studie. SudbøsPROTOCOL-studie skulle inngå som en bestanddel i denne studien. Søknad ble sendt inn til NCIsommeren 2003.Jon Sudbø har opplyst at han på samme tid, altså medio 2003 begynte arbeidet med dendatalisten som senere skulle danne grunnlaget for Lancet-artikkelen, som har en visssammenheng med NCI-studien, ved at en foreløpig versjon av disse dataene ifølge Lippmanfremkommer i søknaden, uten at disse dataene sto sentralt. Jon Sudbø har forklart tilkommisjonen at det til grunn for denne datalisten ligger en rekke data publisert i regi av bl.a.Kreftregisteret, Folkehelseinstituttet og andre. Dette er data om tobakksvaner, kreft og andre100
relevante forhold. Han laget således en oppstilling av kreftforekomst i ulike aldersgrupper ogulike tidsperioder, og satte deretter inn tentative fødselsdatoer på fiktive pasienter. Listen byggermed andre ord på kvalifiserte gjetninger. Listen ble supplert med fiktiv NSAID-bruk, ulike typer,ulike doser, ulike tidsintervaller, slik at man kunne se hvordan ulike forhold fordeler seg mellompasienter og kontrollgruppen, med ulik risiko for å få munnhulekreft ut fra røykevaner. Sudbøhar forklart at dette opprinnelig var ment som en ren simuleringsdatabase – dvs. fiktivetalleksperimenter. Det er ikke funnet holdepunkter for at andre kjente til dette.Det videre tids- og hendelsesforløp er noe uklart for kommisjonen. Kommisjonen harimidlertid hatt tilgang til den omfattende korrespondansen som fant sted mellom Jon Sudbø ogbiostatistikeren ved MD Anderson, J. Jack Lee. Korrespondansen dokumenterer i detalj hvordanJon Sudbø klarte å lage den fabrikkerte datafilen som ligger til grunn for Lancet-artikkelen.Kommunikasjonen mellom Sudbø og Lee per e-post med vedlagte datafiler, viser hvordan JonSudbø først har sendt over en fiktiv datafil til J. Jack Lee.Kommisjonen skal ikke her gå i detalj, men vil fremheve at det gjennomgående trekk ikorrespondansen er at J. Jack Lee påpeker feil, mangler og inkonsistente forhold ved tilsendt fil.Deretter gjør Jon Sudbø rede for hvordan han skal få rettet opp disse beklagelige feilene, somifølge Sudbø må bygge på misforståelser og andre uheldige omstendigheter. Ifølge Sudbøsredegjørelser per e-post overfor Lee, blir opprettingen av feil gjort i samarbeid med kvalifisertefagpersoner og institusjoner. I e-post av 29. januar 2005 heter det for eksempel:”I checked also with the health survey people, who scrambled on Saturday. The confirmed alcohol was nota selection criterion for the original search.”
I e-post av 29. mars 2005 skriver Jon Sudbø til Jack Lee:“Albrecht and I will be in meetings with CONOR (Cohort of Norway), the consortium which administersthe databases of the health surveys. We need to make sure we have documented all there is to documentregarding these surveys and how they are linked to other population based disease registries.”
Et annet eksempel hvor Sudbø demonstrerer sin vilje til å jobbe dag og natt med dette prosjektetog hans tilgang til ikke bare kompetente fagpersoner, men også registrene i Norge, er i maildatert 6. juni 2005, hvor han skriver til Scott Lippman, J. Jack Lee og Andrew Dannenberg:“Please find attached clean copies of the NSAID paper, cover letter and responses. Jon Mork and I spentmost of the weekend at the Cancer registry, checking the number of cases with cancers in differentlocations of the oral cavity. We have also had a meeting to go over the final draftsof the paper, responses and cover letter.”
101
I e-post av 30. september 2005 heter det:“Tonight, I have gone through and discussed the commentators viewpoints and the responses from Jack,with epidemiologists at the Cancer Registry. They ([N.N.], lead epidemiologist on Jon Morks 2001 NEJMpaper, and [N.N.] also epidemiologist at the Cancer Registry and on the Mork 2001 paper) found theresponses to the point, and well placed. In other circumstances, this should get us on dry land with respectto acceptance.”
Det skal bemerkes at kommisjonen mener det ikke er sannsynlig at disse møtene har funnet sted,og at verken Sudbø eller noen av de nevnte personene har hatt en slik tilgang til Kreftregisteretog slike opplysninger.Søknaden til NCI ble innvilget i mars 2004, og den samlede bevilgning var på ca. 70millioner kroner. Prosjektet er imidlertid i hovedsak et amerikansk prosjekt ledet av ScottLippman ved MD Anderson. Jon Sudbøs PROTOCOL-prosjekt fikk bare en mindre del av dennebevilgningen. Ifølge Sudbø skulle til sammen minst 16,5 millioner kroner overføres tilRadiumhospitalet i løpet av en fem års periode. Han viser til at det norske prosjektet var ett avfire prosjekter som inngikk i den samlede søknaden (et såkalt Program Project Grant).Sommeren og høsten 2004 ble PROTOCOL-studien søkt godkjent av Regional komitéfor medisinsk forskningsetikk Sør-Norge (REK-Sør) og Datatilsynet. Studien ble godkjenthenholdsvis 13. august 2004 og 19. oktober 2004.PROTOCOL-studien ble åpnet for inklusjon av pasienter i desember 2005. Da det blekjent gjennom media at Lancet-artikkelen trolig bygget på fabrikkerte forskningsdata, ble dennestudien stanset på ubestemt tid. Ingen pasienter hadde da blitt randomisert (inkludert) i studien,men fem pasienter hadde gjennomgått innledende intervjuer. Én pasient hadde ifølge Sudbø,gjennomgått en kirurgisk biopsi for vurdering med tanke på randomisering i studien.Kommisjonen har gjennomgått NCI-søknaden og det materialet som er levert av JonSudbø. Søknaden bygger på Sudbøs grunnlagsmateriale som dels består av fabrikkerte data. Deter ingen holdepunkter for at noen av samarbeidspartnerne visste om eller hadde mistanke omdette. I tillegg gir Jon Sudbø inntrykk av at han kan levere data og analyser, som det i det minstei ettertid er relativt klart at han ikke ville vært i stand til å levere. Han oppgir også å ha offentligetillatelser som er åpenbart fiktive. Kommisjonen viser i denne forbindelse særlig til søknaden s.130, som på en rekke vesentlige punkter fremstår som ren fiksjon [kommisjonens fortløpendekommentarer er satt i klammetegn]:
102
Accrual Infrastructure, FeasibilityProject 1 leader Dr. Sudbo and Core C Co-Leader Dr. Reith built over a 10-year period the infrastructurethat will support clinical Project 1 and its translational interactions with PO1 colleagues at M.D. Andersonand Weill Medical College of Cornell University (Dr. Dannenberg).•1993-4: Access to biopsy specimens from all Norwegian pathological departments approved bythe Norwegian Cancer Registry (Kreftregisteret), Norwegian Data Protection Agency(Datatilsynet), Norwegian Departement of Health and Social Security (Sosial- oghelsedepartementet). [Dette fremstår i det alt vesentlige som ren fiksjon, jf. punkt 4.2.]•May 1995: Access to Norwegian Cancer-Registry data for evaluating follow-up of 150 patientswith oral white patches. [Datoen skulle vært primo 1996, og materialet det vises til er delvismanipulert og fabrikkert, jf. punkt 4.2.7].••...January 1997: Access to this information granted by the Regional Ethical Committee (RegionalEtisk Komité), Norwegian Data Protection Agency (Datatilsynet), and the Internal Advisory Boardat the Norwegian Radium Hospital (NRH). [Alt dette er uriktig, jf. 4.2.4]•January 1998: Permission from the Norwegian Data Protection Agency (Datatilsynet) to dotelephone interviews to get additional epidemiological information regarding smoking and alcoholhabits and comorbidity from persons in the study. [Uriktig, jf. 4.2.4]••...February 2003: Epidemiological data on NSAID effects obtained from The Norwegian CancerRegistry and National Health Survey Project. [Dette er ren fiksjon.]
Herunder skal det bemerkes at Jon Sudbø i søknaden demonstrerer at han har full oversikt overde formelle prosedyrer som omgir denne typen medisinske forskningsprosjekter.Etter hvert som grunnlagsdataene tok form gjennom samspillet med en tydeligvisintetanende J. Jack Lee, begynte Jon Sudbø arbeidet med artikkelen som senere ble publisert ithe Lancet. Et utkast til artikkelen ble først sendt til New England Journal of Medicine, men derble den refusert to ganger. Kommisjonen har ikke fått tilgang til referee-uttalelsene.Artikkelen ble altså til slutt publisert i The Lancet i oktober 2005, etter å ha gjennomgåttet såkalt fast-track referee-system. Det er verdt å merke seg at en av fagfellene som bedømteartikkelen, var svært negativ til publisering av artikkelen.I en powerpoint presentasjon ved Dr. Ernest Hawk fra National Cancer Institute i USAfra en FDA-høring i midten av februar 2005 finnes hovedresultatene som senere ble publisert iLancet-artikkelen.44Den 7. april 2005 advarte amerikanske helsemyndigheter (FDA) mot kardiovaskulærebivirkninger av ikke selektive NSAIDs. Europeiske helsemyndigheter var mer tilbakeholdende,og kommisjonen kjenner ikke til at det er gjort endringer i retningslinjene. I henhold til pressen44
www.fda.gov
103
prioriterer det norske Statens Legemiddelverk saken, men det er så vidt kommisjonen bekjentikke gjort endringer i norske retningslinjer.Den 7. april rapporterte Aftenposten over halve førstesiden at Ibux (ibuprofen) kunneføre til hjertesykdom. Den 3. mai skal Jon Sudbø ha uttalt til Adresseavisen at han ”måttetrippelsjekke dataene fordi at han ikke kunne tro det stemte. Men de holder vann”45Jon Sudbøstiller seg uforstående til denne pressedekningen.
5.4
Spørsmål reises rundt ploiditetsklassifikasjonene
Sommeren 2005 ble Jon Sudbø kontaktet av Bjørn Risberg som ønsket å bruke detgrunnlagsmaterialet som lå til grunn for Jon Sudbøs doktorgradsarbeid i en annen studie. I denforbindelse gjentok Risberg deler av ploiditetsklassifikasjonene. Det viste seg at disse på ingenmåte stemte med de klassifikasjoner som Sudbø har lagt til grunn i sitt arbeide. Dette påpekteRisberg sammen med Eva Sigstad overfor Sudbø i brev datert 3. august 2005, samtidig som deba om å få utlevert det datamaterialet som ligger til grunn. I brevet heter det:”Vi har nå gjort opp resultatene fra vår automatiske måling av din tidligere M41-studie (påmunnslimhinnebiopsier), og sammenlignet med resultatene som dere kom frem til ved automatisk måling.Resultatene er som følger:ManuellDiploidTetraploidAneuploidUegnet/intet blokknr.Totalt2915132481Automatisk36147248125Samme ploidiresultat1861
Det er stor diskrepans mellom resultatene. Årsaken til dette kan være flere:1.2.3.Feil gjengivelse av dataene i databasene.Målefeil; degenerert (”gammelt”) materiale ved den automatiske målingenMetodeforskjeller mellom manuell og automatisk.
Det er helt nødvendig å finne årsaken til diskrepansen. Videre automatiske målinger vil ellers være utenverdi. Vi vil gjerne høre dine synspunkter på denne problemstilling.”
Til dette vil kommisjonen bemerke at Risberg og Sigstads målinger harmonerer medkommisjonens tidligere funn under punkt 4.2.7, i den forstand at Sudøs målinger ikke stemmernår de etterprøves. Risberg og Sigstads brev er slik kommisjonen ser det slående, ved at detpåvises et sammenfall på kun 25 av 81 målinger. Det er klart at dette var en meget alvorlig ogdramatisk beskyldning rettet mot en forskerkollega, til tross for den nøytrale ordlyden i brevet. I45
http://www.adressa.no/nyheter/sortrondelag/article499549.ece
104
kommisjonens samtale med Risberg kom det frem at man ved å gå nærmere inn igrunnlagsmaterialet for ploiditetsanalysene, kom frem til at det var akseptabel overensstemmelsemellom de automatiske og manuelle målingene (som var det opprinnelige formålet med Risbergsundersøkelse) og at uoverensstemmelsen eventuelt måtte forklares med ombytting avpasientidentifikasjon. Dette siste ble aldri avklart ifølge Risberg.Sudbø forsøkte ifølge Risberg å bortforklare det hele, og sa at han skulle ordne opp, mendette skjedde aldri. Risberg tok dette opp med avdelingsleder Jahn Nesland, uten at det kom noeut av det. Radiumhospitalet var på denne tiden opptatt med en meget krevende fusjon medRikshospitalet.Jon Sudbø bestrider denne fremstillingen, og gjør gjeldende at det var en samletvurdering fra ham selv, Risberg og Reith som ledet til re-klassifiseringen. Kommisjonen festerikke lit til Sudbøs forklaring på dette punkt. Også Reith har bekreftet at det, da Risberg ønsket åreklassifisere materialet, viste seg vanskelig å få materialet fra Sudbø. Etter flere purringerforeslo Reith at Risberg skulle skrive et brev til Sudbø for å få ham til å prioritere fremskaffelsenav materialet. Reith fikk også til slutt avtalt et møte med Sudbø, som Sudbø likevel ikke møttetil. Brevet fra Risberg og Sigstad av 3. august 2005 har vært ukjent for Reith før saken bleavdekket i 2006.Når det gjelder valg og involvering av medforfattere til arbeider som er produsert i ensenere fase, hvor Sudbø har vært mer etablert som selvstendig forsker, er det, som i den førstefasen, karakteristisk at disse har hatt marginal kjennskap til grunnlagsmaterialet. Samtidig harSudbø omgitt seg med tilstrekkelig antall personer til at hans prosjekt fremstår som legitimt. Detfremstår for kommisjonen som om medforfatterne i stor grad er brukt for å legitimere det Sudbøhar gjort. Det er også betegnende at medforfatterne har hatt liten eller ingen kontakt seg imellom; det er Jon Sudbø som har hatt full kontroll over hva den enkelte har visst, og hva denenkelte har hatt tilgang til. I flere tilfeller har medforfattere ikke sett det endelige utkast tilartikler, og mange av forfatterne har vært svært lite involvert i skrivingen av selve manuskriptet.
5.5
Eksterne forhold
Kommisjonen har i samsvar med mandatet undersøkt og vurdert om eksterne årsaker kan ha værtmedvirkende til bruddene på god vitenskapelig praksis som har blitt avdekket. Det kan være taleom forskjellige årsaker, som for eksempel forholdet til eksterne samarbeidendeforskningsinstitusjoner, herunder farmasøytisk industri.Kommisjonen har vurdert slike forhold, men har ikke funnet holdepunkter for at eksterneforhold av denne karakter har vært medvirkende faktorer til bruddene på god vitenskapeligpraksis. Kommisjonen har heller ikke avdekket faktiske forhold som har gitt foranledning til å105
iverksette mer omfattende og utdypende undersøkelser på dette punkt. Kommisjonen finner detfor eksempel ikke sannsynlig at Jon Sudbø har produsert forskningsdata og – resultater påoppdrag fra farmasøytisk industri.Kommisjonen kan imidlertid ikke se helt bort fra som en mulig årsak at Jon Sudbø kan havært drevet av et ønske om å tilfredsstille uttalte eller uuttalte behov, ønsker eller lignende frainternasjonale samarbeidspartnere, herunder legemiddelindustrien, med påfølgende ære oganerkjennelse, samt økonomisk støtte til nye forskningsprosjekter. Kommisjonen kan ikkeutelukke at interesser av denne karakter i noen grad kan være en forklaring (motiverende faktor)på bakgrunnen for NSAID-funnene, altså de kardiovaskulære resultatene i Lancet-artikkelen.Dette var resultater som var oppsiktsvekkende og potensielt nyttige for flere internasjonalehovedaktører innen legemiddelutvikling og produksjon.Det er dessuten grunn til å poengtere at den typen uredelighet som gjør seg gjeldende i blantannet NCI-søknaden og Lancet-artikkelen er mulig nettopp fordi man samarbeidet med eksterneinstitusjoner som ikke hadde tilstrekkelig kjennskap til norske forhold.
5.6
Mangler i regelverk og lignende formelle kontrollformer
De grove bruddene på god vitenskapelig praksis som er avdekket i denne saken, er i det altvesentlige brudd på grunnleggende og klare regler som har eksistert lenge. Forbudet motutilbørlig manipulering og fabrikkering av forskningsdata, er regler som alle forskere må antas åkjenne godt. Kommisjonen kan dermed ikke se at de avdekkede forhold skyldes mangelen påregler.På den annen side har kommisjonen avdekket en rekke mindre forseelser, som i sum harbidratt til et system hvor bruddene på god vitenskapelig praksis har kunnet vokse frem uten å bliavdekket tidligere. Men heller ikke her synes det etter kommisjonens oppfatning å væremangelen på regler som er problemet, men heller den enkelte forsker og institusjons kjennskaptil og praktisering av de regler som vitterlig eksisterer. Som eksempel viser kommisjonen her tilat doktorgradsprosjektet burde ha vært framlagt for Regional komité for medisinskforskningsetikk, Datatilsynet og Statens helsetilsyn (I dag: Sosial- og helsedirektoratet), og atdette er forhold som ingen har reagert på, verken medforfattere, veileder(e) eller ledelsen vedinstitusjonen, ei heller de som sto ansvarlig for godkjenning av doktorgraden.Kommisjonens funn på dette punkt harmonerer med tre utredninger knyttet til reguleringav medisinsk forskning:I sin avsluttende rapport fra 2001 uttalte det daværende nasjonale Uredelighetsutvalgetfor medisinsk og helsefaglig forskning at det var viktig å ha klare regler for god vitenskapeligpraksis. Det ble derfor utarbeidet en veiledning for gjennomføring av prosjekter i medisinsk og106
helsefaglig forskning. Utvalget var opptatt av at tematikken skulle innarbeides i denobligatoriske delen av forskerutdanningen, men mente at det er like viktig at det utvikles et miljøfor livslang læring innen forskningsetikk og god forskningspraksis. Utvalget understreket atansvaret må ligge hos utdanningsinstitusjonene og forskningsmiljøene selv, men at det trengs etsentralt initiativ for å få prosessen i gang.Dette harmonerer videre med Nylenna-utvalgets utredning fra 2005 om reguleringen avmedisinsk og helsefaglig forskning.46Nylenna-utvalget fant at det ikke først og fremst varmangelen på regler som var problemet, selv om enkelte mangler fantes. Hovedproblemet var,slik utvalget så det, at reglene var fragmenterte, kompliserte og utilgjengelige, og at få haddeoversikt over regelverket. Forenkling og klargjøring av regelverket og byråkratiet, samt enklarere ansvarliggjøring av forskningsinstitusjonene, var Nylenna-utvalgets hovedanbefalinger tiltiltak.Denne innfallsvinkelen er også vektlagt forarbeidene til forskningsetikkloven.Kommisjonens oppfatning er altså at de avdekkede forhold ikke primært knytter seg til enmangel på regler, men at det heller har skortet på tiltak for å forebygge brudd på godvitenskapelig praksis gjennom implementering av enkle og effektive rutiner. Sistnevnte er førstog fremst et institusjonelt ansvar. Kommisjonen har da også merket seg at det de siste årene harvært en tiltakende oppmerksomhet rundt disse forholdene ved flere forskningsinstitusjoner, blantannet ved Rikshospitalet - Radiumhospitalet HF, som har i gangsatt en rekke tiltak for å rettledeforskere.47
NOU 2005:1 God forskning – bedre helse. Lov om medisinsk og helsefaglig forskning som involverermennesker, humant biologisk materiale og helseopplysninger (helseforskningsloven).47Sewww.klinforsk.no.For Aker universitetssykehus, sewww.forskningsjus.no,og for Ullevål universitetssykehusse http://www.ulleval.no/modules/module_123/news_template_avdeling.asp?iCategoryId=664
46
107
66.1
Mulige konsekvenser
Betraktninger om konsekvenser for forskningen
Fabrikkering av forskningsdata regnes blant de mest alvorlige former for uredelighet i forskning.Når slikt skjer, bidrar det til at samfunnets tillit til forskning generelt svekkes. For medisinsk oghelsefaglig forskning kan denne tvilen om tillit også få følger for tilliten til helsetjenestene mergenerelt. Tvilen kan skape utrygghet og bekymring i befolkningen. Forskersamfunnet er sværtavhengig av samfunnets tillit, både for å sikre politisk vilje til å bruke offentlige budsjettmidlertil forskningsfinansiering, og av hensyn til befolkningens villighet til å delta i ulikeforskningsprosjekter.De nordiske landene har tradisjonelt hatt et positivt renommé innenfor så vel klinisk somepidemiologisk forskning. Med utgangspunkt i disse landenes helse- og sykdomsregistre, samtmuligheten for koplinger til fullstendige folkeregistre med entydige identifikasjonsmuligheter,har de nordiske landene tradisjonelt vært ettertraktede samarbeidspartnere i forskningsprosjekter.For små land er denne type forskningssamarbeid ofte av avgjørende betydning for å delta i deninternasjonale forskningsfronten. Oppdagelse av uredelighet i tilknytning til bruk av disseregistrene kan svekke det globale forskersamfunnets interesse for å samarbeide med nordiskeforskere.Forskningen er i sin natur sannhetssøkende og kritisk, og har en viktig oppgave i å stillespørsmål ved ”etablerte” sannheter. Likeledes påhviler det forskersamfunnet til enhver tid å sikreat forskningsaktivitetene skjer innenfor etiske og redelige normer. Når det avdekkes uredeligfremferd, gir den økte fokuseringen på normer og yrkesetisk praksis mulighet for fornyetdiskusjon om oppfølgingen innenfor alle ledd i forskningen. Denne saken blir en ”vekker” somkan bidra til skjerpet oppmerksomhet på forebygging av uredelighet. Selv om det foreliggerregler og retningslinjer for etisk og redelig forskeratferd, er det behov for kontinuerlig fokuseringav disse spørsmål, ikke minst i forskerutdanningen.Det er for kommisjonen vanskelig å ha klare oppfatninger av om denne saken spesifiktkommer til å skade omdømmet til Rikshospitalet Radiumhospitalet HF og Universitetet i Oslo,men institusjonenes navn, især førstnevnte, vil uvegerlig være forbundet med Jon Sudbø. Det viltrolig være nødvendig å sette av ressurser for å vise økt åpenhet om praktisering av retningslinjerog kvalitetssikringsrutiner for å gjenreise og opprettholde tilliten. Et forsøk på å bortforklare detsom har skjedd vil lett kunne virke mot sin hensikt når det gjelder å gjenvinne befolkningen ogmyndighetenes tillit. Folk flest forstår og aksepterer at feil og forsømmelser av og til kanforekomme.108
6.2
Mulige skadelige konsekvenser for pasientbehandling mv.
Resultater fra studiene er trolig brukt videre av mange andre forskere i sine arbeider. Når de funndet er henvist til er basert på uriktige og misvisende datagrunnlag, har dette i beste fall medførtmye bortkastet arbeid og ressurser.Mange av publikasjonene omhandler bruk av diagnostiske metoder til å påvise kreft imunnhulen og til å drøfte prognoser for behandling i forhold til diagnosetidspunkt. Dette kan hakonsekvenser for oppfølging og behandling av pasienter. Kommisjonen har ikke sett det som sinoppgave å avdekke konkrete skadevirkninger. Kommisjonen er kjent med at dette vil være ettema for Helsetilsynets egen granskning.Kommisjonen er imidlertid kjent med at resultatene er benyttet i diskusjoner om verdien avlegemidler, også som dokumentasjon i diskusjon om tilbaketrekning av legemidler. Også her vilresultatene av Sudbøs forskning kunne ha hatt negative konsekvenser både for pasientbehandlingog for legemiddelbruk og -omsetning. Kommisjonen har videre registrert at det i mediarapporteres at Sudbøs forskningsresultater har innvirket på diagnostikk og behandling av enkeltpersoner med hvite flekker i munnhulen i Tyskland, Storbritannia og USA. Videre rapporteresdet i norske medier at enkeltpasienter har unnlatt å ta smertestillende tabletter, og heller valgt åleve med smerter, fordi det av Lancet-artikkelen fremgår at tablettene medførte forhøyet risikofor hjerte- og karsykdommer etc.Dette er klart nok meget alvorlige forhold, og denne nærliggende faren for villeding avpasienter, helsepersonell og forskere med påfølgende ulempe og skadevirkninger, må ha værtåpenbar for Jon Sudbø.
109
7 Kritikkverdige forhold7.1Innledende bemerkninger
I tråd med mandatet vil kommisjonen i dette kapitlet foreta en oppsummering av det den finnerer kritikkverdige forhold. For nærmere beskrivelse av fakta og kommisjonens vurderinger av JonSudbøs forskning, vises det til kapittel 4 til 6. De kritikkverdige forholdene kommisjonen haravdekket, knytter seg dels til fysiske personer og dels til institusjoner.Kommisjonens granskning innebar at 60 forfattere av vitenskapelige publikasjoner ogflere ansatte ved institusjoner i realiteten har vært undergitt granskning. I forhold tilenkeltpersoner har kommisjonen, i tråd med det som er sagt i kapittel 2, lagt nivået for hvilkeforhold som skal gi grunnlag for personkritikk relativt høyt, det vil sigrove og alvorlig brudd pågod forskningsskikk voldt uaktsomt eller forsettlig.Kommisjonen har ikke funnet noen holdepunkter for at andre enn Jon Sudbø harmedvirket til fabrikasjon av data eller begått lignede grove og alvorlige regelbrudd forsettlig ellergrovt uaktsomt. Sudbøs veileder og viktigste samarbeidspartner, Albrecht Reith, må imidlertidtåle en viss kritikk for manglende aktsomhet.At nivået for personkritikk er lagt så vidt høyt, innebærer at få personer blir utsatt fordirekte kritikk fra kommisjonens side. Granskningen har avdekket flere mindre grove ogalvorlige tilfeller av manglende etterlevelse av forfatterskapskriterier og omgang medpasientdata i strid med regelverket, som i og for seg kunne foranlediget kritikk mot flere. Somnevnt i kapittel 2 ville imidlertid en slik granskning av mindre grove forhold blittuforholdsmessig krevende. Mindre grove avvik er også alvorlige for forskningen, særlig om manser disse i sammenheng (kollektive og kumulative feil). De er en trussel mot kvaliteten påforskningen og mot befolkningens tillit til forskning. På den bakgrunn har kommisjonen valgt åpåpeke mindre grove, men like fullt alvorlige kritikkverdige forhold, på mer generelt grunnlag,uten at enkeltpersoner nevnes med navn. Som redegjort for innledningsvis har kommisjonenvalgt å konsentrere granskningen omgrovebrudd på god forskningsskikk, og har derfor ikketilstrekkelig grunnlag for å navngi enkeltpersoner når det gjelder mindre alvorlige, men like fulltkritikkverdige forhold. Dessuten er det tale om feil som synes å ha vært av en viss allmennutbredelse, dvs. at kritikken går mer på systemnivå enn enkeltindividnivå, ved at avvikene til enviss grad må ha vært kjent for og dermed tilsynelatende akseptert av ledelsen. Kommisjonen erav den oppfatning at en identifisering av enkeltindivider i en slik situasjon lett vil kunne gi etskjevt inntrykk. Slik kommisjonen ser det, er det institusjonenes oppgave å besørge forsvarligopplæring, organisering og tilsyn med institusjonens virksomhet, inkludert110
forskningsvirksomheten. Et ubetinget krav må være at lover, forskrifter og arbeidsinstruksergjøres kjent blant de ansatte og at det føres en viss jevnlig kontroll med at reglene faktisketterleves. Slik kommisjonen ser det, er det her tale om enkle tiltak, som for ledelsen er litekostnadskrevende og for forskerne lite inngripende. Det skal her bemerkes at det later til at dethar funnet sted en klar forbedring av disse forholdene de siste årene. Kommisjonen vil fremmemer konkrete forslag til utviklingstiltak i kapittel 8.Når det gjelder kritikk mot institusjoner er således nivået for kritiske merknader lagtbetydelig lavere, både i forhold til grovhet og sannsynliggjøring. Når det gjelder”systemkritikken” har kommisjonen valgt å gi uttrykk for en oppfatning vi sitter igjen med, selvom inntrykkene bygger på et ufullstendig og dermed mer usikkert, grunnlag. Oppdragsgivernehar, i motsetning til enkeltpersonene, heller ikke fått anledning til å imøtegå denne kritikken.Kommisjonen vil likevel påpeke enkelte systematiske feil og mangler, fordiforskningsinstitusjoner, og ikke bare de som direkte er involvert, trolig har en del å lære avdenne saken og de forhold som er avdekket i kjølvannet av den.Det er kommisjonens håp at den institusjonelle kritikken blir oppfattet som konstruktiveforbedringstiltak som kan bedre kvaliteten på og tilliten til forskningen på langt sikt.
7.2
Kritikk av enkeltpersoner
7.2.1 Jon SudbøPå grunnlag av det faktum kommisjonen har lagt til grunn og redegjort for i kapittel 4 ogvurderinger som redegjort for i kapittel 5 og 6, finner kommisjonen at Jon Sudbø har begått enrekke regelbrudd. De fleste av disse er begått forsettlig eller grovt uaktsomt, og gir utvilsomtgrunnlag for kritikk og betegnelsen vitenskapelig uredelighet. Regelbruddene må ses isammenheng. De har skjedd systematisk fra slutten av 1990-tallet og frem til uredeligheten bleavslørt i januar 2006.Sudbø har, som redegjort for i punkt 2.4.5, fått lese blant annet to rapportutkast medvedlagt dokumentasjon. Han kom med en rekke innspill til det første utkastet, men avsto fra åkommentere det reviderte utkastet som han deretter fikk tilsendt. Sudbøs innspill harkommisjonen vurdert og tatt hensyn til i den grad kommisjonen har funnet grunnlag for det.Bortsett fra et erkjent forhold av fabrikasjon av grunnlagsmateriale i forbindelse med Lancet-artikkelen, og noen mindre innrømmelser i forhold til to andre artikler, stiller Sudbø seg i det altvesentlige uforstående til det forhold at kommisjonens har lagt til grunn at omfanget avvitenskapelig uredelighet er langt mer omfattende.Oppsummeringsvis dreier det seg om følgende forhold:111
•
Manipulasjon og fabrikasjon av data som ligger til grunn for doktorgradsavhandlingen ogsom ligger til grunn for 13 vitenskapelige publikasjoner, som nå må trekkes tilbake, sepunkt 4.2 - 4.4.
•••
Manipulasjon og fabrikasjon av data som ligger til grunn for en artikkel i Journal ofClinical Oncology 2005, se punkt 4.4.Manipulasjon og fabrikasjon av data som ligger til grunn for en artikkel i The Lancet i2005, se punkt 4.4.Manglende overholdelse av fremleggelsesplikt overfor Regional Etisk Komité ogkonsesjon fra Datatilsynet. Urettmessig omgang med og innsyn i sensitive pasientdata,dvs. manglende deltakersamtykke og/eller dispensasjon fra taushetsplikt fra Statenshelsetilsyn (I dag: Sosial- og helsedirektoratet)., se punkt 4.2.4.
•
Åpenbar feilinformasjon og misledende informasjon i publikasjoner. For eksempelhevdes det at den histologiske klassifikasjon ble foretatt av fire uavhengige patologer, atploiditetsanalysen ble foretatt av fire observatører, at pasienter har vært innrullert i etårlig systematisert oppfølgningsprosjekt, at pasienter inngikk irøykeavvenningsprosjekter og lignende, se spesielt punkt 4.2.
•••
Bevisst villedelse i forbindelse søknad om økonomisk støtte fra National Cancer Institute(NCI), se spesielt punkt 5.3.Brudd på god vitenskapelig skikk for inkludering og ekskludering av forfattere tilpublikasjoner. Medforfattere har blitt misbrukt og villedet, se spesielt punkt 5.2 og 5.3.Villedning av sponsorer og arbeidsgiver og andre som har ytt økonomisk støtte til JonSudbø og hans forskning, herunder spesielt Kreftforeningen, Helse- og Rehabilitering ogRadiumhospitalet, se kapittel 4 til 6.
•
Villedning av egen doktorgradsstipendiat som fikk tildelt datamateriale som dels byggetpå fabrikkerte data fra sin hovedveileder, Jon Sudbø. Konsekvensen er at stipendiaten harbrukt flere år på et prosjekt som nylig ble avsluttet, men som nå må trekkes tilbakeStipendiaten er trolig satt tilbake i minst to år i forhold til mulig disputas, se spesieltpunkt 4.2.
••
Skade på forskningens omdømme. Kommisjonen viser her til den faren for skade denuredelige virksomheten har hatt på tilliten til forskning generelt, se punkt 6.1.Fare for pasientsikkerhet. Uredelighet i forbindelse med denne typen medisinsk forskninger spesielt alvorlig fordi den medfører en nærliggende fare for at de ugyldigeforskningsresultatene vil villede pasienter, helsepersonell og forskere. Denne risikoen måha vært åpenbar for Jon Sudbø. Selv om kommisjonen ikke har ansett det som sinoppgave å forfølge dette, er det rimelig å anta at den uredelige forskningen har hatt112
uheldige og skadelige konsekvenser for diagnostisering og behandling av enkeltpasienter,se nærmere punkt 6.2.
7.2.2 Albrecht ReithKommisjonen har funnet grunnlag for å rette kritikk mot professor dr.med. Albrecht Reith vedRikshospitalet - Radiumhospitalet HF for enkelte forhold. Dette har først og fremst sammenhengmed Reiths rolle som Jon Sudbøs doktorgradsveileder og senere fremste samarbeidspartner. Slikkommisjonen ser det, har en veileder i sin alminnelighet ansvar for å veilede og føre tilsyn medsin stipendiat. Kommisjonen har kommet til at Reith til en viss grad har sviktet som veileder vedmangelfull oppfølging. Dette har vært en medvirkende årsak til at Jon Sudbø har kunnet opptre istrid med god vitenskapelig praksis.Kommisjonen har ikke funnet grunnlag for å si at disse feilene er voldt forsettlig ellergrovt uaktsomt, eller at han har gjort seg skyldig i såkalt vitenskapelig uredelighet.Kommisjonen har funnet det godtgjort at Reith i enkelte tilfeller burde handlet annerledes, og athan er å bebreide for at han ikke gjorde det. Det er dermed tale om simpel uaktsomhet. Det latertil at Reith har hatt en grenseløs tillit til Sudbø. Kommisjonen finner grunn til å bemerke at Reithhar vært meget samarbeidsvillig i forbindelse med granskningen.Reith har fått lese to utkast til rapporten og kommet med bemerkninger til enkeltefaktiske forhold. Disse innspillene har kommisjonen vurdert og tatt hensyn til i den gradkommisjonen har funnet grunnlag for det. Reith har ikke reist innvendinger mot den fremsattekritikk.Kommisjonen vil oppsummeringsvis særlig fremheve følgende forhold som kritikkverdige:•Mangelfull veiledning og aktsomhet i forhold til innhenting av nødvendigeforhåndsvurderinger og tillatelser fra Regional komité for medisinsk forskningsetikk,Datatilsynet og Statens helsetilsyn (I dag: Sosial- og helsedirektoratet).••Mangelfull veiledning og aktsomhet i forhold til omgang med taushetsbelagtepasientopplysninger.Mangelfull veiledning og aktsomhet i forhold til praktisering av alminnelige prinsipperfor forfatterskap. Her vises det til at flere forfattere tok opp Jon Sudbøs uvanlige ogurettmessige praktisering av forfatterskap direkte med Reith, uten at Reith tilsynelatendefant grunn til å følge opp og korrigere denne praksisen. Tvert i mot er det kommisjonensinntrykk at Reith har beskyttet Sudbø og hindret videre utredning av beskyldinger omuakseptabel praksis.•Manglende aktsomhet ved flere publikasjoner, hvor en rekke feil fremkommer. Somhovedveileder og sisteforfatter burde Reith ha reagert på i hvert fall enkelte av disse113
feilene. Det dreier seg bl.a. om angivelsen av at fire uavhengige patologer haddereklassifisert hele grunnlagsmaterialet for munnhulekreftprosjektet, og at fire uavhengigeobservatører hadde vurdert ploiditetsanalysene.
7.3
Kritikk av institusjoner
7.3.1 Rikshospitalet - Radiumhospitalet HFKommisjonen har funnet grunnlag for å rette kritikk mot Rikshospitalet Radiumhospitalet HFved dets daglige ledelse for en rekke forhold. Kommisjonen har lagt til grunn at Sudbø i hele sinvitenskapelige karriere primært har vært tilknyttet Radiumhospitalet, og som dermed har hatt detdaglige overordende ansvaret for hans forskning, som er utført i regi av Radiumhospitalet, jf.punkt 4.2. Det bemerkes at før 1. januar 2002 var Staten ved Helsedepartementet ansvarlig forRadiumhospitalet. Fra og med 1. januar 2002 ble Radiumhospitalet et eget helseforetak ogdermed eget rettssubjekt. Fra og med 1. januar 2005 ble Rikshospitalet HF og RadiumhospitaletHF fusjonert til ett helsefortak og rettssubjekt - Rikshospitalet – Radiumhospitalet HF.Helseforetaket har ikke fått anledning til å imøtegå denne kritikken, jf. punkt 2.4.6.Kommisjonen understreker innledningsvis at denne kritikken ikke bygger på omfattendeundersøkelser av ledelsen, men heller på mer eller mindre klare inntrykk som kommisjonen sitterigjen med etter granskningen av en konkret personalsak. Kommisjonen finner det likevel riktig ågi uttrykk for disse inntrykkene.Når en forskningsinstitusjon, som sykehuset er, legger forholdene til rette for forskningved sin institusjon, må den være beredt til å bære det hele og fulle ansvar for den enkelte forskerog det aktuelle forskningsprosjektet, uavhengig av om andre også har et selvstendig ansvar.Pasienter og andre som forholder seg til sykehuset, herunder samarbeidende institusjoner, måkunne legge til grunn at forskere ved sykehuset opererer på vegne av det aktuelle sykehuset, ogat sykehuset har det overordende ansvaret.Helseforetaket må således tåle kritikk for det som fremstår som mangelfull opplæring,styring og kontroll med Jon Sudbø og andre ansattes forskningsvirksomhet ved institusjonen.Dette har trolig vært en medvirkende årsak til at den uredelige forskningen kunne finne sted ogforegå over så vidt langt tid.Flere forskere ved institusjonen har beskrevet situasjoner fra tidligere perioder som forkommisjonene indikerer en urovekkende manglende oppmerksomhet overfor gjeldende reglerfor god forskningsskikk. Dette gjelder spesielt regler om taushetsplikt, personvern, forfatterskapog forhåndsvurdering av forskningsprosjekter, som er de reglene som har vært særlig aktuelle idenne saken. Videre har ansvarsforholdene ved institusjonens forskning vært uklar, og for mye114
av virksomheten har vært overlatt til den enkelte forsker. Uakseptable forhold som faktisk blepåpekt, og som kunne avslørt den uredelige forskningen, har ikke blitt fulgt opp og håndtert påen tilfredsstillende måte.Her skal det bemerkes at det ikke mangler på gode intensjoner og forsetter. Ledelsen harvært meget klare på eget ansvar og høye forventninger til egne ansatte. I samtaler medkommisjonen har ledelsen vist til interne arbeidsinstrukser og andre tiltak som for eksempel detsåkalte Protokollutvalget og et koordineringskontor for forskning, som er ment å bidra tilimplementering av regelverk og forbedret forskningspraksis. Ledelsen har også vært meget klarpå at de ansatte forventes å overholde alle lover, forskrifter og arbeidsinstrukser, herunder så velHelsinki-deklarasjonen som Vancouver-reglene. Kommisjonen sitter likevel igjen med etinntrykk av at disse tiltakene ikke har blitt fulgt godt nok opp. På den måten har det kunnetutvikle seg en holdning hos de ansatte om at det likevel ikke var så nøye med for eksempeltaushetsplikt, tilrådning fra Regional komité for medisinsk forskningsetikk og praktisering avforfatterskapskriteriene. Flere har overfor kommisjonen gitt uttrykk for at Vancouver-regleneikke er bindende for dem – de er bare veiledende, mens ledelsen har fremholdt at de klart nok erbindende for deres ansatte. Denne diskrepansen og uklarheten må ledelsen ta ansvaret for.Kommisjonen har et inntrykk av at forholdene har blitt/er i ferd med å bli bedre.Mangelfull lederoppfølging av forskningen var neppe et uvanlig fenomen ved enkelte norskeforskningsinstitusjoner for noen år tilbake. Forskere har tradisjonelt arbeidet meget fritt, bådeved universiteter og ved norske sykehus. Klinikere har blitt oppfordret til å drive forskning, mendet har trolig ikke vært tilstrekkelig bevissthet knyttet til de ulike rollene og de dels ulike kravsom stilles til disse, verken hos forskerne eller ledelsen. Mangelfulle og sviktende rutiner, ogmangelfullt system for å varsle om uregelmessigheter, har vært en uheldig kombinasjon forRadiumhospitalet. Det medisinske forskningsmiljøet er således inne i en endringsfase når detgjelder organisering og formalia rundt medisinsk forskning. Kommisjonen tror at denne konkretesaken har vært en vekker for så vel denne som andre forskningsinstitusjoner, og vil trolig bidratil å fremskynde denne utviklingsprosessen.Kommisjonen finner likefullt grunn til å fastholde kritikken mot Rikshospitalet -Radiumhospitalet HF. De kritikkverdige forholdene kan oppsummeres slik:••Manglende forhåndskontroll med og organisering av Sudbøs doktorgradsprosjekt,herunder angivelse av ansvarsforhold.Manglende opplæring og bevisstgjøring av Sudbø og andre ansatte om regler forhåndtering av pasientmateriale, forhåndsvurdering av forskningsprosjekter ogforfatterskap.
115
•
Mangelfull ledelse og rutiner for å avdekke og håndtere avvik fra interne instrukser medvidere.
7.3.2 Universitetet i Oslo – OdontologenKommisjonen finner grunn til å rette en viss kritikk mot Universitetet i Oslo ved Odontologiskfakultet for utleveringen av pasientmateriale og -data fra Odontologen, til Jon Sudbø og AlbrechtReith uten at det forelå deltakersamtykke eller dispensasjon fra taushetsplikten slik kravene varpå den tiden, jf. punkt 4.2.7, jf. 4.2.4. Utleveringen av data fremstår derfor som i strid meddagjeldende regelverk. Universitetet i Oslo har ikke fått anledning til å imøtegå denne kritikken,jf. punkt 2.4.6.Herunder bemerkes det at Jon Sudbø kun har vært ansatt i en 20 % stilling vedUniversitetet i Oslo fra 2. mai 2005 til primo 2006. Og at Universitetet i denne perioden har hattet mer sekundært overordnet ansvar for Jon Sudbøs forskningsvirksomhet, sammenlignet medRikshospitalet Radiumhospitalet HF.
7.3.3 Universitetet i Bergen – Gades instituttKommisjonen har funnet grunn til å rette en viss kritikk mot Universitetet i Bergen, vedAvdeling for patologi, ”Gades institutt”, for å ikke å ha forsikret seg om Jon Sudbø og AlbrechtReith hadde innhentet samtykke fra pasientene eller dispensasjon fra taushetsplikten da de fikkutlevert pasientmateriale og data, jf. punkt 4.2.7, jf. 4.2.4. Utleveringen av data fremstår derforsom i strid med dagjeldende regelverk. Universitetet i Bergen har ikke kommentertkommisjonens utkast til kritikk.
7.3.4 KreftregisteretKommisjonen vurderte hvorvidt det var grunnlag for å rette en viss kritikk mot Kreftregisteretfor å ikke å ha forsikret seg om Jon Sudbø og Albrecht Reith hadde innhentet samtykke frapasientene eller dispensasjon fra taushetsplikten da de fikk utlevert kreftregisterdata koblet tilsine pasientdata i 1996, jf. punkt 4.2.7, jf. 4.2.4. Av rammekonsesjonen av 9. desember 1985punkt 4.3 nr. 2, tredje strekpunkt, fremgår det at utlevering av opplysninger til forskningsformålvar betinget av iakttakelse av reglene om taushetsplikt, eventuelt etter dispensasjon. Noendispensasjon for den aktuelle utlevering er ikke gitt.Kreftregisteret ble varslet om at kommisjonen vurderte å gi uttrykk for en viss kritikk pådette grunnlag, og har benyttet seg av retten til å kommentere et tidligere utkast til rapport punkt7.3.4. Kreftregisteret har i brev til kommisjonen 20. juni 2006 anført at utkastet til kritikk erbasert på feilaktig oppfatning av Kreftregisterets forskjellige roller. Kreftregisteret hevder at deoppfattet Jon Sudbøs anmodning av 20. februar 1996 som en rutinemessig anmodning om116
oppfølgningsdata for pasienter ved Radiumhospitalet, Avdeling for patologi, som ikke krevdeforhåndstillatelser, som for eksempel dispensasjon fra taushetsplikt, se nærmere punkt 4.2.7.Kommisjonen har vurdert Kreftregisterets merknader, og sammenholdt dette med deopplysninger som gis i Jon Sudbøs brev av 20. februar 1996 til Kreftregisteret, sitert i punkt4.2.7, og andre opplysninger i saken. På den bakgrunn legger kommisjonen til grunn at detfremgår av brevet at det er tale om et forskningsprosjekt, noe Kreftregisteret burde ha forstått.Utleveringen av data fremstår dermed som i strid med konsesjonsvilkårene.
7.4
Generelle bemerkninger
Kommisjonen har som nevnt gransket samtlige 60 medforfattere. Kommisjonen har gjennomgåttden enkeltes rolle for spesielt å se om noen kan mistenkes for å ha vært med på fabrikkering avforskningsdata eller lignende grove brudd på god vitenskapelig praksis. Kommisjonen harkommet til at det ikke finnes holdepunkter for at noen andre enn Jon Sudbø forsettlig eller grovtuaktsomt har medvirket til fabrikasjon av data eller har begått lignende grove og alvorlige bruddpå god vitenskapelig praksis.Kommisjonen har blant annet av allmennpreventive årsaker likevel funnet grunnlag for åtrekke frem enkelte kritikkverdige forhold på mer generelt grunnlag.Kommisjonen stiller seg undrende til at de brudd på god vitenskapelig praksis som eravdekket, trolig har pågått over en så vidt lang periode uten at noen har oppdaget det.Kommisjonen har i kapittel 5 berørt hvordan dette kan ha skjedd. Jon Sudbø har tydeligvis hatthovedansvaret for de artikler hvor han er førsteforfatter. Han har hatt full kontroll overdatagrunnlaget og de analyser som er gjort. Han har videre hatt full kontroll over hvem som harvært medforfatter og hvem som ikke har vært det. Dermed har han kunnet fordelearbeidsoppgaver slik at de forskjellige bidragsytere/medforfattere ikke har hatt særlig innsikt i deøvrige bidragsyteres/medforfatteres faktiske oppgaver og bidrag. Medforfatterne har gjennomdenne fordelinger av arbeidsoppgaver blitt ført bak lyset ved at medforfattere bare har blittinvolvert i nokså begrenset grad. Samtidig har de vært involvert på en slik måte at de ”likevel”har akseptert forfatterskapet. Flere har riktignok uttrykt tvil om de burde vært med sommedforfatter, og tatt opp dette med Jon Sudbø og Albrecht Reith. Enkelte har til og med påpektat den medforfatterpraksis som Jon Sudbø fulgte var uakseptabel, og har gjort dette klart overforJon Sudbø og Albrecht Reith. De har da fått beskjed om at det synet er tatt til etterretning og atdet ikke skulle gjenta seg. Det ble likevel ikke noen bedring. Disse forfatterne har i stedet blittekskludert fra videre samarbeid.I ettertid er det klart at mange burde ha blitt mistenksomme, reagert kraftigere ogundersøkt forholdene nærmere. Herunder har trolig flere hatt foranledning til å varsle ledelsen117
ved institusjonen. Det er også flere i det medisinske miljøet som har vært mistenksomme ogskeptiske til Jon Sudbøs forskning og påpekt dette både overfor Jon Sudbø, Albrecht Reith ogledelsen ved Radiumhospitalet. Det har imidlertid ikke eksistert gode rutiner for varsling, ogkritikk mot Jon Sudbø har blitt avfeid, bortforklart og ”kokt bort”. Flere har også overforkommisjonen gitt uttrykk for at de ikke ønsket å komme i en varslingsposisjon, og at de av dengrunn avsto fra å gjøre nærmere undersøkelser. De hevder at det ville være en stor personligbelastning å komme i en varslingsposisjon, særlig når man sto overfor en forsker som hadde enslags status av å være miljøets ”gullgutt”.At kommisjonen ikke har valgt å foreta nærmere og mer inngående granskning avenkeltpersoner for mindre grove brudd på god vitenskapelig praksis, er også begrunnet i atkommisjonen oppfatter at praktiseringen av forfatterskapskriterier neppe er unike for dennesaken.Flere medforfattere har blitt oppført uten at de har hatt kjennskap til dette. Enkelte avdisse har fått kjennskap til slike oppføringer etter publisering og tatt opp det uakseptable veddenne gjennomføringsmåten med Jon Sudbø, uten at det har fått konsekvenser. Disse forholdkunne og burde ha vært rapportert til ledelsen, og gitt ledelsen mulighet til å gripe inn på et merprinsipielt grunnlag. Et gjennomgående trekk synes å være at mange av medforfatterne har hattet relativt lite bevisst forhold til det ansvaret det innebærer å stå som medforfatter på envitenskapelig publikasjon. De har med andre ord tatt for lett på denne rollen og dette ansvaret.Media har viet stor oppmerksomhet rundt det forhold at Jon Sudbøs samboer, Wanja Kildal,og hans bror, Asle Sudbø, har vært medforfattere på flere publikasjoner. Kommisjonen vil av dengrunn avslutningsvis bemerke at de begge har samarbeidet med kommisjonen og bidratt til åopplyse saken. Hensett til det omfattende mediefokus, og derigjennom mistenkeliggjøring, somhar vært rettet mot disse, finner kommisjonen grunn til å understreke at granskningen ikke haravdekket holdepunkter for at noen av dem har gjort seg skyldig i eller medvirket til vitenskapeliguredelighet.
118
8 Anbefalinger8.1Institusjonene
Som redegjort for i kapittel 5 er kommisjonen av den oppfatning at de brudd på godvitenskapelig praksis som er avdekket, neppe kan forklares med mangel på forskningsetiskeregler og prinsipper. Ei heller kan de alene forklares gjennom en henvisning til en enkelt uredeligforsker. Her er det et samvirke av en rekke uheldige omstendigheter som har spilt inn.Kommisjonen har på denne bakgrunn valgt å fremheve forskningsmiljøets, og isærforskningsinstitusjonens, kollektive ansvar for å fremme redelig og etisk forsvarlig forskning avgod kvalitet.Kommisjonen anser det for å ligge utenfor dens mandat å komme med detaljerte forslagtil hvordan forbedringer av interne institusjonelle kontrollrutiner og organiseringen avforskningen skal gjennomføres. Kommisjonen vil likevel peke på noen forhold av mer generellkarakter, som vil kunne være effektive og relativt enkle å iverksette:
Institusjonell implementering av gjeldende regelverkForskningsinstitusjoner må i større grad bevisstgjøre alle forskere og veiledere om hvilkeregler som gjelder, og hvilket ansvar som knytter seg til brudd på regelverket.Det å sørge for at gjeldende lover og regler blir fulgt og håndhevet, er i stor grad etinstitusjonelt system- og ledelsesansvar, hvor det etter kommisjonens vurderingforeligger et klart potensial for forbedringer. For eksempel må den ansvarligeforskningsinstitusjon ha tilfredsstillende oversikt over og kontroll med alleforskningsprosjekter som foregår ved eller i regi av den, uten at det behøver å komme ikonflikt med den akademiske frihet. Behovet for forebyggende arbeid, ogforskningsinstitusjonenes ansvar for utvikling av miljøer som ivaretar livslang læringinnenfor forskningsetikk og god forskningspraksis understrekes også i forarbeidene tilden nylig vedtatte forskningsetikkloven (ikke i kraft). For eksempel kunne institusjonenevært tydeligere på om og i hvilken grad Vancouver-reglene er å anse som bindende forderes ansatte. Kommisjonen viser også her til de enkle, men gode råd som fins iVeiledning for gjennomføring av prosjekter i medisinsk og helsefaglig forskning(vedlegg5).
119
Datahåndtering og etisk vurdering av prosjekterSom et minimum bør institusjonene ha rutiner for å sikre at nødvendige tillatelser forforskning som involverer mennesker, humant biologisk materiale, personopplysningerog/eller dyr foreligger ved igangsetting av forskningsprosjekter. I tillegg bør for eksempeluniversitetene kreve dokumentasjon for at dette foreligger når doktorgradsavhandlingerblir innlevert.
Arkivering av forskningsdataForskningsinstitusjonene bør etablere ordninger som sikrer arkivering og oppbevaring avforskningsdata, slik f eks Forskningsrådet stiller krav om ved tildeling av midler.
Innholdet i veilederrollenInnholdet i veilederrollen må tydeliggjøres bedre, og veileder bør pålegges et tydeligereansvar når det gjelder å sikre forståelse av forskningsetiske forhold.
VarslingDet bør også legges bedre til rette for varsling av feil og mangler, for eksempel vedopprettelsen av et forskerombud, slik enkelte har foreslått.
8.2
Tidsskriftene
Denne saken har etter kommisjonens vurdering avdekket enkelte svakheter i de rutiner sompraktiseres i forbindelse med publisering av medisinske forskningsartikler. For å bidra til at detregelverket som eksisterer faktisk etterleves, mener kommisjonen at medisinske tidsskrifter børinnføre og praktisere et system hvor alle medforfattere trekkes med i kommunikasjonen medtidsskriftene. De bør bli tilskrevet og orientert om at de er angitt som medforfattere, og de børenkeltvis avgi sine bekreftelser om dette direkte til de respektive redaksjoner. Forfatterne børsamtidig gi en skriftlig redegjørelse for hva deres intellektuelle bidrag til arbeidet består i, noeenkelte tidsskrifter krever allerede i dag. Likeledes mener kommisjonen at det vil være rimelig atalle medforfattere får tilsendt review-uttalelser. På denne måten styrkes ansvarliggjøring av denenkelte forfatter, og en vil samtidig kunne unngå at forskere oppføres som forfattere uten å hakjennskap til dette.Dersom slike prinsipper hadde blitt anvendt på Lancet-artikkelen, er det etterkommisjonens vurdering nokså sannsynlig at forskningsjukset ville ha blitt avslørt allerede førpublisering, særlig tatt i betraktning nokså negative uttalelser og kritiske spørsmål fra en av
120
fagfellene som vurderte artikkelen. Tilsvarende prinsipper bør gjelde for bidragsytere som eroppført under acknowledgements.Med bruk av moderne elektronisk kommunikasjon kan ikke kommisjonen se at disseforslag til endrede rutiner skulle innebære vesentlige administrative eller økonomiske byrder. Forå lette de administrative utfordringene bør det derfor stilles krav om at innsendelse av manusledsages av en liste med e-postadresser til samtlige forfattere/medforfattere og bidragsytere.Kommisjonen har videre vurdert hvorvidt systemet med ”fast track publishing” somenkelte tidsskrifter praktiserer, kan ha uheldige virkninger, i betydningen av at det går for kort tidmellom fagfellevurderingen og publisering til å kunne fange opp faglige innvendinger tilarbeidet. Kommisjonen begrenser seg her til å reise problemstillingen. Selv om de personer somblir benyttet som fagfeller i et ”fast track” review-system har solid faglig tyngde og integritet,kan en likevel ikke se helt bort fra at tidspresset som ligger innbakt i selve systemet, genererer enunødig risiko for at feil ikke oppdages.
8.3
Kommisjonens avsluttende merknad
Kommisjonen vil avslutningsvis bemerke at selv om denne saken har vært meget alvorlig ogtragisk for enkeltpersoner, institusjoner og norsk forskning mer generelt, finnes dettilsynelatende en bemerkelsesverdig vilje innad i forskningsmiljøet til å snu saken til noe positivt– noe alle kan ta lærdom av. Hyppige avisinnlegg, debatter og seminarer har vist et allerede stortengasjement i mange forskningsmiljøer. Kommisjonen vil støtte opp om en slik tankegang, ogsamtidig advare mot forsøk på å feie denne ekstraordinære saken under teppet – fordi denerekstraordinær - og bare fortsette som før.Tvert i mot gir denne saken anledning til en grundig diskusjon av ulike sider ved denormer som knytter seg til god forskningsskikk. Det kollektive forskningsmiljøet må ta etkrafttak for å tydeliggjøre forskningens tradisjonelle idealer om ærlighet, grundighet,etterrettelighet og åpenhet. Og det må synliggjøres for allmennheten, slik at befolkningens tillittil norsk forskning opprettholdes og styrkes.
121
Vedlegg
122
Vedlegg 1: Jon Sudbøs publikasjonsliste481: Sudbo J, Lee JJ, Lippman SM, Mork J, Sagen S, Flatner N, Ristimaki A, Sudbo A, Mao L,Zhou X, Kildal W, Evensen JF, Reith A, Dannenberg AJ. Non-steroidal anti-inflammatory drugsand the risk of oral cancer: a nested case-control study. Lancet. 2005 Oct 15-21;366(9494):1359-66.2: Sudbo J. Novel management of oral cancer: a paradigm of predictive oncology. Clin Med Res.2004 Nov;2(4):233-42. Review.3: Kildal W, Risberg B, Abeler VM, Kristensen GB, Sudbo J, Nesland JM, Danielsen HE. beta-catenin _expression, DNA ploidy and clinicopathological features in ovarian cancer: a study in253 patients. Eur J Cancer. 2005 May;41(8):1127-34. Epub 2005 Apr 14.4: Lilleby W, Sudbo J, Fossa SD. [Biology and treatment options during the development ofprostate cancer] Tidsskr Nor Laegeforen. 2005 Mar 3;125(5):571-4. Review. Norwegian.5: Sudbo J, Samuelsson R, Risberg B, Heistein S, Nyhus C, Samuelsson M, Puntervold R,Sigstad E, Davidson B, Reith A, Berner A. Risk markers of oral cancer in clinically normalmucosa as an aid in smoking cessation counseling. J Clin Oncol. 2005 Mar 20;23(9):1927-33.6: Sudbo J, Reith A. The evolution of predictive oncology and molecular-based therapy for oralcancer prevention. Int J Cancer. 2005 Jun 20;115(3):339-45. Review.7: Lippman SM, Sudbo J, Hong WK. Oral cancer prevention and the evolution of molecular-targeted drug development. J Clin Oncol. 2005 Jan 10;23(2):346-56. Review.8: Kildal W, Kaern J, Kraggerud SM, Abeler VM, Sudbo J, Trope CG, Lothe RA, Danielsen HE.Evaluation of genomic changes in a large series of malignant ovarian germ cell tumors--relationto clinicopathologic variables. Cancer Genet Cytogenet. 2004 Nov;155(1):25-32.9: Sudbo J, Lippman SM, Lee JJ, Mao L, Kildal W, Sudbo A, Sagen S, Bryne M, El-Naggar A,Risberg B, Evensen JF, Reith A. The influence of resection and aneuploidy on mortality in oralleukoplakia. N Engl J Med. 2004 Apr 1;350(14):1405-13.10: Sudbo J, Reith A, Florenes VA, Nesland JM, Ristimaki A, Bryne M. COX-2 _expression instriated muscle under physiological conditions.Oral Dis. 2003 Nov;9(6):313-6.11: Sudbo J. Non-invasive early diagnosis of oral cavity malignancies.Anal Cell Pathol. 2003;25(4):157-8.12: Sudbo J, Bryne M, Mao L, Lotan R, Reith A, Kildal W, Davidson B, Soland TM, LippmanSM. Molecular based treatment of oral cancer.Oral Oncol. 2003 Dec;39(8):749-58. Review.13: Sudbo J. Protection of research subjects. N Engl J Med. 2003 Jul 10;349(2):188-92; authorreply 188-92.
48
Hentet frawww.pubmed.govjanuar 2006. Ikke uttømmende.
123
14: Sudbo J. [Chemoprevention of oral cancer] Tidsskr Nor Laegeforen. 2003 May29;123(11):1518-21. Review. Norwegian.15: Sudbo J. [Chemoprevention: treatment of persons at high risk of cancer] Tidsskr NorLaegeforen. 2003 May 29;123(11):1514-7. Review. Norwegian.16: Sudbo J, Ristimaki A, Sondresen JE, Kildal W, Boysen M, Koppang HS, Reith A, Risberg B,Nesland JM, Bryne M. Cyclooxygenase-2 (COX-2) expression in high-risk premalignant orallesions. Oral Oncol. 2003 Jul;39(5):497-505.17: Scully C, Sudbo J, Speight PM. Progress in determining the malignant potential of orallesions. J Oral Pathol Med. 2003 May;32(5):251-6. Review.18: Sudbo J, Reith A. When is an oral leukoplakia premalignant?Oral Oncol. 2002 Dec;38(8):813-4; author reply 811-2. No abstract available.19: Sudbo J, Reith A. Which putatively pre-malignant oral lesions become oral cancers? Clinicalrelevance of early targeting of high-risk individuals.J Oral Pathol Med. 2003 Feb;32(2):63-70. Review.20: Reith A, Sudbo J. Impact of genomic instability in risk assessment and chemoprevention oforal premalignancies. Int J Cancer. 2002 Sep 20;101(3):205-9. Review.21: Sudbo J. [Adverse effects of COX-2 inhibitors] Tidsskr Nor Laegeforen. 2002 Jan10;122(1):102-3. Norwegian.22: Sudbo J. [DNA ploidy analysis--a possibility for early identification of patient with risk oforal cancer] Lakartidningen. 2001 Nov 7;98(45):4980-4. Review. Norwegian.23: Sudbo J. Pathology in disgrace? J Pathol. 2002 Feb;196(2):244-5. No abstract available.24: Sudbo J, Kildal W, Johannessen AC, Koppang HS, Sudbo A, Danielsen HE, Risberg B,Reith A. Gross genomic aberrations in precancers: clinical implications of a long-term follow-upstudy in oral erythroplakias. J Clin Oncol. 2002 Jan 15;20(2):456-62.25: Sudbo J, Warloe T, Aamdal S, Reith A, Bryne M. [Diagnosis and treatment of oralprecancerous lesions] Tidsskr Nor Laegeforen. 2001 Oct 30;121(26):3066-71. Norwegian.26: Sudbo J, Ried T, Bryne M, Kildal W, Danielsen H, Reith A.Abnormal DNA content predicts the occurrence of carcinomas in non-dysplastic oral whitepatches. Oral Oncol. 2001 Oct;37(7):558-65.27: Sudbo J. Human papillomavirus infection as a risk factor for squamous-cell carcinoma of thehead and neck. N Engl J Med. 2001 Aug 2;345(5):376-7.28: Sudbo J, Bryne M, Johannessen AC, Kildal W, Danielsen HE, Reith A. Comparison ofhistological grading and large-scale genomic status (DNA ploidy) as prognostic tools in oraldysplasia. J Pathol. 2001 Jul;194(3):303-10.29: Sudbo J, Reith A, Lingjaerde OC. Gene-_expression profiles in hereditary breast cancer. NEngl J Med. 2001 Jun 28;344(26):2029. No abstract available.
124
30: Sudbo J, Kildal W, Risberg B, Koppang HS, Danielsen HE, Reith A. DNA content as aprognostic marker in patients with oral leukoplakia. N Engl J Med. 2001 Apr 26;344(17):1270-8.31: Sudbo J, Marcelpoil R, Reith A. New algorithms based on the Voronoi Diagram applied in apilot study on normal mucosa and carcinomas. Anal Cell Pathol. 2000;21(2):71-86.32: Sudbo J, Marcelpoil R, Reith A. Caveats: numerical requirements in graph theory basedquantitation of tissue architecture. Anal Cell Pathol. 2000;21(2):59-69.33: Sudbo J, Bankfalvi A, Bryne M, Marcelpoil R, Boysen M, Piffko J, Hemmer J, Kraft K,Reith A. Prognostic value of graph theory-based tissue architecture analysis in carcinomas of thetongue. Lab Invest. 2000 Dec;80(12):1881-9.34: Danielsen HE, Kildal W, Sudbo J. [Digital image analysis in pathology--exemplified inprostatic cancer] Tidsskr Nor Laegeforen. 2000 Feb 10;120(4):479-88. Review. Norwegian.35: Bryne M, Boysen M, Alfsen CG, Abeler VM, Sudbo J, Nesland JM, Kristensen GB, Piffko J,Bankfalvi A. The invasive front of carcinomas. The most important area for tumour prognosis?Anticancer Res. 1998 Nov-Dec;18(6B):4757-64. Review.36: Zhang Z, Suo Z, Sudbo J, Holm R, Boysen M, Reith A. Diagnostic implications of p53protein reactivity in nasal mucosa of nickel workers.Anal Quant Cytol Histol. 1997 Aug;19(4):345-50.37: Xie X, Clausen OP, Sudbo J, Boysen M. Diagnostic and prognostic value of nucleolarorganizer regions in normal epithelium, dysplasia, and squamous cell carcinoma of the oralcavity. Cancer. 1997 Jun 1;79(11):2200-8.38: Bjaalie JG, Sudbo J, Brodal P. Corticopontine terminal fibres form small scale clusters andlarge scale lamellae in the cat. Neuroreport. 1997 May 6;8(7):1651-5.
125
Vedlegg 2: Utviklingen av forfatterskapskriteriene1997International Committee ofMedical Journal Editors.Uniform requirements formanuscripts submitted tobiomedical journals. N Engl JMed. 1997 Jan23;336(4):309-15.AuthorshipAll persons designated as authors should qualify for authorship.Each author shouldhave participated sufficiently in the work to take public responsibility for thecontent.Authorship credit should be based only on substantial contributions to(a)conception and design,oranalysis and interpretation of data; and to(b)drafting the article or revising it critically for important intellectual content; and on(c)final approval of the version to be published.Conditions (a), (b), and (c) must allbe met.Participation solely in the acquisition of funding or the collection of data does notjustify authorship. General supervision of the research group is not sufficient forauthorship.Any part of an article critical to its main conclusions must be theresponsibility of at least one author.Editors may ask authors to describe whateach contributed; this information may be published.Increasingly, multicenter trials are attributed to a corporate author. All members of thegroup who are named as authors, either in the authorship position below the title or ina footnote, should fully meet the above criteria for authorship. Group members who donot meet these criteria should be listed, with their permission, in theAcknowledgments or in an appendix (see Acknowledgments). The order of authorshipshould be a joint decision of the coauthors. Because the order is assigned in differentways, its meaning cannot be inferred accurately unless it is stated by the authors.Authors may wish to explain the order of authorship in a footnote.In deciding onthe order, authors should be aware that many journals limit the number of authorslisted in the table of contents and that the National Library of Medicine lists inMEDLINE only the first 24 plus the last author when there are more than 25 authors.2003Davidoff F, Godlee F, Hoey J,Glass R, Overbeke J, UtigerR, Nicholls MG, Horton R,Nylenna M, Hojgaard L,Kotzin S; InternationalCommittee of Medical JournalEditors.Uniform requirements formanuscripts submitted tobiomedical journals. J AmOsteopath Assoc. 2003Mar;103(3):137-49.(2) drafting the article or revising it critically for important intellectual content; and(1) substantial contributions to conception and design,oracquisition of data,oranalysis and interpretation of data;All persons designated as authors should qualify for authorship, and all those whoqualify should be listed.Each author should have participated sufficiently in thework to take public responsibility for appropriate portions of the content. Oneor more authors should take responsibility for the integrity of the work as awhole, from inception to published article.Authorship credit should be based onlyonAuthorship
(3) final approval of the version to be published.
Conditions 1, 2, and 3 must all be met.Acquisition of funding, the collection of data,or general supervision of the research group, by themselves, do not justify authorship.Authors should provide a description of what each contributed, and editors shouldpublish that information. All others who contributed to the work who are not authorsshould be named in the Acknowledgments, and what they did should be described
126
(see Acknowledgments, page 140). Increasingly, authorship of multicenter trials isattributed to a group. All members of the group who are named as authors should fullymeet the above criteria for authorship. Group members who do not meet these criteriashould be listed, with their permission, in the Acknowledgments or in an appendix(see Acknowledgments, page 140).The order of authorship on the byline shouldbe a joint decision of the coauthors. Authors should be prepared to explain theorder in which authors are listed.
127
2006Uniform Requirements forManuscripts Submitted toBiomedical Journals: Writingand Editing for BiomedicalPublication
II.A Authorship and ContributorshipII.A.1. Byline AuthorsAn “author” is generally considered to be someone who has made substantiveintellectual contributions to a published study, and biomedical authorshipcontinues to have important academic, social, and financial implications.(1) Inthe past, readers were rarely provided with information about contributions to studiesfrom those listed as authors and in acknowledgments. (2) Some journals now request
Updated February 2006
and publish information about the contributions of each person named as havingparticipated in a submitted study, at least for original research. Editors are strongly
www.icmje.org
encouraged to develop and implement a contributorship policy, as well as a policy onidentifying who is responsible for the integrity of the work as a whole. Whilecontributorship and guarantorship policies obviously remove much of the ambiguitysurrounding contributions, it leaves unresolved the question of the quantity and qualityof contribution that qualify for authorship. The International Committee of MedicalJournal Editors has recommended the following criteria for authorship; these criteriaare still appropriate for those journals that distinguish authors from other contributors.• Authorship credit should be based on1)substantial contributions to conception and design,oracquisition of data,oranalysis and interpretation of data;2)drafting the article or revising it critically for important intellectual content; and3)final approval of the version to be published.Authors should meet conditions 1, 2, and 3.• When a large, multi-center group has conducted the work, the group should identifythe individuals who accept direct responsibility for the manuscript (3). Theseindividuals should fully meet the criteria for authorship defined above and editors willask these individuals to complete journal-specific author and conflict of interestdisclosure forms. When submitting a group author manuscript, the correspondingauthor should clearly indicate the preferred citation and should clearly identify allindividual authors as well as the group name. Journals will generally list othermembers of the group in the acknowledgements. The National Library of Medicineindexes the group name and the names of individuals the group has identified asbeing directly responsible for the manuscript.• Acquisition of funding, collection of data, or general supervision of the researchgroup, alone, does not justify authorship.• All persons designated as authors should qualify for authorship, and all those whoqualify should be listed.• Each author should have participated sufficiently in the work to take publicresponsibility for appropriate portions of the content. Some journals now alsorequest that one or more authors, referred to as “guarantors,” be identified asthe persons who take responsibility for the integrity of the work as a whole,from inception to published article, and publish that information.Increasingly,authorship of multi-center trials is attributed to a group. All members of the group whoare named as authors should fully meet the above criteria for authorship. The order ofauthorship on the byline should be a joint decision of the co-authors.Authors shouldbe prepared to explain the order in which authors are listed.
128
1997InternationalCommittee of MedicalJournal Editors.Uniform requirementsfor manuscriptssubmitted tobiomedical journals.N Engl J Med. 1997Jan 23;336(4):309-15.
AcknowledgmentsAt an appropriate place in the article (the title-page footnote or an appendix to the text; seethe journal’s requirements) one or more statements should specify (a) contributions thatneed acknowledging but do not justify authorship, such as general support by adepartmental chair; (b) acknowledgments of technical help; (c) acknowledgments offinancial and material support, which should specify the nature of the support; and (d)relationships that may pose a conflict of interest. Persons who have contributedintellectually to the paper but whose contributions do not justify authorship may be namedand their function or contribution described — for example, “scientific advisor,” “criticalreview of study proposal,” “data collection,” or “participation in clinical trial.” Such personsmust have given their permission to be named.Authors are responsible for obtainingwritten permission from persons acknowledged by name, because readers may infertheir endorsement of the data and conclusions.Technical help should beacknowledged in a paragraph separate from those acknowledging other contributions.
2003Davidoff F, Godlee F,Hoey J, Glass R,Overbeke J, Utiger R,Nicholls MG, HortonR, Nylenna M,Hojgaard L, Kotzin S;InternationalCommittee of MedicalJournal Editors.Uniform requirementsfor manuscriptssubmitted tobiomedical journals. JAm Osteopath Assoc.2003 Mar;103(3):137-49.
AcknowledgmentsList all contributors who do not meet the criteria for authorship, such as a person whoprovided purely technical help, writing assistance, or a department chair who provided onlygeneral support. Financial and material support should also be acknowledged. Groups ofpersons who have contributed materially to the paper but whose contributions do not justifyauthorship may be listed under a heading such as "clinical investigators" or "participatinginvestigators," and their function or contribution should be described-for example, "servedas scientific advisors," "critically reviewed the study proposal," "collected data," or"provided and cared for study patients."Because readers may infer their endorsementof the data and conclusions, all persons must have given written permission to beacknowledged.
129
2006UniformRequirements forManuscriptsSubmitted toBiomedical Journals:Writing and Editingfor BiomedicalPublicationUpdated February2006
II.A.2. Contributors Listed in AcknowledgmentsAll contributors who do not meet the criteria for authorship should be listed in anacknowledgments section. Examples of those who might be acknowledged include aperson who provided purely technical help, writing assistance, or a department chair whoprovided only general support. Editors should ask authors to disclose whether they hadwriting assistance and to identify the entity that paid for this assistance. Financial andmaterial support should also be acknowledged. Groups of persons who have contributedmaterially to the paper but whose contributions do not justify authorship may be listedunder a heading such as “clinical investigators” or “participating investigators,” and theirfunction or contribution should be described—for example, “served as scientific advisors,”“critically reviewed the study proposal,” “collected data,” or “provided and cared for studypatients.”Because readers may infer their endorsement of the data and conclusions,all persons must give written permission to be acknowledged.
www.icmje.org
130
Vedlegg 3: Filer og lister som Kommisjonen har benyttet igranskningen av artiklene i New England Journal of Medicinei 2001 og 2004FilnavnUpdatedrawdata(Excel)Sudbø8(Excel)Reith papirliste(rawdata munn-slimhinne)L29(Excel)147 records(blokknummer)150 records150 recordsRecords150 recordsNotatFørste fil sendt til USA for New England Journal ofMedicine 2004Har ikke koplingsnøkkelSiste fil sendt til USA for New England Journal ofMedicine 2004Har ikke koplingsnøkkelIdentisk med Sudbø8 på datovariabler – inneholderi tillegg blokknummer på 142 records sommuliggjør koplingInneholder samme blokknummer som Reithpapirliste. Overskriften på listen er ”Dato: 15.04.98 Hovedjournal Jnr L29 ProsjektMunnslimhinne Parafinblokker fra Haukeland”L31(Excel)106 records(Blokknummer)Dato:april1998 Hovedjournal Jnr:L31Materiale:munnslimhinne. Parafinblokker fraHaukeland. Snittet 50umxn. Metode:monolayerfremstilling. Protease 60min, Hydrolyse60minL34(Excel)69 records(blokknummer)Dato: 08.03.99 Hovedjournal Jnr: L34 Materiale:Dysplasier fra odont.fak. Mottatt blokker, snittet50um + 3 ufargede snitt Metode: MonolayerFeulgen farget + farge HE av 1 ufarget snittProtease 0.5mg/ml i 60 min 37C. 5N HCl 60minBasisk Fuchsin 2timerOBS!Etter avtale med Jon Går denne protokollenut. Prøvene i denne serien får L3123.10.01 Ryddet isnitt og blokker . Snitt ikkeendret til L31. Derfor arkivert under L34 .Prosjektansvarlig:Jon SudbøDato:L47(Excel)46 records(blokknummer)Dato: 24.03.00 Hovedjournal Jnr.L47 Jnr.L47Materiale: Normal munnslimhinneMetode: monolayer fra parafininnstøpt materiale1. Snittes et HE-snitt, hvis lite materiale lages kunmonolayer 2. Snittes nx 50 um snittHE2-snitt49
Kilde / år49JJL 2006
JJL 2006
AR 2006
Radiumhospitalet
Oversendt fra HD2006
Oversendt fra HD2006
Sign:
Oversendt fra RP2006
3. Snittes et
JJL=J.Jack Lee, AR=Albrecht Reith, JS= Jon Sudbø, HD=Håvard Danielsen, RP= Ruth Punthervold
131
Prosjektansvarlig:Jon Sudbøutskriftsdato:25.03.00
Sign:
Dato:
Desember 2000. prosjekt avsluttet levert til JonDato: 24.03.00 HovedjournalPloidiliste(Excel)393 linjer i Excel-arketFilnavn: Alle Originale blokker og HE-snittkorrelert til ploidiprep og L29 serien.xlsInneholder link mellom ploidipreparat ogblokknummer og link til L29 serienDnr-js2(Excel)Xdiagnoser(SPSS)Xpersoner(SPSS)GadeOdontologen,OsloPapirliste Gade590 records162 personer132 records,62 personer178 records(blokknummer)144-146 personerAlle remisser fra Odontologen, Oslo på personerfra Dnr-js2Mottatt avidentifisert med blokknummer226 personer – 61mangler pnr311 records på195 personer226 personerAlle på Dnr-js2 med kreftdiagnose pr 2006 (195 av226 personer)Alle på Dnr-js2 supplert med pnr og dødsdato pr2006Alle remisser fra Gade på personer fra Dnr-js2Fil levert fra Kreftregisteret til Sudbø i 1996Kreftregisteret1996Kreftregisteret2006Kreftregisteret2006Kreftregisteret2006Kreftregisteret2006Gade 1997Produsert av RP2006
132
Vedlegg 4: TabellRawdata lenket til opplysninger fra Kreftregisteret og opplysninger om ploidipreparat fra Radiumhospitalet. Sudbø8som lå til grunn for artikkelen i NEJM 2004, er identisk med Rawdata som i tillegg inneholdt prep_nr som harmuliggjort kobling. Munnhulekreft er definert ved kodene 1400-1499. Uthevet skrift viser records hvor dato formunnhulekreft er før dato da biopsien ble tatt (dato for prep_nr). Prep_nr er strøket. Missing betyr at det ikke varprep_nr på Rawdata filen.KommisjonenunikepersonerP1P2P3P4P5P6P7P8P9P10P11P12P13P14P15P16P17P18P19P20P21P22P23P24P25P26P27P28P29P30P31P32P33P34P35P36P37P38P39P40P41P42P43Missing198619861986198619861986198619861986198619861986198219861986JaJaJaNeiNeiJa1989198719951992198719871988Missing1984198419841984198419851985198519851985198419841984198419841985198519851985JaJaJaJaJaJaJaJaJa1984198519861986
Rawdataptnidrecordnr12345678910111213141516171819202122232425262728293031323334353637383940414243
Rawdata/L29prep_nrår prep1981198119811981198119811981198119821982198219821982198219821982199019831989198919831983
Kreftregisteret 1996år kreft19811981198119811981198019801982195519731982198219781976198219871975198919891982kreft imunnhuleJaJaJaJaJaNeiJaJaNeiNeiJaJaNeiJaJaJaJaNeiJaJaår død1981
Sudbø8årleukoplaki1982199019831993198219861992199319911991198719941992199419901992199319941994199219931992198819871991199319871988199019941993199419941990199319821987199119931985199419921993198620001988år kreft
Ploidilistelink tilprep_nrJa
19911985198619931983
JaJaJaJa
20011990Ja
1983198319841983198319911989
Ja
1983
JaJaJaJaJaJa
19931986
JaJaJa
Ja
133
Rawdataptnidrecordnr4445464748495051515253545556575859606162636465666768697071727374757677787980818283848586878889909192
KommisjonenunikepersonerP44P45P46P47P48P17P49P50P41P51P52P44P45P46P47P53P48P17P54P55P56P57P58P59P60P61P62P63P64P65P66P67P68P69P70P71P72P73P74P19P20P75P76P77P78P79P80P81P82P83
Rawdata/L29prep_nrår prep198719871987198719871987Missing19921986Missing19871987198719871987Missing198719871987198719871988198719881988198819881988198819881988198819881988Missing198919891989198919891989198919901990199019901990199019901990
Kreftregisteret 1996år kreft1987198819871987kreft imunnhuleJaNeiJaJaår død
Sudbø8årleukoplaki19901984198619901994198319921992år kreft
Ploidilistelink tilprep_nrJaJa
1988
1992
1992
Ja
Ja1987Ja198819821990199419871984198319841993199419941993199019891993199219901983198519901988198619921982198719941990198219881994198719931990198419891987198819921991198619891994JaJaJaJaJa
Ja
1986198619871987
JaJaJaNei
19901992
JaJaJaJaJa
19931988198819881992198919881989198119881989198919891989
NeiJaJaNeiNeiNeiJaJaNeiJaJaJaJaJa
199019901992
JaJaJaJaJaJaJa
1991
1993
JaJaJa
1979
Ja
1994
198519901990
JaJaJa
19911990
134
Rawdataptnidrecordnr93949596979899100101102103104105106107108109110111112113114115116117118119120121122123124125126127128129130131132133134135136137138139140141142
KommisjonenunikepersonerP84P85P86P87P88P89P90P91P92P93P94P95P96P97P98P99P100P101P102P103P104P105P106P107P108P109P110P111P112P113P114P115P116P117P118P119P120P121P122P123P124P125P126P127P128P129P130P131P132P133
Rawdata/L29prep_nrår prep1990199119911991Missing199119911991199219921992199219921992199219921992199219921992199219921992199219921992199519921993199319931993199319931993199319931993199319931993Missing19941993199319941994199419941994
Kreftregisteret 1996år kreft198419891991kreft imunnhuleNeiNeiNeiår død199419921991
Sudbø8årleukoplaki198319841993198719921991198319911986199419931992198819921990199419941995199519861993199219941984199319901993198619931986199019861984198919931993199019941989198519821991198919831987199419841990199419861983199119941986199319922000198419881995198519881992200020011991200019902000200119981988199620001987199719931997år kreft
Ploidilistelink tilprep_nr
198919911974199219911992198619921992199219821992198719921988199119921980199219931992199319931993199319931982199319931993196819931984
JaJaNeiJaJaJaNeiJaJaJaJaJaNeiJaNeiJaJaNeiJaJaJaJaJaJaJaJaNeiJaJaJaNeiJaNei
1992
JaJaJaJaJaJaJaJaJaJaJaJa
Ja
JaJaJa
JaJa
JaJa
Ja1988199319881994JaJa
1981
Nei
JaJa
135
Rawdataptnidrecordnr143144145146147148149150
KommisjonenunikepersonerP134P135P136P137P138P139P82P140
Rawdata/L29prep_nrår prep19941994199419941995199519901995
Kreftregisteret 1996år kreftkreft imunnhuleår død
Sudbø8årleukoplaki19881994198819931994198319871994år kreft1990199119951997198519881994
Ploidilistelink tilprep_nr
1989
Nei
JaJaJa
136
Vedlegg 5: Uredelighetsutvalgets veilederNorges forskningsråd 2001
Veiledning for gjennomføring av prosjekter i medisinsk og helsefagligforskning,50utarbeidet av det daværende Nasjonale uredelighetsutvalgHensikt med veiledningen:Å gi råd for utforming av undersøkelsesplaner, dokumentasjon ogoppbevaring av data innenfor medisinsk og helsefaglig forskning. Målet er å forebyggeuoverensstemmelser mellom deltakerne i et prosjekt og dessuten unngå at det reises tvil omgjennomføringen av prosjektet.
Før prosjektet settes i gang:•Prosjektets hensikt og mål skal være klart formulert. Det man ønsker å registrere (effektmål,variabler), hvordan man ønsker å utføre prosjektet (metode) og de materialer og prosedyrersom inngår skal være klart formulert i en forsøksplan (forsøksprotokoll).•••••Eventuelle interessebindinger og interessekonflikter vedrørende undersøkelsen og deltakereskal klargjøres.Prosjektlederansvar og arbeidsdeling skal avtales.Forfatterskap for planlagte publikasjoner bør avtales. Ved endring i forfatterskap skal detteavtales på ny.Eierskap og bruksrett til originaldata og bearbeidede resultater skal klargjøres.Et prosjekt som inkluderer forsøkspersoner skal være vurdert av den regionaleforskningsetiske komité for medisin (REK) og tilråding gitt før prosjektet settes i verk. Detskal være informert samtykke fra forsøkspersoner. Inklusjons- og eksklusjonskriterier, samtkriterier for å avbryte prosjektet skal foreligge. Det skal være innhentet tillatelser som angårdatalagring, taushetsplikt og eventuelle andre forhold der det er aktuelt.••Forsøk med dyr skal være vurdert av Forsøksdyrutvalget og tillatelse gitt før prosjektet settesi verk.Utstyr med målefunksjon og andre måleinstrumenter skal være dokumentert og det skaletableres rutiner for kontroll, kalibrering og validering.
50
Merk at denne veilederen verken er helt à jour eller uttømmende, og at nyere lovgivning, som for eksempelbiobankloven som trådte i kraft sommeren 2003 ikke er medregnet.
137
•
Undersøkelsesplaner med tilhørende registreringsskjema skal være tilgjengelige, oversiktlige,utvetydige og forståelige for alle som deltar i prosjektet. Dette materialet skal utformes i sågod tid at det er tilstrekkelig tid til opplæring, eventuell utprøving og justering.
Under prosjektperioden:•••De medvirkende i prosjektet har gjensidig informasjonsplikt vedrørende fremdrift, resultater,bearbeiding, presentasjon og fortolkning.Avvik fra opprinnelig undersøkelsesplan og forsøksprosedyrer skal dokumenteres. Eventuellendring av prosjektet og konsekvenser av dette skal være godkjent av prosjektledelsen.Personrelaterte data som samles inn i løpet av kliniske forskningsprosjekter, skal kunneidentifiseres og gjenfinnes for hver enkelt forsøksperson i henhold til vilkår gitt avkontrollorgan/tilsynsmyndighet. Det skal fremgå hvem som har samlet inn data, og når detble gjort.••Utstyr med målefunksjon skal kontrolleres og kalibreres jevnlig. Det skal fremgå hvem somhar utført det, og når det ble gjort.Materiell (f. eks. kjemikalier, preparater, materialer) som benyttes i prosjektet skal kunneidentifiseres og dokumenteres.
Etter prosjektperioden:•Originaldata skal være ordnet systematisk, sikkert og skal kunne gjenfinnes. Data, inklusivesamtykkeerklæringer, skal vanligvis oppbevares i minst 10 år og etter de bestemmelser somtil enhver tid gjelder i nasjonal lovgivning, konsesjonsvilkår, kontraktsbetingelser og egneinstitusjonsregler. Det samme gjelder undersøkelsesplaner, bilag og eventuelleavviksbeskrivelser.•Etter at prosjektperioden er avsluttet, kan informasjonen lagres samlet hos institusjoner somer godkjent for dette. Det bør inngås en endelig avtale om framtidig eierskap,oppbevaringsrett og disposisjonsrett til data og øvrig materiale som er tilgjengelig som enfølge av prosjektet. Det må tas spesielle hensyn når det inngår personrelaterte data slik at detikke oppstår konflikt i forhold til avtaler med forsøkspersoner.•I påkommende tilfeller skal eier av data kunne etablere sporbarhet fra publiserte samledata, f.eks. tabeller og figurer, til originaldata.
138
Medisinske ord og uttrykk51Adenom:godartet svulst som utgår fra og til dels er oppbygd som en kjertelBiopsi:Vevsprøve fra levende pasient for mikroskopisk undersøkelseCancer:KreftCarcinoma in situ:betegnelse på celleforandringer som tyder på begynnende kreftutvikling utenat spredning ennå er begynt, forstadium til kreftDiploid:betegner at en celle inneholder to kromosomsettDNA-aneuploidi:celler med avvikende DNA-mengde, kan finnes ved mange ondartede svulsterDNA-histogram:Grafisk fremstilling av analyseresultater for DNA mengde som benyttes iploidiklassifikasjon (se egen forklaring)Dysplasi (mild, moderat eller grov):Vekstforstyrrelse, ufullstendig eller feilaktig utvikling avben, brusk og/eller hudErythroplakier:Rød flekk (plakk) eller lesjon i munnslimhinnen (kalles også dysplastiskleukoplaki); lesjonen er relatert til leukoplaki, men sjeldnere og mer alvorlig i det den hyppigereutvikler seg til kreftGrafteori:Analyse og numerisk representasjon av grafiske fremstillingerHisto-patologi:Læren om sykelig forandringer i veveneHydrolyse og Feulgen farging:Teknikker som benyttes for fremstilling av vevspreparaterkarsinom: ondartet svulst i epitelvev, dvs. i hud, i slimhinner eller i kjertlerKjemoprevensjon:Begrep særlig brukt om inntak av ulike stoffer for å hindre utvikling av kreft51
I det vesentlige hentet fra: Nylenna M. Medisinsk ordbok. Oslo: Kunnskapsforlaget, 2005.
139
Kolorektalkreft:Kreft i tykktarm og endetarmLesjon:Fellesbetegnelse på avgrensede skader på kroppenLeukoplaki:hvit flekk (plakk) i munnslimhinnen som ikke kan skrapes bort; leukoplakien kanutvikle seg til kreftMalign:OndartetMaligne transformasjonspotensialet:En lesjon med høyt malignt transformasjonspotensiale(f.eks. erytroplaki) utvikler seg hyppigere til kreft enn en lesjon med lavere malignttransformasjonspotensiale (f.eks. leukoplaki)Melanom:Føflekkreft, pigmentcellekreftNSAID:Non steroidal anti-inflammatory drugsOdontologi:TannmedisinOral:Som hører til eller har med munnen å gjørePlateepitelcarcinom:Ondartet svulst utviklet fra plateepitelceller i hud eller slimhinnerPloidiklassifikasjon:Klassifikasjon av DNA mengde som diploid, tetraploid eller aneuploid (seegne forklaringer)Premaligne lidelser:Tilstander som kan utvikle seg til kreftRe-klassifikasjon: Gjentatt klassifikasjonRemisse:Brev fra en lege til annen lege, sykehus, laboratorium eller lignende med begjæring omfor eksempel å ta hånd om eller undersøke ytterligereTetraploid:Har fire sett kromosomer i cellekjernen140
Vevsblokk:Parafin-innstøpt vev som benyttes til fremstilling av histologiske snitt.
141
Lover og forskrifter brukt i rapportenBiobanklovenForvaltningslovenForskningsetikklovenHelseforetakslovenHelsepersonellovenHelseregisterlovenJournalforskriftenLov om universiteterog høgskolerMenneskerettighetslovenOffentlighetslovenPasientrettighetslovenPersonopplysningslovenSkadeerstatningslovenLov om biobanker (LOV-2003-02-21-12).Lov om behandlingsmåten i forvaltningens saker (LOV-1967-02-10).Lov om behandling av etikk og redelighet i forskning. (LOV-2006-06-08-71). (Ikke sanksjonert).Lov om helseforetak m.m. (LOV-2001-06-15-93).Lov om helsepersonell m.v. (LOV-1999-07-02-64).Lov om helseregistre og behandling av helseopplysninger. (LOV-2001-05-18-24).Forskrift om pasientjournal. (FOR-2000-12-21-1385).Lov om universiteter og høyskoler. (LOV-2005-04-01-15).Lov om styrking av menneskerettighetenes stilling i norsk rett.(LOV-1999-05-21-30).Lov om offentlighet i forvaltningen. (LOV-1970-06-19-69).Lov om pasientrettigheter. (LOV-1999-07-02-63).Lov om behandling av personopplysninger. (LOV-2000-04-14-31).Lov om skadeserstatning. (LOV-1969-06-13-26).
Spesialisthelsetjenesteloven Lov om spesialisthelsetjenesten m.m. (LOV-1999-07-02-61).ÅndsverkslovenLov om opphavsrett til åndsverk m.v. (LOV-1961-05-12-2).
Opphevede loverLegelovenPersonregisterlovenTannlegelovenLov om leger. (LOV-1980-06-13-42).Lov om personregistre m.m. (LOV 1978-06-09-48).Lov om tannleger (LOV 1980-06-13 nr 43).
142
LitteraturlisteBates T, Anič A, Marušič M, Marušič A. Authorship Criteria and Disclosure of Contributors.Comparison of 3 General Medical Journals With Different Author Contribution Forms. JAMA2004; 292: 86–88.Benestad HB, Laake P. Forskningsmetode i medisin og biofag. Oslo: Gyldendal, 2004.Bentzen N, Hansen BL, Nexøe J (red.). Ph.D.-vejledning. Et idéhæfte. Købehavn, 1999.Bergsjø P. Biomedisinske forskningsprosjekter hvor forsøk på mennesker inngår – hva er nå det?Tidsskrift for Den norske lægeforening nr 12 1993; 113: 1443-1444.Bhopal R et al. The vexed question of authorship: views of researchers in a British medicalfaculty. BMJ 1997; 314: 1009Bratholm A. Granskning som statlig virkemiddel for å bringe faktiske forhold elleransvarsforhold på rene. Lov og Rett 1986: 439.Buskop T. Hvem har ansvaret for et forskningsprosjekt? www.forskningsjus.no, 2006.Hoen WP, Walvoort HC, Overbeke AJPM. What Are the Factors Determining Authorship andthe Order of the Authors’ Names?, A Study Among Authors of the Nederlands Tijdschrift voorGeneeskunde (Dutch Journal of Medicine). JAMA 1998; 280: 217–218.Innst.O.nr.70 (2005-2006) Innstilling fra kirke-, utdannings- og forskningskomiteen om lov ombehandling av etikk og redelighet i forskningKwok LS. The White Bull effect: abusive coauthorship and publication parasitism. J Med Ethics2005; 31: 554–556.Kyvik S. Forskerutdanning. I Magnus Gulbrandsen M, Smeby JS (red). Forskning veduniversitetene. Oslo: Cappelen Akademisk forlag, 2005.143
Lippman SM, Hong WK. Molecular Markers of the Risk of Oral Cancer. N Engl J Med 2001;344: 1323-1326.Lock S, Wells F, Farthing M eds. Fraud and Misconduct in Biomedical Research. London: BMJBooks, 2001.NOU 2005:1 God forskning – bedre helse. Lov om medisinsk og helsefaglig forskning sominvolverer mennesker, humant biologisk materiale og helseopplysninger (helseforskningsloven).Nylenna M, Simonsen S. Scientific misconduct: a new approach to prevention. The Lancet 2006;367: 1882-1884.Nylenna M. Forfatterskapskriteriene er endret. Tidsskrift for Den Norske Lægeforening 2000;120: 1844.Ot.prp. nr. 58 (2005-2006) Om lov om behandling av etikk og redelighet i forskning.Pignatelli B, Maisonneuve H, Chapuis F. Authorship ignorance: views of researchers in Frenchclinical settings. J Med Ethics 2005; 31: 578–581.Rennie D, Flanagin A, Yank V. The Contributions of Authors. JAMA 2000; 284: 89–91.Rundskriv G-48/75 av 4. mars 1975 ”Regler for granskningskommisjoner”Ruyter KW. Forskningsetikk. Oslo: Gyldendal, 2003.Sheikh A. Publication ethics and the research assessment exercise: reflections on the troubledquestion of authorship. Journal of Medical Ethics 2000; 26: 422–426.Simonsen S, Nylenna M. Helseforskningsrett. Oslo: Gyldendal, 2005.Sox HC. Research Misconduct, Retraction, and Cleansing the Medical Literature: Lessons fromthe Poehlman Case. Annals of Internal Medicine 2006; 144: E-7–E-11.
144
Tranøy KE. Vitenskapen – samfunnsmakt og livsform. Oslo: Universitetsforlaget, 1986.
Uniform Requirements for Manuscripts Submitted to Biomedical Journals: Writing and Editingfor Biomedical Publication – updated February 2006Yank V, Rennie D. Disclosure of Researcher Contributions: A Study of Original ResearchArticles in The Lancet. Annals of Internal Medicine 1999; 130: 661–670.
145