Sundhedsudvalget 2009-10
SUU Alm.del Bilag 287
Offentligt
BETÆNKNING OM DET VIDENSKABSETISKEKOMITÉSYSTEM I DANMARK
BETÆNKNING NR. 1515UDVALGET OM REVISION AF DETVIDENSKABSETISKE KOMITÉSYSTEMMARTS 2010
KolofonBetænkning nr. 1515 om det videnskabsetiske komitésystem i DanmarkUdarbejdet af:Udvalg om revision af det videnskabsetiske komitésystemUdgivet af:Indenrigs- og SundhedsministerietSlotsholmsgade 10-121216 København K.Telefon: 72 26 90 00Telefax: 72 26 90 01E-post:[email protected]EAN–lokationsnummer: 5798000362055Grafisk design:1508 A/SUdgave: 1. udgaveUdgivelsesår: 2010ISBN:978-87-7601-291-5Publikationen er tilgængelig påhttp://www.sum.dk
Indhold
Forord ...................................................................................................................................................................... 41.Udvalgets baggrund og sammensætning .................................................................................................... 51.1. Baggrund og opgaver....................................................................................................................................... 51.2. Udvalgets sammensætning .............................................................................................................................. 61.3. Udvalgets arbejde ............................................................................................................................................ 72.Sammenfatning og konklusioner.................................................................................................................. 82.1. Beskrivelse og analyse af det nuværende videnskabsetiske komitésystem .................................................... 82.2. Udvalgets 40 anbefalinger til fremtidens videnskabsetiske komitésystem ..................................................... 103.Det videnskabsetiske komitésystem – regulering og rammer ................................................................. 153.1. Det videnskabsetiske komitésystems oprettelse og historie .......................................................................... 153.2. Lovgivningen om det videnskabsetiske komitésystem ................................................................................... 163.3. Rammerne for den videnskabsetiske bedømmelse af biomedicinske forskningsprojekter............................. 163.4. Internationale retskilder .................................................................................................................................. 214.Beskrivelse af det eksisterende videnskabsetiske komitésystem .......................................................... 284.1. Det videnskabsetiske komitésystem .............................................................................................................. 284.2. Den Centrale Videnskabsetiske Komité (CVK) .............................................................................................. 294.3. De regionale videnskabsetiske komiteer ........................................................................................................ 324.4. Komitésystemets snitflader til øvrige myndigheder m.v. ................................................................................ 375.Internationale erfaringer - de videnskabsetiske komitesystemer i Norge, Sverige, Finland, Holland ogStorbritannien ....................................................................................................................................................... 435.1. Det norske videnskabsetiske komitésystem ................................................................................................... 455.2. Det svenske videnskabsetiske komitésystem ................................................................................................ 475.3. Det finske videnskabsetiske komitésystem .................................................................................................... 495.4. Det hollandske videnskabsetiske komitésystem ............................................................................................ 505.5. Det britiske videnskabsetiske komitésystem .................................................................................................. 526.Analyse af problemstillinger og udfordringer ved det nuværende videnskabsetiske komitésystem .. 556.1. Indledning – styrkelsen af et velfungerende komitésystem ............................................................................ 556.2. Komitésystemets struktur ............................................................................................................................... 566.3. Opgaver og opgaveportefølje ......................................................................................................................... 626.4. Forsøgspersoners deltagelse i forsøg ............................................................................................................ 726.5. Sagsbehandling og procedurer ...................................................................................................................... 777.Udvalgets 40 anbefalinger til indretningen af fremtidens videnskabsetiske komitésystem ................. 877.1. Indledning – forankring, udvikling og tendenser ............................................................................................. 877.2. En fremtidssikret struktur ............................................................................................................................... 917.3. Ny opgavefordeling og klar opgaveportefølje ................................................................................................. 987.4. Forbedring af muligheder for at forske i akutte situationer ........................................................................... 1077.5. Smidig sagsbehandling ................................................................................................................................ 1087.6. Økonomiske konsekvenser .......................................................................................................................... 113Bilag 1. Kommissorium for udvalg om revision af det videnskabsetiske komitésystem............................. 114Bilag 2. Skriftlige bilag til udvalgets arbejde.................................................................................................... 116Bilag 3. Mindretalsudtalelse fra Danske Regioners repræsentant vedr. betænkningens anbefalinger ...... 117
3
Forord
Vi har i Danmark et velfungerede videnskabsetisk komitésystem og en god, lang tradition på området, som posi-tivt har bidraget til at give den danske befolkning tillid til at deltage i sundhedsvidenskabelige forsøg. Men på enrække områder trænger systemet til et serviceeftersyn.Det har været en stor fornøjelse at være formand for dette udvalg, som repræsenterer en lang række af de vigtig-ste interessenter på området – patienterne, forskningsverdenen, industrien, sundhedsmyndighederne, regionernesamt repræsentanter fra det nuværende komitésystem.Udvalgets arbejde har taget afsæt i, at et godt sundhedsvæsen med høj behandlingskvalitet til gavn for patienter-ne forudsætter, at der forskes på sundhedsområdet. Udvalget har set det som sin opgave at kortlægge de rele-vante problemstillinger og udfordringer ved det nuværende komitésystem, identificere generelle tendenser på detvidenskabsetiske område samt kigge ud over landets grænser for at hente inspiration til at styrke det danske ko-mitésystem. Overordnet vil udvalget gerne bidrage til at tegne et billede af, at god videnskabsetik og god forsk-ning er hinandens forudsætninger og derfor skal ses i sammenhæng.På den baggrund præsenterer udvalget 40 konkrete anbefalinger til indretningen af fremtidens videnskabsetiskekomitésystem. Ambitionen er et komitésystem, som dels sikrer forsøgspersonernes sikkerhed og integritet og gi-ver befolkningen tillid til at deltage i sundhedsvidenskabelige forsøg, dels bidrager til at sikre dansk sundheds-forskning en international førerposition.Det er udvalgets vurdering, at disse 40 anbefalinger kan bidrage til at sikre et velfungerende og fremtidssikretkomitésystem til gavn for både forsøgspersoner og den sundhedsvidenskabelige forskning.
Mogens Hørder.
4
1. Udvalgets baggrund ogsammensætning
1.1.
Baggrund og opgaver
Det videnskabsetiske komitésystem har overordnet til formål at sikre, at biomedicinske forskningsprojekter gen-nemføres videnskabsetisk forsvarligt. I forhold til at skabe mulighed for udvikling af ny værdifuld viden går hensy-net til forsøgspersonernes rettigheder, sikkerhed og velbefindende forud for videnskabelige og samfundsmæssigeinteresser.Siden den første komitélov fra 1992 er der løbende foretaget revisioner af lovgivningen i forhold til det viden-skabsetiske komitésystem, senest i 2006. Disse lovrevisioner har imidlertid primært været gennemført som følgeaf anden lovgivning og international regulering.Det har i flere sammenhænge været tilkendegivet, bl.a. i forbindelse med de løbende lovrevisioner, at der er be-hov for en mere gennemgribende analyse af det videnskabsetiske komitésystem med henblik på at vurdere, omden nuværende struktur og styring af komitésystemet er den mest hensigtsmæssige.Erfaringer fra de regionale komiteers arbejde viser også, at praksis er uensartet, samt at lovgivningen på flereområder er uklar, hvilket giver sig udslag i fortolkningstvivl.Derudover er spørgsmålet om den løbende kontrol af de godkendte forskningsprotokoller, som i henhold til komi-téloven skal udøves af de regionale komiteer, fortsat uafklaret.På den baggrund besluttede ministeren for sundhed og forebyggelse i foråret 2009 at nedsætte et bredt sam-mensat udvalg, som fik til opgave at udarbejde en betænkning om revision af det videnskabsetiske komitésystemmed henblik på en revision af lovgivningen herom.Udvalgets kommissorium er vedlagt som bilag 1 til betænkningen.Det fremgår af kommissoriet, at udvalget har til opgave at:•Beskrive og analysere den eksisterende struktur, opgaveportefølje og opgavevaretagelse for det vi-denskabsetiske komitésystem, herunder samspillet mellem de regionale komiteer og Den Centrale Vi-denskabsetiske Komité.•Opstille forslag til en fremtidig forenklet struktur, som sikrer:oStyring: Ensartet og effektiv sagsbehandling, som sikrer, at såvel forsøgspersoners som forsk-ningens interesser tilgodeses.
5
oOpgaveportefølje og opgavevaretagelse: Velafgrænset opgaveportefølje og ensartet opgavevare-tagelse under hensyntagen til dansk og international lovgivning, især GCP-direktivet og Europa-rådets biomedicinske forskningsprotokol.oOpfølgning og kontrol: Ensartet og effektiv opfølgning og kontrol med godkendte forskningsproto-koller.Der skal endvidere tages hensyn til de spørgsmål, som er blevet rejst i forbindelse med tidligere lovrevisioner.Udvalgets forslag til ny struktur må samlet set ikke medføre offentlige merudgifter.Udvalget skal afgive sin betænkning ultimo 2009.
1.2.
Udvalgets sammensætning
Udvalget er bredt sammensat af en lang række vigtige interessenter på området. Udvalget har haft følgende med-lemmer:•••••••••••••••••Professor, dr. med Mogens Hørder (formand) (udpeget af ministeren for sundhed og forebyggelse).Afdelingschef Vagn Nielsen, Indenrigs- og Sundhedsministeriet (udpeget af ministeren for sundhed ogforebyggelse).Vicedirektør Claus Munk Jensen, Sundhedsstyrelsen (udpeget af ministeren for sundhed og forebyggel-se). Indtil 1. oktober 2009.Afdelingslæge Peter Saugmann-Jensen, Sundhedsstyrelsen. Fra 1. oktober 2009.Specialkonsulent, farmaceut Lene Grejs Petersen, Lægemiddelstyrelsen (udpeget af ministeren forsundhed og forebyggelse).Afdelingschef Ole Allin Jensen, Statens Serum Institut (udpeget af ministeren for sundhed og forebyg-gelse).Chefkonsulent, cand.jur. Charlotte Elverdam, Forsknings- og Innovationsstyrelsen (udpeget efter indstil-ling af Ministeriet for Videnskab, Teknologi og Udvikling).Overlæge, dr. med. Poul Jaszczak, Herlev Sygehus (udpeget efter indstilling af Lægeforeningen).Specialkonsulent, ph.d. (pharm) Jakob Bjerg Larsen, Lægemiddelindustriforeningen (udpeget efter ind-stilling af Lægemiddelindustriforeningen).Sundhedsdirektør Jane Kraglund, Region Syddanmark (udpeget efter indstilling af Danske Regioner).Indtil 20. oktober 2009.Kvalitetsdirektør Lars Onsberg Henriksen, Region Sjælland (udpeget efter indstilling af Danske Regio-ner). Fra 20. oktober 2009.Formand for CVK, lægelig direktør, dr. med. Johannes Gaub, Sygehus Lillebælt – Vejle Sygehus (udpe-get efter indstilling af CVK).Medlem af CVK, professor, ph.d. Mette Rasmussen, formand for Komité A, Region Hovedstaden, Far-maceutiske Fakultet, Københavns Universitet (udpeget efter indstilling af CVK).Medlem af CVK, lærer Hans Aarup Jegindø, næstformand i Komité 2, Region Midtjylland (udpeget efterindstilling af CVK).Senior konsulent Annette Wandel, Danske Patienter (udpeget efter indstilling af Danske Patienter).Professor, dr. jur. Mette Hartlev, Københavns Universitet (udpeget efter indstilling af Det Etiske Råd).Professor, ledende overlæge, dr. med. Raben Rosenberg, Center for Psykiatrisk Forskning, Århus Uni-versitetshospital Risskov (udpeget efter indstilling af Det Frie Forskningsråd Sundhed og Sygdom).
6
Sekretariatet for udvalgsarbejdet er varetaget af Indenrigs- og Sundhedsministeriet.
1.3.
Udvalgets arbejde
Udvalget blev nedsat i maj 2009.Udvalget har holdt syv møder i perioden den 27. maj 2009 til den 9. december 2009, herunder en workshop hvorde overordnede temaer for udvalgets anbefalinger blev drøftetDerudover har udvalgets formand og sekretariatet været på studiebesøg hos den regionale komité i Region Syd-danmark, ligesom udvalget på et af sine møder har haft besøg af sekretariatschefen for den centrale videnskab-setiske komité i Norge. Formanden har ligeledes deltaget i en række konferencer om det videnskabsetiske komi-tésystem, herunder CVKs seneste årsmøde. Endelig har udvalget modtaget en lang række notater om relevanteproblemstillinger på området, jf. bilag 2.Betænkningens afsnit 4.3, som indeholder en beskrivelse af de regionale videnskabsetiske komiteer, er baseretpå bidrag fra de regionale sekretariater og har også efterfølgende været i høring hos disse.I den første halvdel af udvalgets arbejdsperiode har fokus været på beskrivelse og analyse af det eksisterendevidenskabsetiske komitésystem, regelgrundlaget på området samt indhentelse af udenlandske erfaringer. På denbaggrund har udvalget i den sidste halvdel af sin arbejdsperiode fokuseret på udvikling og drøftelse af udvalgets40 anbefalinger til indretningen af fremtidens videnskabsetiske komitésystem.
7
2. Sammenfatning ogkonklusioner
Udvalget om revision af det videnskabsetiske komitésystem præsenterer hermed 40 konkrete forslag og anbefa-linger, som kan skabe rammerne for at gøre et godt dansk komitésystem endnu bedre til gavn for både forsøgs-personer og den sundhedsvidenskabelige forskning. Anbefalingerne er udarbejdet på baggrund af en beskrivelseog en analyse af det nuværende videnskabsetiske komitésystem.
2.1.
Beskrivelse og analyse af det nuværende videnskabsetiske komi-tésystem
Kapitel 3giver indledningsvist en kort introduktion til det danske komitésystems oprettelse og historie. Derudoverindeholder kapitlet en beskrivelse af den nuværende lovgivning om det videnskabsetiske komitésystem og de ret-lige rammer for den videnskabsetiske bedømmelse af biomedicinske forskningsprojekter, som komitéloven fast-lægger, herunder hvad der skal anmeldes, hvilke kriterier der gælder for godkendelse af et forskningsprojekt samtregler om information og samtykke. Komitésystemet præges desuden af en række internationale retskilder. Derforindeholder kapitlet også en overordnet introduktion til EU-direktivet om god klinisk praksis (GCP-direktivet), Euro-parådets Bioetikkonvention samt Helsinki-deklarationen udarbejdet af Verdenslægeforsamlingen.Kapitel 4indeholder en beskrivelse af det eksisterende videnskabsetiske komitésystem, herunder en beskrivelseaf Den Centrale Videnskabsetiske Komité (CVK) og de regionale komiteer med hensyn til opgaver, organiseringog sammensætning, sagsbyrder, økonomi, personale og sekretariat samt sagsgange. Set i lyset af, at komitésy-stemet virker i samspil med en række andre myndigheder og aktører, gives der desuden en beskrivelse af de snit-flader, komitésystemet har til Lægemiddelstyrelsen, Forskningsrådene og arbejdet med god videnskabelig prak-sis, Datatilsynet og Det Etiske Råd.Der sker en stigende internationalisering i disse år – både i forhold til det sundhedsvidenskabelige forskningsom-råde og på det videnskabsetiske område. Med henblik på at sikre at udvalgets analyser og anbefalinger har ettilstrækkeligt bredt fundament, har udvalget valgt at inddrage udenlandske erfaringer. Ikapitel 5gives derfor enkortfattet beskrivelse og sammenligning af de videnskabsetiske komitésystemer i Norge, Sverige, Finland, Hol-land og Storbritannien med fokus på, hvordan de forskellige komitésystemer er organiseret, hvilke opgaver hen-holdsvis den centrale komité og de decentrale komiteer har, hvordan anmeldelse af forsøg foregår, samt hvordanopgaven i forhold til opfølgning og kontrol løftes. Sammenligningen viser, at der generelt er stor variation i opbyg-ningen af komiteerne, og at det danske komitésystem har en række lighedstræk med de øvrige landes komitésy-stemer, men også en række særtræk. Det gælder fx flertallet af lægmænd i såvel CVK som de regionale komite-er, samt at de regionale komiteer er udpeget af et regionalt politisk niveau.Kapitel 6indeholder en analyse af de problemstillinger og udfordringer, som efter udvalgets opfattelse eksisterer iforhold til det nuværende videnskabsetiske komitésystem. Analysen er struktureret i forhold til følgende temaer:
8
••••
Komitésystemets struktur, herunder CVKs og de regionale komiteers sammensætning og rammevilkår.Komitésystemets opgaver og opgaveportefølje, herunder opfølgning og kontrol.Forsøgspersonens deltagelse i forsøg.Komitésystemets sagsbehandling og procedurer.
I forhold til komitésystemets struktur viser udvalgets analyse, at komitésystemets nuværende decentrale struktur,hvor de regionale komiteer er forankret i de fem regioner, både har en række fordele, men også en række ulem-per. Fordelen er en bred forankring, sammenhæng til det regionale sundhedsvæsen og nærhed til de størresundhedsvidenskabelige forskningsmiljøer. Svagheden er, at opgavevaretagelsen i flere sammenhænge er uens-artet på tværs af de regionale komiteer. CVKs nuværende sammensætning og lovgivningsmæssige kompetencerindebærer ligeledes, at det er vanskeligt for CVK at sikre koordinering og styring på tværs af de regionale komite-er. Derudover ligger der også en udfordring i, at regionerne har vanskeligt ved at rekruttere særligt forskningsakti-ve medlemmer til de regionale komiteer. På den baggrund har udvalget drøftet komitésystemets overordnedestruktur, sammensætning af såvel CVK som de regionale komiteer samt organisering af sekretariatsfunktionen.Med hensyn til komitésystemets opgaver og opgaveportefølje viser udvalgets analyse, at opgaverne for de vi-denskabsetiske komiteer ikke i alle tilfælde er helt klare, og at der derfor kan opstå tvivl om, hvorvidt et projekt eranmeldelsespligtigt, herunder om forsøg med anonymt, biologisk materiale skal anmeldes til komitésystemet. Ud-valget har også overvejet arbejdsdelingen mellem CVK og de regionale komiteer, bl.a. set i lyset af at det er ud-valgets vurdering, at der er behov for større ensartethed og gennemsigtighed i systemet. På den baggrund harudvalget bl.a. drøftet, om CVK skal behandle sager på særligt komplekse forskningsområder.I forhold til opfølgning og kontrol fremgår det af analysen, at der i dag kun i begrænset og varierende omfang fo-kuseres på opfølgning og kontrol i forhold til de godkendte forsøgsprojekter, uagtet at dette er en lovfæstet opga-ve for regionerne. Analysen viser ligeledes, at der kun i meget begrænset omfang arbejdes med kvalitetssikringog kvalitetsudvikling. Det er udvalgets vurdering, at kvalitetsudvikling, opfølgning og kontrol skal ses i tæt sam-menhæng – og at udviklingen af disse opgaver kan styrke komitésystemet.Med hensyn til forsøgspersonens deltagelse i forsøg viser udvalgets analyse, at de nuværende regler om forsk-ning i akutte situationer, herunder kravet om stedfortrædende samtykke ved forskning i akutte situationer medlægemidler, indeholder en række begrænsninger, som betyder, at det i en række tilfælde er særdeles vanskeligtat gennemføre forskningsprojekter i akutte situationer.I forhold til komitésystemets sagsbehandling og opgavevaretagelse viser analysen, at de nuværende beslut-ningsprocedurer i de regionale komiteer kan optimeres. Derudover understreges det, at der er behov for at sikrestørre ensartethed og gennemsigtighed i sagsbehandlingen, og at dette fx kan ske i form af centrale retningslinjerog vejledninger. Analysen viser ligeledes, at de nuværende anmeldelsesprocedurer på en række områder kansmidiggøres, bl.a. med henblik på at fastholde Danmark som et attraktivt sted at udføre klinisk forskning. Detgælder fx kravet om dansksprogede protokoller, samt at det i de fleste komiteer i dag ikke er muligt at indsendealt ansøgningsmaterialet elektronisk.
9
2.2.
Udvalgets 40 anbefalinger til fremtidens videnskabsetiske komité-system
På baggrund af ovennævnte beskrivelser og analyser præsenterer udvalget ikapitel 740 anbefalinger til indret-ningen af fremtidens videnskabsetiske komitésystem. Udvalgets ambition er et komitésystem, som på én ogsamme tid sikrer forsøgspersonernes integritet og velfærd, giver befolkningen tillid til at deltage i sundhedsviden-skabelige forsøg, samt bidrager til at sikre dansk sundhedsforskning en international førerposition.Udvalgets anbefalinger tager udgangspunkt i række generelle tendenser og pejlemærker, som udvalget ser påområdet, og som udvalget gerne ser forankret og yderligere udviklet i det danske komitésystem.Overordnet vil udvalget gerne bidrage til at tegne et billede af, at god videnskabsetik og god forskning er hinan-dens forudsætninger og derfor skal ses i sammenhæng. I den forbindelse ser udvalget også, at udviklingen går iretning af højere grad af direkte og synlig ansvarlighed for videnskabsetikken hos de forsøgsansvarlige. Udvalgetønsker at understrege, at det er en afgørende forudsætning for et moderne og velfungerende sundhedsvæsen, atsundhedsforskningen er i top og har attraktive rammevilkår. Her spiller det videnskabsetiske komitésystem en vig-tig rolle. Danske patienter har en berettiget forventning om at modtage den nyeste behandling og dermed også eninteresse i, at der gennemføres videnskabelige forsøg. Det er udvalgets vurdering, at det er vigtigt at holde sigdette for øje. Hensynet til forsøgspersoners rettigheder, sikkerhed og integritet må dog altid have førsteprioritet.Den enkelte forsøgsperson skal kunne nære tillid til, at der er de rigtige rammer for at deltage i sundhedsviden-skabelige forsøg.Komitésystemets fremtidige struktur – regionale komiteer og en nytænkt national komitéUdvalget ønsker et komitésystem, som har bred legitimitet og folkelig forankring, og som samtidig er effektivt oggennemsigtigt til gavn for både forsøgspersoner og forskningens interesser. Det er udvalgets vurdering, at dissehensyn bedst tilgodeses, hvis komitésystemet forankres i politisk udpegede systemer. En demokratisk repræsen-tation er med til at sikre en afspejling af befolkningens holdninger til den videnskabsetiske kultur, som til stadighedforandres og nuanceres i takt med forskningens udvikling.Det er samtidig udvalgets vurdering, at det er nødvendigt med to niveauer – et nationalt niveau og et regionalt ni-veau – med hver deres opgaveportefølje og ansvarsområde. Udvalget anbefaler samtidig, at den nationale komiténytænkes, og at det nuværende CVK omdannes til Den Nationale Videnskabsetiske Komité.
Udvalget anbefaler:1.2.Regionale komiteer forankret i de fem regioner.En styrket national komité med udvidet opgaveportefølje og flere beføjelser.
Bred sammensætning af den nationale komité og de regionale komiteerSammensætningen af både den nationale komité og de regionale komiteer skal sikre tilstedeværelse af de nød-vendige kompetencer med henblik på, at komiteerne kan løfte deres opgaver på en velkvalificeret og smidig må-de. Set i lyset af komitésystemets opgaveportefølje mener udvalget, at komiteerne bør bestå af både lægmændog fagkyndige.
Udvalget anbefaler:3.4.10
Bred sammensætning af den nationale komité og de regionale komiteer med både lægmænd og fag-kyndige.Øget fokus på ligestilling i sammensætningen af komiteerne.
En nytænkt national komité på 13 medlemmer udpeget af indenrigs- og sundhedsministerenDet er udvalgets anbefaling, at den nationale komité skal slankes, sammensættes og udpeges på en anden må-de. Det er udvalgets vurdering, at det vil bidrage til at sikre en styrket national komité.
Udvalget anbefaler:5.6.7.En nytænkt national komité med 13 medlemmer og regional repræsentation i form af et medlem frahver region.Etablering af effektivt kontaktforum mellem formandskaberne i den nationale komité og de regionalekomiteer.Ansvaret for at udpege medlemmer til den nationale komité forankres hos indenrigs- og sundheds-ministeren.
De regionale komiteer forankres bredt i de fem regionerUdvalget anbefaler, at de regionale komiteer forankres i de fem regioner. Det kan sikre sammenhæng til det regi-onale sundhedsvæsen og regionernes forpligtigelse til at bedrive forskning. Det er desuden udvalgets opfattelse,at det er nødvendigt at gøre det mere attraktivt at være medlem af en regional komité.Udvalget anbefaler:8.9.De regionale komiteer forankres bredt i de fem regioner, og medlemmerne udpeges af regionsråde-ne.Flertal af lægmænd i de regionale komiteer.10. Medlemsantal på 7, 9 eller 11 medlemmer i de regionale komiteer.11. Formændene for de regionale komiteer vælges blandt komiteernes forskningsaktive.12. Det skal være mere attraktivt at være komitémedlem.
Styrkelse af sekretariatsfunktionerne og større inddragelse af sagkyndige/ekspertbistandUdvalget anbefaler, at der sker en styrkelse af sekretariatsfunktionerne, bl.a. med henblik på at sikre en større ogmere faglig kvalificeret sagsforberedelse på sekretariatsniveau, samt at den eksisterende mulighed for indhentel-se af ekspertbistand i højere grad anvendes.
Udvalget anbefaler:13. Sekretariatsfunktionerne organiseres regionalt og nationalt som komiteerne.14. Styrkelse af sekretariatsfunktionerne med sundhedsvidenskabelige kompetencer.15. Større faglig sagsforberedelse i sekretariaterne.16. Større inddragelse af sagkyndige/ekspertbistand.
Klar afgrænsning af komitésystemets opgaveområdeUdvalget ønsker en klar afgrænsning af komitésystemets opgaveområde.
11
Udvalget anbefaler:17. Definitionen af hvilke projekter, der skal anmeldes, ændres fra biomedicin til sundhedsvidenskab.18. Komiteerne skal vurdere, om et projekt tilvejebringer ny viden eller undersøger eksisterende viden,som kan berettige forsøgets gennemførelse.19. Anonymt, biologisk materiale undtages anmeldelsespligten.20. Den nuværende regulering i forhold til biobanker fastholdes.
Ændret arbejdsdeling mellem den nationale komité og de regionale komiteerDet er udvalgets vurdering, at visse sagstyper er så komplekse, at de i en periode bør behandles af den nationalekomité med henblik på, at der kan fastlægges en ensartet praksis, samt at den nationale komité i højere grad skalfølge udviklingen på sundhedsområdet og det videnskabsetiske område, også internationalt, og sikre at nye ud-viklingstendenser indarbejdes i dansk praksis.Udvalget anbefaler:21. Den nationale komité skal behandle sager på særligt komplekse områder.Mulighed for fleksibel arbejdsdeling mellemmere proaktivkomitéertil at følge udviklingen på sundhedsområdet22. Den nationale komité skal værede regionalei forholdog det videnskabsetiske område.
Mulighed for fleksibel arbejdsdeling mellem de regionale komiteerUdvalget anbefaler, at den forsøgsansvarlige fortsat skal anmelde forsøget til den regionale komité, hvor ved-kommende har sit virke, men at der skal være mulighed for, at regionerne kan fordele sagerne imellem sig.Udvalget anbefaler:23. Anmeldelse sker regionalt – med mulighed for at regionerne kan fordele sagerne imellem sig.
Aktivt samarbejde og koordinering med relevante myndigheder og aktørerUdvalget anbefaler, at komitésystemet aktivt samarbejder og koordinerer med relevante myndigheder og aktører,herunder Lægemiddelstyrelsen, Datatilsynet, forskningsrådene og Det Etiske Råd.
Udvalget anbefaler:24. Komitésystemet skal aktivt samarbejde og koordinere med relevante myndigheder og aktører.
Fokus på kvalitetsudvikling, opfølgning og kontrolDet er udvalgets vurdering, at opfølgning og kontrol i forhold til godkendte forskningsprojekter er en vigtig del afkomitésystemets arbejde. Det er ligeledes udvalgets vurdering, at kvalitetsudvikling og kontrol hænger tæt sam-men, samt at et bredere fokus på kvalitetssikring og læring er vigtigt – både for brugerne af komitésystemet ogkomiteernes medlemmer.
12
Udvalget anbefaler:25. En målrettet og gradueret opfølgning og kontrol baseret på en samlet vurdering af forsøgsprojekter-ne.26. Komitésystemet skal have de nødvendige lovgivningsmæssige kompetencer til at løfte kontrolopga-ven.27. Fokus på kvalitetsudvikling og læring, herunder inddragelse af forsøgspersoner.
Forbedring af muligheder for at forske i akutte situationerUdvalget ønsker, at mulighederne for at forske i akutte situationer forbedres under nøje iagttagelse af forsøgsper-sonernes rettigheder og sikkerhed.
Udvalget anbefaler:28. Der skal arbejdes for at øge mulighederne for forskning i akutte situationer – under iagttagelse af for-søgspersoners rettigheder, sikkerhed og velbefindende.
Effektive beslutningsprocedurerUdvalget ønsker at optimere beslutningsprocedurerne i de regionale komiteer, bl.a. med henblik på at sikre smi-dige og effektive sagsgange og aflaste arbejdsbyrden i de regionale komiteer.
Udvalget anbefaler:29. De regionale komiteer kan afgøre sager ved flertalsafgørelser.30. Der skal skabes mulighed for, at formandskabet i en komité kan træffe afgørelse i ukomplicerede ogrutineprægede sager.
Større ensartethed og gennemsigtighedBåde af hensyn til forsøgspersonerne og forskerne ønsker udvalget at bidrage til større ensartet og gennemsig-tighed i komitésystemets opgavevaretagelse.
Udvalget anbefaler:31. Den nationale komité skal i større omfang udarbejde retningslinjer og indstille forslag til forskrifter tilindenrigs- og sundhedsministeren.32. Løbende kvalitetsudvikling og kvalitetssikring i forhold til komitésystemet - testsager, audits og styr-ket uddannelsesprogram.33. Samlet årsberetning for hele komitésystemet.
13
Lettere anmeldelsesprocedurer og mindre bureaukratiDet er udvalgets anbefaling, at anmeldelsesprocedurerne m.v. til det videnskabsetiske komitésystem på en rækkeområder kan gøres mere smidige og mindre bureaukratiske.Udvalget anbefaler:34. Kravet om dansksprogede protokoller skal fjernes.35. Sponsor og den forsøgsansvarlige skal sammen indsende ansøgning til den relevante komité.36. Alt ansøgningsmateriale skal kunne indsendes elektronisk, og der skal arbejdes for at harmonisereLægemiddelstyrelsens og komitésystemets ansøgningsskemaer.37. Ens krav til vurdering af, hvornår en ansøgning er behørigt udformet - hurtigere sagsbehandlingstid.38. Større mulighed for delegation fra den forsøgsansvarlige i forbindelse med underskrift på samtykke-erklæringer.39. Europæisk harmonisering vedr. indberetninger i forbindelse med lægemiddelforsøg – fortsat årligindsendelse af oversigt over alle alvorlige bivirkninger, men ophævelse af dansk krav om indberet-ning af hændelser.40. Informationsindsatsen over for forskerne skal styrkes ved tværgående initiativer.
14
3. Det videnskabsetiskekomitésystem – regulering ogrammer
3.1.
Det videnskabsetiske komitésystems oprettelse og historie
Som det første land i verden fik Danmark i 1980 et egentligt komitésystem.Baggrunden for komitésystemet var Helsinki-deklaration I, som blev vedtaget af Verdenslægesammenslutningen i1964 og omhandlede lægers udførelse af forsøg med mennesker. Vedtagelsen var en udløber af Nürnberg-processen, hvor det blev afsløret, at læger groft havde krænket menneskerettighederne.En udbygning af deklarationen blev vedtaget i 1975 (Helsinki II). Indholdet var generelle principper for alle biome-dicinske forsøg, hvor den vigtigste nydannelse var kravet om en udarbejdelse af en forsøgsprotokol, som skulleforelægges en uafhængig komité samt nogle bestemmelser om henholdsvis kliniske og ikke-kliniske forsøg.Det danske komitésystem var i første omgang en frivillig ordning, der blev gennemført udenom Folketinget. Sy-stemet var kendetegnet ved to hovedprincipper: For det første skulle komiteerne være regionale. Der var dog frastarten tale om et toinstanssystem, hvilket betød, at også CVK blev oprettet i 1980. For det andet skulle der væreen ligelig repræsentation af forskere og lægmedlemmer i komiteerne. Systemet byggede på rent privat aftaleret-ligt grundlag.I 1992 blev området lovreguleret. Dette skete ved lov om et videnskabsetisk komitésystem og behandling af bio-medicinske forskningsprojekter (lov nr. 503 af 24. juni 1992). Loven tilstræbte først og fremmest at skabe retligtbindende rammer for den videnskabsetiske bedømmelse af biomedicinske forskningsprojekter. Loven indeholdtderfor bl.a. regler om oprettelse af et videnskabsetisk komitésystem, lovpligtig anmeldelse af biomedicinskeforskningsprojekter, de overordnede principper for bedømmelsen af projekter samt for kontrol og opfølgning. Medhensyn til organisering og struktur var der tale om lovfæstelse af den hidtidige model, bortset fra at loven indførteflertal af lægmedlemmer.Sidenhen er loven blevet ændret i takt med, at man har fået flere erfaringer, og man har kunnet se behovet for atændre på bestemte områder. Den seneste udgave af loven er fra 2003 med ændringer i 2006. Internationaleretskilder som direktivet om god klinisk praksis fra 2001 og Europarådets bioetik-konvention fra 1997 har naturlig-vis også præget udviklingen af det videnskabsetiske komitésystem.I dette kapitel beskrives:••Lovgivningen om det videnskabsetiske komitésystem (afsnit 3.2).Rammerne for den videnskabsetiske bedømmelse af biomedicinske forskningsprojekter (afsnit 3.3).
15
•
Internationale retskilder (afsnit 3.4).
3.2.
Lovgivningen om det videnskabsetiske komitésystem
Det videnskabsetiske komitésystem er reguleret af lov nr. 402 af 28. maj 2003 om et videnskabsetisk komitésy-stem og behandling af biomedicinske forskningsprojekter med senere ændringer ved lov nr. 272 af 1. april 2006og lov nr. 440 af 9. juni 2004 (§ 13) om Det Etiske Råd.Med hjemmel i loven er udstedt:••Bekendtgørelse nr. 806 af 12. juli 2004 om information og samtykke ved inddragelse af forsøgspersoneri biomedicinske forskningsprojekter (informationsbekendtgørelsen).Bekendtgørelse nr. 260 af 14. april 2004 om forskningsfaglige fora og overgangsbestemmelser vedrø-rende behandling af ansøgninger om godkendelse af biomedicinske forskningsprojekter anmeldt til detvidenskabsetiske komitésystem før den 1. maj 2004.•Bekendtgørelse nr. 795 af 24. september 1992 om gebyr for behandling af biomedicinske forskningspro-jekter i de regionale videnskabsetiske komiteer.Herudover har CVK udarbejdet vejledning nr. 9688 af 6. oktober 2008 om anmeldelse m.v. af et biomedicinskforskningsprojekt til det videnskabsetiske komitésystem.Endvidere er en række internationale retskilder også relevante for det videnskabsetiske komitésystem, herunder:•Europa-Parlamentets og Rådets direktiv 2001/20/EF af 4. april 2001 om indbyrdes tilnærmelse af med-lemsstaternes love og administrative bestemmelser om anvendelse af god klinisk praksis ved gennemfø-relse af kliniske forsøg med lægemidler til human brug (GCP-direktivet).•Europarådets konvention af 4. april 1997 om beskyttelse af menneskerettigheder og menneskelig vær-dighed i forbindelse med anvendelse af biologi og lægevidenskab: Konvention om menneskerettighederog biomedicin (bioetikkonventionen) samt tillægsprotokoller hertil.•Helsinki-deklarationen.
3.3.
Rammerne for den videnskabsetiske bedømmelse af biomedicin-ske forskningsprojekter
Komitéloven fastlægger de retlige rammer for den videnskabsetiske bedømmelse af biomedicinske forskningspro-jekter. I loven er komitésystemets opbygning og kompetencer beskrevet. Nedenfor er en række af de grundlæg-gende regler beskrevet overordnet. For en detaljeret gennemgang af komiteernes sammensætning og struktur,samt opgavefordeling mellem det regionale og centrale niveau henvises til kapitel 4. I kapitel 4 gennemgås desu-den komitésystemets snitflader til øvrige myndigheder samt de tidsfrister, som komiteernes arbejde er underlagt.Det videnskabsetiske komitésystems opgave er ifølge komitélovens § 1, stk. 3, at sikre, at biomedicinske forsk-ningsprojekter gennemføres videnskabsetisk forsvarligt. I forhold til at skabe mulighed for at udvikling af ny, vær-difuld viden går hensynet til forsøgspersonernes rettigheder, sikkerhed og velbefindende forud for videnskabeligeog samfundsmæssige interesser.
16
Indledningsvis introduceres nedenfor en række begreber, som anvendes gennem rapporten:
Begreber•••••••En celle: Den mindste strukturelle og funktionelle enhed i organismen (fx et rødt blodlegeme, enhjertecelle, en nervecelle, en muskelcelle).Et væv: En funktionel og strukturel enhed, som består af forskellige slags samarbejdende celler ud-viklet fra en fælles ”moden” stamcelle (fx blod, bindevæv, muskelvæv).Et organ: En funktionel og strukturel enhed af flere samvirkende væv (fx lever, nyre, hjerte, hjerne,knoglemarv, fuldhud).Biologisk materiale: En fælles betegnelse for enhver funktionel eller strukturel bestanddel af celler,væv eller organer, herunder også arvemateriale.En cellelinje: En bestand af celler frembragt fra én celle eller en gruppe af ”ens” celler ved fortsattecelledelinger under kunstige vækstbetingelser i laboratoriet.En cellekultur: Enhver levende bestand af celler, ens eller forskellige, som vedligeholdes i kortereeller længere tid under kunstige vækstbetingelser i laboratoriet.En stamcelle: Fælles betegnelse for celler, som både er i stand til at forny (opformere) sig selv overtid (for nogles vedkommende ubegrænset længe), og kan frembringe mere specialiserede celler.
3.3.1.
Hvad skal anmeldes
De videnskabsetiske komiteer skal godkende biomedicinske forsøg, der ønskes gennemført i Danmark. Biomedi-cinske forskningsprojekter er i komitéloven defineret som:”Et projekt, der indebærer forsøg på levendefødte menneskelige individer, menneskelige kønsceller, der agtesanvendt til befrugtning, menneskelige befrugtede æg, fosteranlæg og fostre, væv, celler og arvebestanddele framennesker, fostre og lignende samt afdøde. Endvidere omfattes forsøg, der har til formål at afdække eller efter-prøve de kliniske, farmakologiske eller andre farmakodynamiske virkninger, at identificere bivirkninger eller at un-dersøge farmakokinetik (optagelse, fordeling, nedbrydning eller udskillelse) med det formål at få viden om læge-midlers sikkerhed eller virkning. Endelig omfattes klinisk afprøvning af medicinsk udstyr, jf. dog stk. 2.”Informationsbekendtgørelsens § 3 indeholder desuden en definition af et biomedicinsk forskningsprojekt. Detfremgår heraf, at der ved et biomedicinsk forskningsprojekt forstås en virksomhed, der er tilrettelagt efter viden-skabelig metode, og som tilsigter at frembringe ny, værdifuld viden om menneskets biologiske og psykologiskeprocesser enten i forhold til raske mennesker eller til at forebygge, erkende, lindre, behandle eller helbrede syg-dom, sygdomssymptomer og smerter, herunder påvirke legemsfunktioner.Det bemærkes, at det i lovbemærkningerne fra lov nr. 503 af 24. juni 1992 fremgår, at der ”vedforskning forståsen planlagt virksomhed, som har til formål systematisk at erhverve viden om sygdommes opståen og om forebyg-gelse, diagnostik og behandling heraf. Virksomheden skal være planlagt, og formålet skal være en systematiskvidenserhvervelse. Derved adskilles forskningen fra forebyggelse, diagnostik og behandling i konkrete situationereller over for konkrete individer/personer, hvor formålet alene er at opnå en forbedring af disses livskvalitet, menikke en planlagt systematisk videnserhvervelse.”Som det fremgår af ovenstående, skal ethvert biomedicinsk forskningsprojekt anmeldes til den regionale vi-denskabsetiske komité. Projekter, der ikke skal anmeldes, jf. §§ 7, nr. 1 og 8, er:
17
•
Ikke-interventionsforsøg med lægemidlerIkke-interventionsforsøg med lægemidler er undersøgelser, hvor et eller flere lægemidler ordineres somnormalt efter betingelserne i markedsføringstilladelsen. Beslutningen om at ordinere det pågældendelægemiddel er klart adskilt fra beslutningen om at inkludere patienten i en undersøgelse. Selve behand-lingen sker ikke efter en forsøgsprotokol, men følger almindelig praksis. Der foregår ingen ekstra diag-nostiske eller kontrolmæssige procedurer, og der skal bruges epidemiologiske metoder til at analyserede indsamlede data.Ikke-interventionsforsøg med lægemidler skal ikke anmeldes til komitésystemet, da patienten ikke tilføjesen selvstændig belastning eller risiko, og det primære formål med at ordinere lægemidlet er behandling.
•
Nye behandlingerVed indførelse af en ny behandling, herunder undersøgelsesmetode mv., skal dette ikke anmeldes tilden videnskabsetiske komité, hvis den nye behandling er dokumenteret bedre end den gamle. Dette for-udsætter bl.a., at der foreligger tilstrækkeligt omfattende kliniske erfaringer, der på en overbevisendemåde belyser effekt, bivirkninger og risici ved behandlingen.Hvis den ansvarlige læge er i tvivl om, hvorvidt anmeldelse til komitésystemet er nødvendigt, skal denansvarlige læge kontakte komitésystemet.Det bemærkes, at der i Sundhedsstyrelsens vejledning af 2. juli 1999 om indførelse af nye behandlinger isundhedsvæsenet er eksempler på, hvornår brugen af nye kliniske behandlingsmetoder kræver et for-melt forsøgsregi og dermed anmeldelse til det videnskabsetiske komitésystem.
•
Individuelle behandlingsforsøg - særlige behandlingssituationerI konkrete, individuelle behandlingssituationer (forebyggelse, diagnostik og behandling), hvor en ny ellerspinkelt dokumenteret behandling prøves alene bestemt af hensynet til en enkelt patients tarv henset tilde konkrete omstændigheder, skal dette ikke anmeldes til den videnskabsetiske komité. Det afgørendefor, om der skal ske anmeldelse er, om formålet er at behandle patienten og ikke at generere ny viden.Det bemærkes, at der i sådanne situationer er skærpede krav til det informerede samtykke.Der henvises desuden til ovennævnte vejledning af 2. juli 1999 for flere eksempler på, hvornår brugen afnye kliniske behandlingsmetoder kræver et formelt forsøgsregi og dermed anmeldelse til det videnskab-setiske komitésystem.
•
Kvalitetssikring - kvalitetsudviklingsprojekter eller kvalitetskontrolKvalitetsudviklingsprojekter eller kvalitetskontrol skal ikke anmeldes til komitésystemet. Typisk er der taleom en aktivitet, der indgår i sundhedsvæsenets drift vedrørende fx en sygehusafdelings opnåede be-handlingsresultater for en given patientgruppe. Det samme gælder en virksomheds produktudvikling.Formålet er her ikke at opnå ny, værdifuld viden, men at afprøve en sygehusafdelings kliniske funktioneller et produkts effekt.
Det bemærkes desuden, at forsøg på cellelinjer eller lignende, der stammer fra et forsøg med indsamling af cellereller væv, som har opnået den nødvendige godkendelse, ikke skal anmeldes til komitésystemet i medfør af komi-télovens § 8, stk. 4. Hvis det ikke kan dokumenteres, at der foreligger fornøden godkendelse, skal projektet an-meldes. Det er den forsøgsansvarlige, der har bevisbyrden for, om den fornødne godkendelse foreligger. Be-stemmelsen tager sigte på at sikre, at komitésystemet ikke belastes af en stor andel af projekter, som baserer sigpå ukontroversiel forskning på basis af cellelinjer, der må betragtes som allerede eksisterende laboratoriekulturer.Det har desuden været formålet at imødegå risiko for manglende fokus på og ressourcer til behandling af de reel-
18
le videnskabsetiske problemstillinger. Samtidig er hensynet til forsøgspersonen tilgodeset, idet det lægges tilgrund, at personen har afgivet informeret samtykke til det oprindelige forsøg om indsamling af væv og celler ogde deraf afledte forsøg. Det bemærkes, at bestemmelsen ikke finder anvendelse i forbindelse med forskningspro-jekter, hvori der anvendes befrugtede æg, stamceller og stamcellelinjer, som reguleres i befrugtningsloven.1Det er den forsøgsansvarlige, som skal anmelde et forskningsprojekt til den regionale komité for det område,hvori den forsøgsansvarlige har sit virke. Ved den forsøgsansvarlige forstås en person, der udøver et erhverv, derer anerkendt til udførelse af forskning, fx via en ansættelse som forsker eller ph.d.-studerende eller på anden visved beskæftigelse med konkret forskningsarbejde, og som er ansvarlig for den praktiske gennemførelse af forsø-get på et bestemt forsøgssted.Det bemærkes, at der ved begrebet sponsor i komitéloven forstås en fysisk eller juridisk person, der påtager sigansvaret for igangsætning, ledelse eller finansiering af et biomedicinsk forskningsprojekt.3.3.2.Kriterier for godkendelse af et forskningsprojekt
Af §§ 11 – 15 i komitéloven fremgår de kriterier, som komiteerne skal iagttage i forbindelse med godkendelse afen ansøgning. Reglerne skal sikre, at der sker en kvalificeret afvejning af hensynet til udvikling af ny viden på detsundhedsfaglige område til gavn for fremtidig patientbehandling i sundhedsvæsenet og hensynet til forsøgsper-sonernes sikkerhed.En komité kan meddele tilladelse til et forsøg efter en vurdering af, om:••••De risici, der kan være forbundet med at gennemføre projektet, hverken i sig selv eller i forhold til projek-tets forudselige fordele har et uforsvarligt omfang.Den forventede gevinst i terapeutisk henseende og for folkesundheden kan berettige projektet.Projektets videnskabelige standard opfylder kravet om, at projektet skal bidrage til udvikling af ny, værdi-fuld viden.Der er tilstrækkelig grund til at gennemføre projektet, og projektets konklusioner er berettigede.
Ved denne vurdering skal der foretages en afvejning af forudsigelige ulemper og risici i forhold til mulige gevinsterfor forsøgspersonen selv eller andre patienter, ligesom forsøgspersonens sygdom og udviklingsstadium skal ind-drages. Ved afvejningen skal der også tages hensyn til, om der er tale om en forsøgsperson, der selv er i stand tilat afgive samtykke, eller om der skal indhentes stedfortrædende samtykke.En forudsætning for en tilladelse fra en komité er desuden, at:•Det klart fremgår af den skriftlige eller elektroniske information til forsøgspersonerne, hvilken økonomiskstøtte den forsøgsansvarlige modtager fra private virksomheder, fonde m.v. til gennemførelse af det på-gældende forskningsprojekt, og om den forsøgsansvarlige i øvrigt har en økonomisk tilknytning til privatevirksomheder, fonde m.v., som har interesser i det pågældende forskningsprojekt.
1
Det fremgår af lov om kunstig befrugtning, at biomedicinske forsøg på befrugtede menneskelige æg samt på kønsceller, der agtes anvendt til
befrugtning, kun må foretages i følgende tilfælde: 1) Hvis de har til formål at forbedre in vitro-befrugtning eller lignende teknikker med henblik på atfremkalde en graviditet. 2) Hvis de har til formål at forbedre teknikker til genetisk undersøgelse af et befrugtet æg med henblik på at fastslå, omder foreligger en alvorlig arvelig sygdom eller en væsentlig kromosomabnormitet (præimplantationsdiagnostik). 3) Hvis forsøgene ved anvendelseaf befrugtede æg og stamceller herfra har til formål at opnå ny viden, som vil kunne forbedre mulighederne for behandling af sygdomme hos men-nesker. Udtagning og befrugtning af æg med henblik på at gennemføre andre forsøg end de ovenfornævnte er ikke tilladt.
19
•••••
Eventuelt vederlag eller anden ydelse for deltagelse i et biomedicinsk forskningsprojekt ikke er egnet tilat påvirke samtykkeafgivelsen.Forsøgspersonens ret til fysisk og mental integritet samt retten til privatlivets fred respekteres, og oplys-ninger vedrørende forsøgspersonen beskyttes efter lov om behandling af personoplysninger.Den forsøgsansvarlige har sikret forsøgspersonen adgang til at få yderligere oplysninger om projektet.Projekter, der medfører udførsel af biologisk materiale og oplysninger til tredjelande, gennemføres ioverensstemmelse med reglerne i lov om behandling af personoplysninger.Der sker offentliggørelse af såvel negative som positive forsøgsresultater så hurtigt, som det er muligt ogfagligt forsvarligt. Offentliggørelsen skal ske i overensstemmelse med lov om behandling af personop-lysninger.
Hvis forsøgspersonerne ikke er i stand til selv at afgive samtykke til deltagelse i forskningsprojektet, skærpes risi-kovurderingen.I forbindelse med behandling af en ansøgning, som omhandler klinisk forsøg med lægemidler eller klinisk afprøv-ning af medicinsk udstyr, skal komiteerne påse:••At Lægemiddelstyrelsen er inddraget i godkendelsen af projektet.At der er en erstatning eller godtgørelsesordning, hvis forsøgspersonen lider skade eller dør som følgeaf projektet, og at der er tegnet forsikringer eller foreligger en godtgørelsesordning til dækning af denforsøgsansvarlige og sponsors ansvar.•Størrelsen af og de nærmere regler for udbetaling af eventuelt honorar eller eventuel kompensation tilden forsøgsansvarlige og forsøgspersoner og indholdet af de relevante klausuler i enhver påtænkt kon-trakt mellem sponsoren og forsøgsstedet.•At den forsøgsansvarlige er kvalificeret til at træffe behandlingsmæssige beslutninger og har en behørigsundhedsvidenskabelig uddannelse som læge eller, hvor det er relevant, tandlæge og klinisk erfaring.3.3.3.Information og samtykke
Det fremgår af komitéloven, at det videnskabsetiske komitésystems opgave er at sikre, at biomedicinske forsk-ningsprojekter gennemføres videnskabsetisk forsvarligt. I forhold til at skabe mulighed for udvikling af ny, værdi-fuld viden går hensynet til forsøgspersonens rettigheder, sikkerhed og velbefindende forud for videnskabelige ogsamfundsmæssige interesser.Dette er et af de grundlæggende vilkår for komiteernes virke i dag. For at sikre forsøgspersonernes rettigheder erder blandt andet fastsat regler om informeret samtykke, som fremgår af komitélovens kapitel 5. Det informeredesamtykke er som udgangspunkt en grundlæggende forudsætning for at deltage i forsøg. Der er således fastsatregler for indhentelse af informeret samtykke for henholdsvis myndige forsøgspersoner, mindreårige forsøgsper-soner, forsøgspersoner under personligt værgemål og voksne inhabile. Hertil kommer, at der også er fastsat reg-ler for informeret samtykke for personer på 15-17 år, som ikke er myndige.Det bemærkes, at reglerne om information og samtykke desuden er nøjere beskrevet i bekendtgørelse nr. 806 af12. juni 2004 om information og samtykke ved inddragelse af forsøgspersoner i biomedicinske forskningsprojek-ter.Det skal ligeledes bemærkes, at de særlige samtykkeregler, som gælder i forbindelse med forskning i akutte situ-ationer, beskrives og drøftes i afsnit 6.4.2.
20
3.4.
Internationale retskilder
Det videnskabsetiske komitésystem præges som nævnt af en række internationale retskilder. Disse kilder afvejerbl.a. hensynet til udvikling af ny, værdifuld viden og behovet for sikkerhed for forsøgspersonen. Udover at vareta-ge disse grundlæggende hensyn skaber kilderne også større ensartethed i kriterierne for behandlingen af ansøg-ninger i det videnskabsetiske komitésystem på internationalt niveau. Nedenfor er en overordnet introduktion tilGCP-direktivet, bioetikkonvention og Helsinki-deklarationen.3.4.1Direktivet om god klinisk praksis (GCP-direktivet) ved forsøg med lægemidler
God klinisk praksis (GCP) er en international anerkendt etisk og videnskabelig kvalitetsstandard, som gælder forforsøg med lægemidler på mennesker. Standarden bliver løbende udviklet og justeret under hensyntagen til denvidenskabelige og teknologiske udvikling.Direktiv 2001/20/EF er et direktiv om indbyrdes tilnærmelse af medlemsstaternes lovgivning og administrative be-stemmelser om anvendelse af god klinisk praksis (GCP) ved gennemførelse af kliniske forsøg med lægemidler tilhuman brug, som blev vedtaget af Rådet den 27. februar 2001. Det følger af direktivets artikel 1(2), at god kliniskpraksis er en internationalt anerkendt etisk og videnskabelig kvalitetsstandard, som skal overholdes ved udform-ning, gennemførelse, registrering og anmeldelse af kliniske forsøg, som indebærer deltagelse af forsøgspersoner.Overholdelse af denne standard skal ifølge direktivet sikre, at forsøgspersoners rettigheder, sikkerhed og velfærdbeskyttes, og at data fra kliniske forsøg er troværdige. Direktivet er gennemført i dansk ret i komitéloven og læ-gemiddelloven samt bekendtgørelser knyttet hertil, bl.a. bekendtgørelse nr. 744 af 29. juni 2006,2og bekendtgø-relse nr. 806 af 12. juli 2004.3GCP-direktivet er et minimumsdirektiv, hvilket indebærer, at eventuelt strammere danskere regler om forsøg medlægemidler går forud for direktivets regler.Det bemærkes, at det med direktiv 2005/28/EF af 8. april 2005 om principper og detaljerede retningslinjer for godklinisk praksis i forbindelse med testpræparater til human brug og om krav i forbindelse med tilladelse til fremstil-ling eller import af sådanne præparater, blev fastslået, at hensynet til forsøgspersonernes rettigheder, sikkerhedog velbefindende går forud for videnskabelige og samfundsmæssige interesser.Direktivet fra 2005 er en ”uddybning” af direktivet fra 2001 og fastsætter en række regler om god klinisk praksis iforbindelse med udformning, gennemførelse, registrering og anmeldelse af et klinisk forsøg.Med GCP-direktivet er der indført krav om, at alle faser i kliniske lægemiddelforsøg på mennesker skal foregå ioverensstemmelse med GCP-standarden. GCP-direktivet omfatter både de etiske og de videnskabelige aspekteri forbindelse med kliniske forsøg.GCP-direktivet stiller krav til såvel parterne i forsøget, sponsor og investigator, som til de etiske komiteer og dekompetente lægemiddelmyndigheder.Et grundlæggende element i GCP-direktivet er, at sponsor, inden et godkendt forsøg indledes, skal opbygge etdokumenteret kvalitetssikringssystem med standardprocedurer for de forskellige faser i forsøget og for håndterin-gen af data. Under forsøget skal sponsor som led i kvalitetskontrollen sikre efterlevelse af de fastsatte procedurer
23
Bekendtgørelse om god klinisk praksis i forbindelse med kliniske forsøg med lægemidler på mennesker (GCP-bekendtgørelsen).Bekendtgørelse om information og samtykke ved inddragelse af forsøgspersoner i biomedicinske forskningsprojekter (informationsbekendtgørel-
sen).
21
(monitorering og audit), og den kompetente myndighed kan gennemføre inspektion på forsøgsstedet eller andrerelevante steder. Når et forsøg er afsluttet, er analysen af data også omfattet af kvalitetskontrol. Alle forsøgsaktivi-teter, kontrolbesøg m.v. skal dokumenteres i skriftlige rapporter.3.4.1.1. GCP-direktivets krav til de videnskabsetiske komiteer (lægemidler)GCP-direktivets krav til de videnskabsetiske komiteer reguleres i direktivets artikel 6, hvoraf det fremgår, at denetiske komité afgiver sin udtalelse navnlig under hensyn til følgende:a)b)c)d)e)f)g)Forsøgets relevans og udformning.Om vurderingen af de forventede gevinster og risici i henhold til artikel 3, stk. 2, litra a), er tilfredsstillen-de, og om konklusionerne er berettigede.Forsøgsprotokollen.Investigatorens og støttepersonalets egnethed.Investigatorbrochuren.Faciliteternes kvalitet.Relevansen og fuldstændigheden af de skriftlige oplysninger, som skal udleveres, samt fremgangsmå-den herfor, med det formål at danne grundlag for et informeret samtykke og begrundelsen for forskningpå personer, der ikke er i stand til at give et informeret samtykke, hvad angår de særlige forbehold, derer fastsat i artikel 3.h)i)j)Bestemmelserne om erstatning eller godtgørelse, hvis en forsøgsperson lider skade eller dør som følgeaf et klinisk forsøg.Forsikringer eller godtgørelser til dækning af investigators og sponsors ansvar.Størrelsen af og de nærmere regler for udbetaling af eventuelt honorar eller eventuel kompensation tilinvestigatorer og forsøgspersoner, der deltager i kliniske forsøg, og de relevante klausuler i enhver på-tænkt kontrakt mellem sponsor og forsøgssted.k)Reglerne for hvervning af forsøgspersoner.
3.4.1.2. Definitioner og centrale bestemmelser i GCP-direktivet (lægemidler)I GCP-direktivet, der som nævnt gælder for lægemidler, er en række definitioner og begreber fastlagt:•Klinisk forsøgEthvert forsøg på mennesker, der har til formål at afdække eller efterprøve de kliniske, farmakologiskeog/eller andre farmakodynamiske virkninger af et eller flere testpræparater og/eller at identificere bivirk-ninger ved et eller flere testpræparater og/eller at undersøge absorption, distribution, metabolisme ogudskillelse af et eller flere testpræparater med henblik på at vurdere sikkerhed og/eller effekt. Det omfat-ter kliniske forsøg, der foretages på et sted eller på flere steder, i en eller flere medlemsstater.•SponsorEn person, et firma, en institution eller et organ, der påtager sig ansvaret for igangsætning, ledelseog/eller finansiering af et klinisk forsøg.•InvestigatorEn læge eller en person, der udøver et erhverv, som medlemsstaten anerkender til udførelse af forsk-ning, fordi det opfylder kravene til videnskabelig baggrund og erfaring i patientpleje. Investigator er an-svarlig for den praktiske gennemførelse af et klinisk forsøg på et bestemt forsøgssted. Hvis et forsøggennemføres af et hold på et forsøgssted, er investigator den ansvarlige leder af holdet, og han kan be-nævnes hovedinvestigator.•Informeret samtykke
22
Skriftlig, dateret og underskrevet beslutning om at deltage i et klinisk forsøg, der efter fyldestgørende in-formation om forsøgets art, betydning, rækkevidde og risici og modtagelse af passende dokumentationer truffet af egen fri vilje af en person, der er i stand til at give sit samtykke eller, hvis det drejer sig om enperson, der ikke er i stand hertil, af den pågældendes værge. Er den pågældende person ikke i stand tilat skrive, kan der i undtagelsestilfælde afgives et mundtligt samtykke i nærværelse af mindst ét vidne, ioverensstemmelse med bestemmelserne i den nationale lovgivning.Det bemærkes, at direktivet ikke fastsætter en definition af et biomedicinsk forsøg.Endvidere er nedenstående bestemmelser særlig relevante for udvalgets arbejde:•TidsfristerDen etiske komité har i medfør af direktivet en frist på 60 dage til at meddele en begrundet udtalelse (ef-ter modtagelsen af en behørigt udformet ansøgning) til ansøgeren og den kompetente myndighed i denberørte medlemsstat.Inden for den periode, hvor ansøgningen om udtalelse behandles, kan den etiske komité højst fremsen-de én enkelt anmodning om oplysninger ud over, hvad ansøgeren allerede har forelagt. Fristen afbrydes,indtil de supplerende oplysninger er modtaget.Fristen på højst 60 dage kan kun forlænges, hvis der er tale om forsøg med lægemidler til genterapi ellersomatisk celleterapi eller om lægemidler, der indeholder genmodificerede organismer. I sådanne tilfældekan fristen forlænges med højst 30 dage. For disse lægemidlers vedkommende kan fristen på i alt 90dage forlænges med yderligere 90 dage i tilfælde af høring af en gruppe eller et udvalg i overensstem-melse med medlemsstatens lovgivning og procedurer. Ved xenogen celleterapi gælder der ingen tids-mæssige begrænsninger i fristen for meddelelse af afgørelse.•Påbegyndelse af et klinisk forsøg med lægemidlerDet fremgår af GCP-direktivets artikel 9, at sponsor, inden et klinisk forsøg påbegyndes, skal have indgi-vet en behørigt udformet ansøgning om tilladelse til den kompetente myndighed, Lægemiddelstyrelsen, iden medlemsstat, hvor sponsor ønsker at gennemføre et klinisk forsøg.Det fremgår ikke af direktivteksten, hvem der skal indsende ansøgning til den etiske komité. Direktivetfastlægger således ikke, at det skal være den forsøgsansvarlige forsker, dvs. en anden person endsponsor, som indgiver ansøgningen til den relevante videnskabsetiske komité.Det følger af artikel 9(1), at sponsor først kan påbegynde et klinisk forsøg, når der foreligger en positivudtalelse fra den etiske komité, og hvis den kompetente myndighed i den berørte medlemsstat ikke harsendt sponsor en begrundet indsigelse mod forsøget. Afviklingen af procedurerne for disse afgørelserkan alt efter sponsors ønske foregå parallelt eller ej.•Indberetninger af hændelserDet fremgår af direktivets artikel 16, at investigator straks skal indberette alle alvorlige hændelser tilsponsor med undtagelse af de alvorlige hændelser, som i forsøgsprotokollen eller investigatorbrochurener betegnet som hændelser, der ikke kræver øjeblikkelig indberetning.Hændelser og/eller unormale analyseresultater, der i forsøgsprotokollen er identificeret som værendekritiske for sikkerhedsevalueringerne, indberettes til sponsor i henhold til indberetningsreglerne og indenfor de tidsfrister, der er anført i forsøgsprotokollen.
23
Ved en forsøgspersons indberettede dødsfald fremsender investigator alle yderligere oplysninger, somden etiske komité måtte anmode om.Sponsor skal opbevare detaljerede optegnelser over alle hændelser, som investigatoren eller investiga-torerne har indberettet til ham. Disse optegnelser forelægges de relevante medlemslande efter anmod-ning.•Indberetning af alvorlige bivirkningerDet fremgår af artikel 17, at sponsor skal sikre, at alle vigtige oplysninger om formodede alvorlige uven-tede bivirkninger, som er dødelige eller livstruende, registreres og indberettes hurtigst muligt til de kom-petente myndigheder i alle de berørte EU-medlemsstater samt til den etiske komité, men under ingenomstændigheder senere end syv dage efter, at sponsor har fået kendskab til et sådant tilfælde, og at re-levante oplysninger vedrørende det videre forløb derefter gives inden for en ny frist på otte dage.Alle andre formodede alvorlige uventede bivirkninger skal indberettes hurtigst muligt til de berørte kom-petente myndigheder og til den berørte etiske komité, men senest 15 dage regnet fra den dato, hvorsponsor for første gang fik kendskab til dem.En gang om året i hele forsøgsperioden afgiver sponsor både en liste over alle formodede alvorlige bi-virkninger, som er indtruffet i løbet af året, og en rapport om forsøgspersonernes sikkerhed til de rele-vante medlemslande og etiske komiteer.•Informeret samtykke til deltagelse i forsøgDet følger af artikel 3 om beskyttelse af forsøgspersoner, at et klinisk forsøg kun må påbegyndes, hvisforsøgspersonen eller, hvis denne ikke kan give et informeret samtykke, værgen, i en forudgående sam-tale med investigator eller et medlem af forsøgsholdet har haft mulighed for at blive sat ind i formåletmed forsøget, de hermed forbundne risici og ulemper og de vilkår, under hvilke det vil blive gennemført,og desuden er blevet underrettet om, at han når som helst kan udgå af forsøget. Der skal desuden fore-ligge et skriftligt samtykke til behandlingen, efter at forsøgspersonen eller dennes værge er blevet infor-meret om forsøgets art, betydning, rækkevidde og risici.3.4.1.3. God klinisk praksis og ICH-guidelines (lægemidler)Med henblik på at skabe global ensartethed på området for god klinisk praksis har EU, USA og Japan sammenudarbejdet ICH-guidelines (retningslinjer), som anvendes i forbindelse med godkendelse af kliniske lægemiddel-forsøg.4Det bemærkes, at andre lande såsom Canada og Australien også anvender ICH-guidelines.GCP-direktivet er udarbejdet i overensstemmelse med kravene i disse ICH-guidelines, specielt ICH-GCP guide-line (CPMP/ICH/135/95). Principperne for GCP, som fremgår af den førnævnte ICH-GCP guideline (kapitel 2), erogså anført i direktiv 2005/28/EF (artikel 2, 3 og 5). Det bemærkes, at der pt. arbejdes på nye ICH-retningslinjerpå området for nye årlige rapportstandarder vedr. indberetninger af alvorlige hændelser og bivirkninger: The De-velopment Safety Update Report (DSUR, ICHE2F): Harmonizing the Format and Content for Periodic Safety Re-porting During Clinical Trials. Denne retningslinje udarbejdes af CIOMS (the Council for International Organiza-tions of Medical Sciences) working group.
4
International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH), bl.a.
CPMP/ICH/135/95v.
24
I forbindelse med ansøgning om tilladelse til kliniske forsøg stilles der krav om, at sponsor efterlever ICH-GCP, jf.Lægemiddelstyrelsens vejledning til ansøgning om tilladelse til kliniske forsøg med lægemidler på mennesker.For klinisk afprøvning af medicinsk udstyr gælder den internationale standard EN/ISO 14155.3.4.2Europarådets Bioetikkonvention
Europarådets konvention af 4. april 1997 om beskyttelse af menneskerettigheder og menneskelig værdighed iforbindelse med anvendelse af biologi og lægevidenskab: Konvention om menneskerettigheder og biomedicin(herefter bioetik-konventionen) fastsætter grundlæggende rettigheder på sundhedsområdet og har til formål atbeskytte det enkelte menneske mod misbrug ved behandling og forskning.Hovedprincipperne i konventionen har karakter af minimumsstandarder, som hvert land skal opfylde, samtidigmed at landene i national lovgivning og praksis kan beslutte at beskytte individet i større omfang end, hvad følgeraf konventionen.Danmark har ratificeret konventionen i forbindelse med, at Folketinget den 11. maj 1999 vedtog beslutningsfor-slag herom.5Ratifikationen betyder, at dansk ret og dansk retsanvendelse ikke må stride mod konventionens be-stemmelser.Bioetikkonventionen har bl.a. fastsat regler om samtykke, ret til privatliv og adgang til oplysninger, videnskabeligforskning, fjernelse af organer og væv fra levende donorer med henblik på transplantation, og forbud mod øko-nomisk gevinst og bortskaffelse af dele af menneskekroppen.Konventionens kapitel V omhandler videnskabelig forskning, og nedenstående fremgår heraf:•Beskyttelse af personer, som er genstand for forskningForskning på personer kan kun finde sted, hvis alle følgende betingelser er opfyldt, jf. artikel 16:I.II.III.Der er ikke noget alternativ af tilsvarende effektivitet til forskning på mennesker.Den risiko, en person udsættes for, er ikke ude af proportion med de mulige fordele af forsknin-gen.Forskningsprojektet er godkendt af den kompetente myndighed efter uvildig undersøgelse af devidenskabelige fordele, inklusive vurdering af betydningen af målet med forskningen og tvær-faglig gennemgang af det etisk acceptable ved forskningen.IV.V.De personer, der er underkastet forskning, er blevet underrettet om deres rettigheder og de sik-kerhedsforanstaltninger, der til deres beskyttelse er foreskrevet ved lov.Det krævede samtykke i medfør af artikel 5 er udtrykkeligt og specifikt og er dokumenteret. Etsådant samtykke kan til enhver tid frit tilbagekaldes.•Beskyttelse af personer, der er ude af stand til at give samtykke til forskningForskning på en person uden evne til at samtykke, jf. artikel 5, må kun foretages, såfremt alle nedenstå-ende betingelser er opfyldt, jf. artikel 17:I.II.Betingelserne i medfør af artikel 16, pkt. I til IV er opfyldt.Resultatet af forskningen indebærer mulighed for at frembringe reelle og direkte fordele for denpågældende persons helbred.
5
Ratifikationen er bekendtgjort i Lovtidende C som bekendtgørelse nr. 65 af 11. december 2000.
25
III.IV.V.
Forskning af sammenlignelig effektivitet kan ikke udføres på personer, der har evne til at samtyk-ke.Den nødvendige bemyndigelse i medfør af artikel 6 er givet specifikt og skriftligt.Den pågældende person har ikke indvendinger.
Undtagelsesvis og i overensstemmelse med den beskyttelse, der er foreskrevet ved lov, hvor forskningikke har mulighed for at frembringe resultater med direkte fordele for den pågældende persons helbred,kan en sådan forskning tillades i overensstemmelse med betingelserne i medfør af artikel 17, stk. 1, pkt.I, III, IV og V ovenfor og med følgende yderligere betingelser:I.Forskningen har til formål gennem væsentlig forbedring af den videnskabelige forståelse af denenkeltes tilstand, sygdom eller forstyrrelse at bidrage til den endelige opnåelse af resultater, derer i stand til at overføre fordele til den pågældende person eller til andre personer i samme al-dersklasse eller ramt af den samme sygdom eller forstyrrelse eller med samme tilstand.II.Forskningen medfører kun minimal risiko og minimal gene for den pågældende person.
3.4.2.1. Tillægsprotokol til Europarådets BioetikkonventionDanmark har desuden underskrevet en tillægsprotokol til bioetikkonventionen. Protokollen omfatter alle former forbiomedicinske forskningsaktiviteter, der indebærer direkte intervention på mennesker.I kapitel 3 i tillægsprotokollen fremgår en række grundlæggende krav til de videnskabsetiske komiteer. Det følgeraf tillægsprotokollen, at alle biomedicinske projekter, der indebærer intervention på mennesker, kræver en forud-gående godkendelse af en kompetent myndighed i overensstemmelse med national ret, hvor der skal ske en uaf-hængig vurdering af den videnskabelige og etiske værdi af et projekt.Vurderingen af et projekts egenskaber skal foregå i en etisk komité i hvert af de lande, hvor forsøget finder sted.Formålet med vurderingen skal være at beskytte forsøgspersoners værdighed, rettigheder, sikkerhed og sund-hed, og vurderingen skal baseres på et passende omfang af erfaring og ekspertise og inddrage både professio-nelle og læge synspunkter. Den etiske komité skal fremsætte en udtalelse, der klart opregner begrundelsen fordens konklusion. Endvidere er der i tillægsprotokollen fastsat regler om komitémedlemmernes uafhængighed,samt at der ikke må ske påvirkning (uretsmæssig indflydelse), herunder finansiel påvirkning, over for de personer,der skal deltage i forsøget.I kapitel 4 i tillægsprotokollen er der desuden en række bestemmelser om information og samtykke. Endvidere erder i tillægsprotokollens artikel 19 fastsat regler for forskning i akutte situationer. Artikel 19 opregner således deforhold, der skal påses, såfremt deltagerne i forsøget ikke er i stand til at samtykke på grund af alder, tilstand ellerpsykisk kapacitet. Det skal i den sammenhæng bemærkes, at der i artikel 19 (2) åbnes muligheder for godken-delse af forsøg med forskning i akutte situationer, selvom det ikke på længere sigt vil forbedre den konkrete pati-ents helbred, under forudsætning af at det skaber gevinster for den pågældende patientgruppe. Dette kan dogkun ske under forudsætning af, at forsøget kun indebærer minimale risici og minimal belastning for patienten.3.4.3Helsinki-deklarationen
Verdenslægeforsamlingen (WMA) har udarbejdet Helsinki-deklarationen, som indeholder grundlæggende etiskeprincipper til læger og andre, der deltager i medicinsk forskning med mennesket som forsøgsperson. Helsinki-deklarationen opstiller således en række professionsetiske rammer, men Helsinki-deklarationen har ikke direkteretlig betydning. Der er imidlertid i stort omfang overensstemmelse mellem komitéloven og Helsinki-deklarationen.
26
Helsinki-deklarationen blev udarbejdet i 1964 og er senere blevet revideret flere gange. Den seneste revision blevvedtaget på Verdenslægeforeningens generalforsamling i Seoul, Sydkorea, i 2008. Ved denne revision blev derbl.a. fokuseret på brugen af placebo i forsøg, jf. nedenstående.Helsinki-deklarationen afvejer forholdet mellem hensynet til forsøgspersonen og forskningen. Det fremgår såle-des, at hensynet til forsøgspersonens velbefindende skal veje tungere end videnskabens og samfundets interes-ser i forbindelse med medicinsk forskning med mennesket. Det er desuden fastsat, at biomedicinsk forskning skalvære baseret på forsøgspersonernes fulde og informerede samtykke.Endvidere fremgår det, at der skal udarbejdes en forsøgsprotokol, som skal forelægges en særlig udnævnt, etiskbedømmelseskomité til overvejelse, kommentering og vejledning, og hvor dette må være hensigtsmæssigt ogsåtil godkendelse. Komiteen skal være uafhængig af forskeren og sponsoren eller andre, som kan udøve ubehørigindflydelse. Det fremgår desuden, at komiteen har ret til at overvåge igangværende forsøg. Forskeren har pligt tilat skaffe komiteen information til brug for overvågningen, især i forhold til alle alvorlige, uforudsete hændelser.Forskeren skal også tilsende komiteen information til bedømmelse af finansiering, sponsorer, institutionelle til-hørsforhold, andre mulige interessekonflikter og belønningen af forsøgspersoner.3.4.3.1. Informeret samtykkeDet fremgår af Helsinki-deklarationen, at forsøgspersonerne skal deltage frivilligt og på et informeret grundlag, jf.artikel 22 og 24. Forsøgspersonerne skal bl.a. informeres om forsøgets formål, metoder, finansieringskilder, alleeventuelle interessekonflikter, forskerens institutionelle tilhørsforhold samt de forventede fordele, de mulige risiciog det ubehag, som undersøgelsen kan medføre. Efter at have sikret sig, at forsøgspersonen har forstået infor-mationerne, skal lægen indhente forsøgspersonens frit afgivne, informerede samtykke, helst skriftligt.Helsinki-deklarationens artikel 29 fastslår, at forskning på individer, fra hvem det ikke er muligt at opnå samtykke,herunder stedfortrædende eller forudgående samtykke, kun må foretages, hvis den fysiske/mentale tilstand, somgør det umuligt at opnå informeret samtykke, er en nødvendig karakteristik ved forskningsprojektets forsøgsgrup-pe. De specifikke grunde til at inddrage forsøgspersoner med en helbredstilstand, som gør dem ude af stand til atgive informeret samtykke, skal anføres i forsøgsprotokollen til overvejelse og godkendelse af bedømmelseskomi-teen. Protokollen skal angive, at samtykke til at forblive i forskningsprojektet vil indhentes fra individet eller en ju-ridisk stedfortræder, så snart det vil blive muligt.3.4.3.2. PlaceboDet fremgår af Helsinki-deklarationens artikel 32, at fordele, risici, ubehag og effektivitet i forbindelse med en nymetode skal testes i forhold til fordele, risici, ubehag og effektivitet i forbindelse med de bedste gængse (profylak-tiske, diagnostiske og terapeutiske) metoder.Ovenstående finder dog ikke anvendelse i situationer, hvor der ikke eksisterer en gængs metode – i disse situati-oner kan anvendelse af placebo finde sted.Anvendelse af placebo i forbindelse med forsøg på mennesker kan desuden finde sted, når der foreligger en til-strækkelig overbevisende og sikker videnskabelig begrundelse for, at anvendelse af placebo er nødvendig for atafgøre effekten eller sikkerheden af en intervention. En betingelse herfor er desuden, at patienten, som modtagerplacebo, ikke udsættes for alvorlige risici eller hændelser. Det er i deklarationen understreget, at anvendelse afplacebo bør ske med yderste forsigtighed for at undgå misbrug.
27
4. Beskrivelse af det eksisterendevidenskabsetiske komitésystem
Dette kapitel indeholder en beskrivelse af det eksisterende videnskabsetiske komitésystem, herunder en beskri-velse af Den Centrale Videnskabsetiske Komité (afsnit 4.2) og de regionale komiteer (afsnit 4.3) med hensyn til:••••••OpgaverOrganisering og sammensætningSagsbyrderØkonomiPersonale og sekretariatSagsgange
Derudover indeholder kapitlet en beskrivelse af de snitflader, komitésystemet har til relevante myndigheder m.v.(afsnit 4.4).
4.1.
Det videnskabsetiske komitésystem
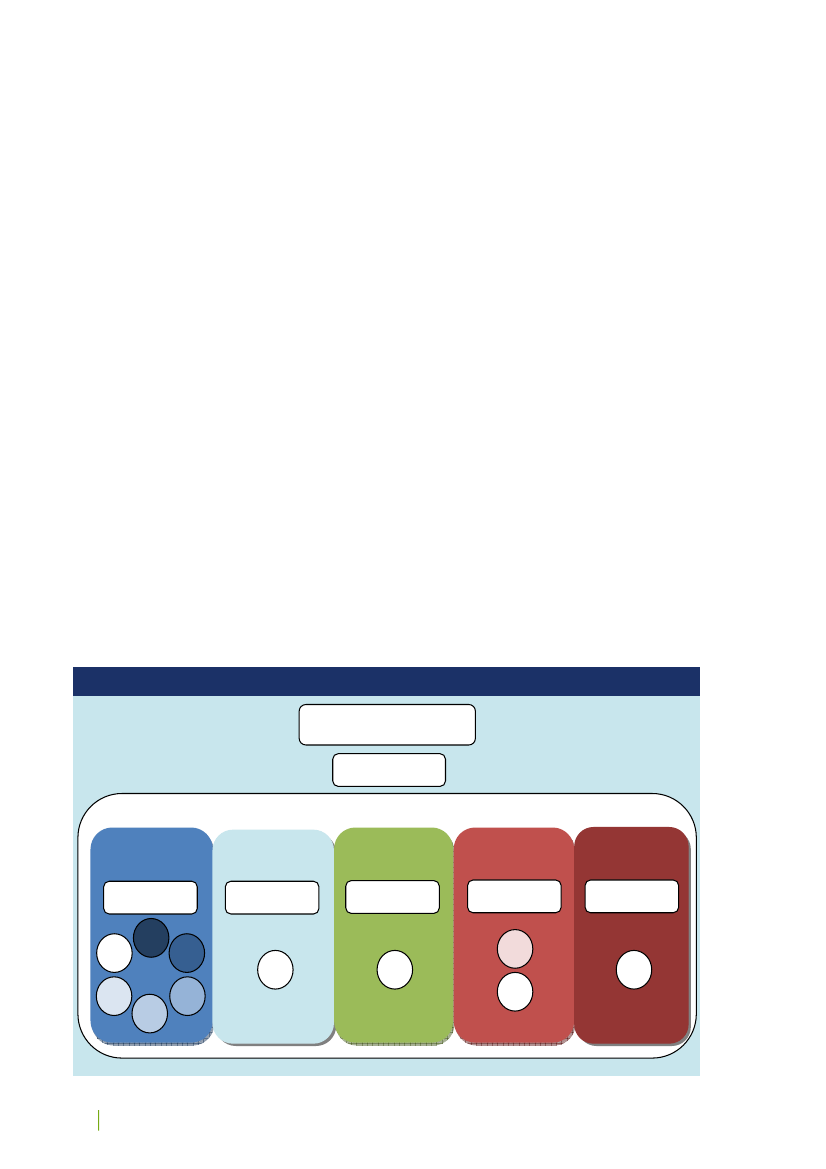
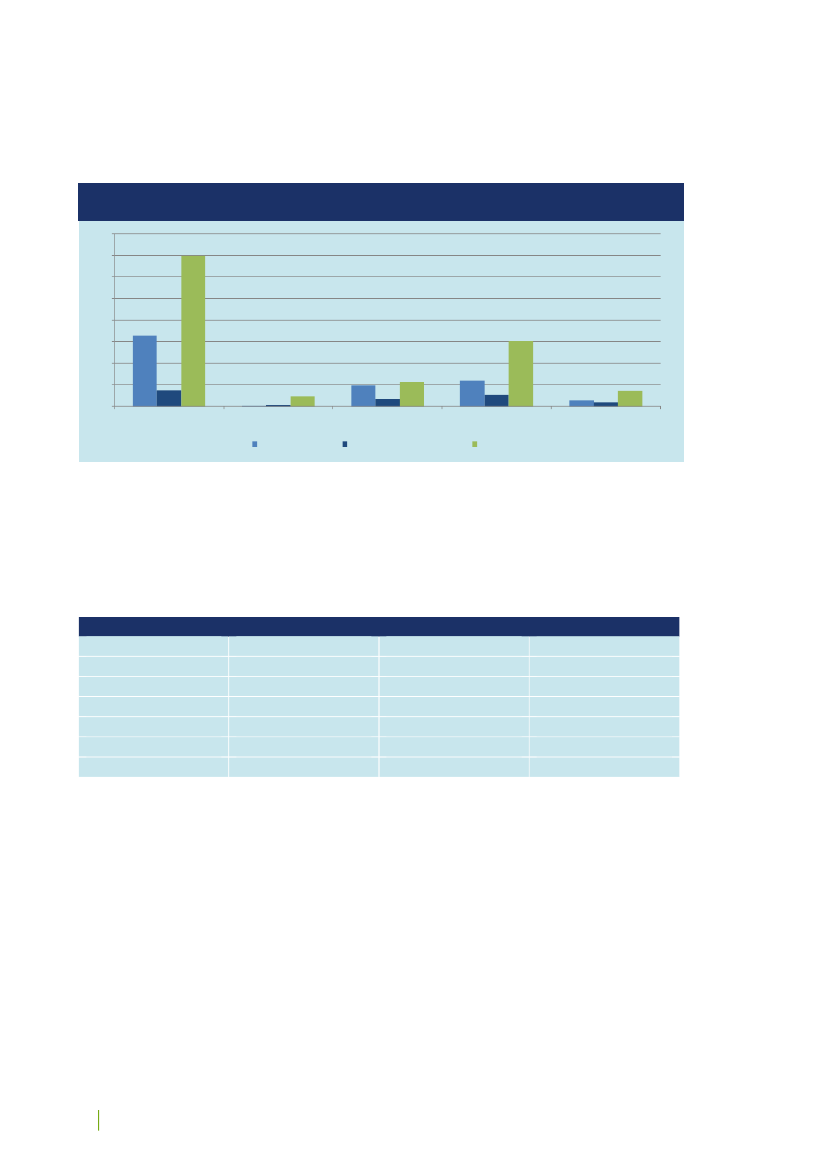
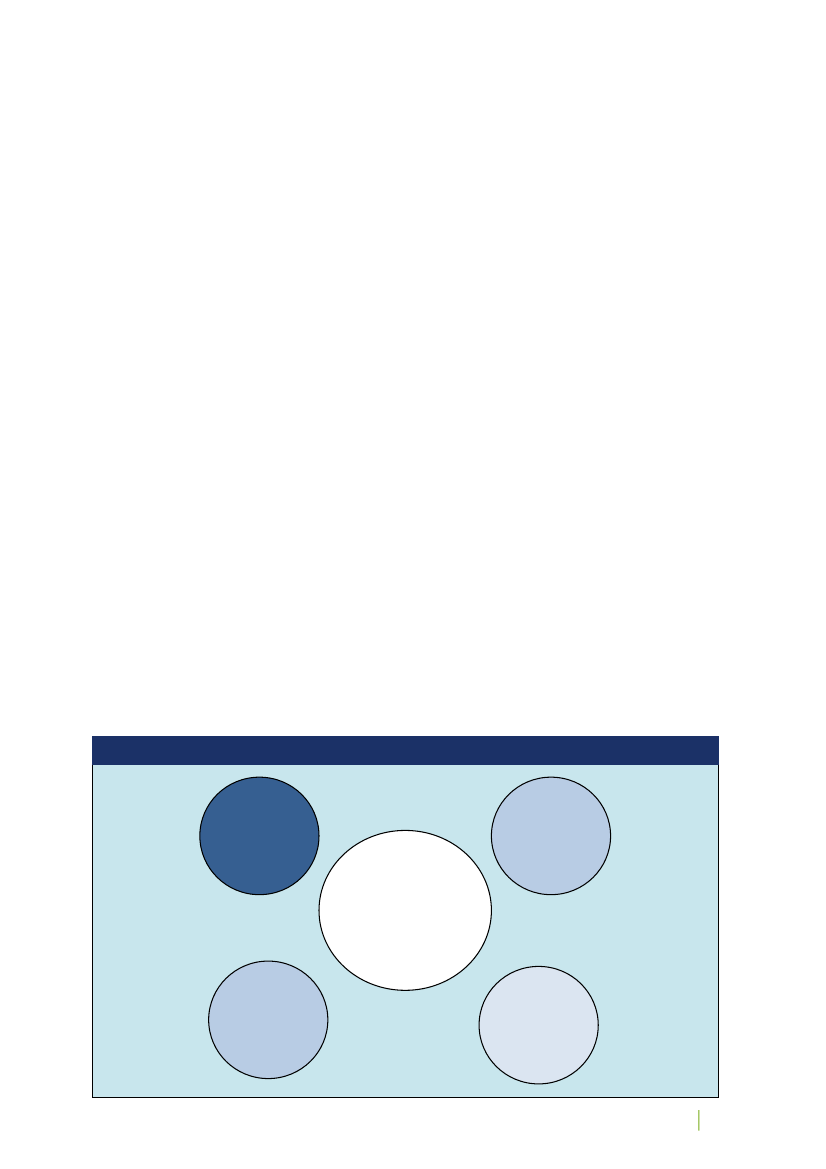
Det videnskabsetiske komitésystem består af Den Centrale Videnskabsetiske Komité (CVK) og 11 regionale vi-denskabsetiske komiteer, alle med repræsentation af både lægfolk og forskere. Jf. figur 1.Figur 1: Det videnskabsetiske komitésystem i DanmarkDen Centrale Videnskabse-tiske Komité (CVK)CVKs Sekretariat
De Regionale Videnskabsetiske KomiteerSeks komiteer iRegion Hovedsta-denEn komité i RegionSjællandEn komité i RegionSyddanmarkTo komiteer i Re-gion MidtjyllandEn komité i RegionNordjylland
Sekretariat
Sekretariat
Sekretariat
Sekretariat
Sekretariat
28
Medlemmerne af CVK er udpeget af indenrigs- og sundhedsministeren, jf. nedenfor. Indenrigs- og sundhedsmini-steren har ikke instruktionsbeføjelser over for CVK. CVK skal dog udarbejde forslag til vedtægter, som godkendesaf ministeren, jf. komitélovens § 4, stk. 5. De regionale komiteer er i dag som udgangspunkt selvstændige i allehenseender i relation til CVK, idet de dog skal følge CVKs praksis. Dertil kommer, at de regionale komiteer udar-bejder forslag til vedtægter, som godkendes af CVK, jf. § 3, stk. 5. De regionale komiteer er også selvstændige irelation til indenrigs- og sundhedsministeren.
4.2.4.2.1.
Den Centrale Videnskabsetiske Komité (CVK)CVKs opgaver
CVKs opgaver er i henhold til komitélovens kapitel 7, at:•••••••Koordinere arbejdet i de regionale komiteer.Fastsætte vejledende retningslinjer.Udtale sig om spørgsmål af principiel karakter, såfremt dette ikke er knyttet til godkendelse af et konkretforskningsprojekt.Fungere som ankeinstans for afgørelser truffet af de regionale komiteer (klagesager) og afgøre sager,hvor der er uenighed blandt medlemmer i de regionale komiteer (uenighedssager).Følge forskningsudviklingen på sundhedsområdet og virke for forståelsen af de etiske problemstillinger,udviklingen kan medføre, i forhold til sundhedsvæsenet og de biomedicinske forskningsmiljøer.Udarbejde årsrapport.Overveje om CVK skal foretage indstillinger til indenrigs- og sundhedsministeren efter komitélovens §§26 og 27 (disse bestemmelser omhandler specifikke nye forskningsområder).Desuden afgiver CVK vejledende udtalelser om biomedicinske forskningsprojekter, som danske forskere plan-lægger at gennemføre i ulande (ulandssager). Da ulandssager ikke er omfattet af komitélovens regler, bliver derikke truffet afgørelser, men alene afgivet en vejledende udtalelse til forsker. Der er tale om en frivillig ordning.4.2.2.Organisering og sammensætning
CVKs sammensætning er fastlagt i komitélovens § 4.Formanden og 3 medlemmer udpeges af indenrigs- og sundhedsministeren, heraf udpeges 2 af disse medlem-mer efter indstilling fra videnskabsministeren. Formanden skal repræsentere statslige forskningsinteresser og fol-keoplysende, almenkulturelle eller sociale interesser, der er af betydning for CVKs virke. De 3 andre ministerud-pegede medlemmer skal repræsentere folkeoplysende, almenkulturelle eller sociale interesser, der er af betyd-ning for den centrale komités virke.Herudover består komiteen af 2 medlemmer udpeget efter indstilling fra hver af de regionale komiteer – en forsk-ningsaktiv og et lægt medlem. Det er som hovedregel formand og næstformand for de regionale komiteer, somudpeges som medlemmer. De regionale medlemmer er politisk udpegede – de forskningsaktive er udpeget efterindstilling fra relevante forskningsfaglige fora. Det bemærkes, at komitéloven ikke stiller særlige krav til de lægemedlemmer, som udpeges af regionsrådene.Det betyder, at CVK for tiden består af 26 medlemmer. Af de 26 medlemmer er 4 ministerudpegede og 22 regio-nalt indstillede (11 læge medlemmer og 11 forskningsaktive); dvs. de har også sæde i en af de regionale komite-er. 22 af CVKs 26 medlemmer repræsenterer således førsteinstansmyndigheden. Herudover har 2 repræsentan-ter for den færøske regionale videnskabsetiske komité observatørstatus, men deltager aldrig i CVKs møder.
29
CVK holder ca. 8 møder om året – typisk af en halv dags varighed – samt et årsmøde for alle medlemmer af ko-mitésystemet.4.2.3.Sagsbyrder
Antallet af behandlede sager i CVK ligger nogenlunde stabilt. De konkrete projektsager består af klagesager,uenighedssager og ulandssager. Jf. tabel 1.Tabel 1: Konkrete projektsager i CVK2004KlagesagerUenighedssagerUlandssagerI alt4.2.4.løn.Formanden, næstformanden samt de 3 øvrige ministerudpegede medlemmer af CVK honoreres via CVKs bevil-ling. For så vidt angår formand og næstformand er fastsat et særskilt honorar, som udbetales månedligt. For såvidt angår de 3 ministerudpegede medlemmer er fastsat et honorar pr. møde, som den pågældende deltager i.CVK har en driftsaftale med Indenrigs- og Sundhedsministeriet. Aftalen dækker husleje, it, service o. lign. samtvaretagelse af regnskabs- og personalefunktioner. Driftsaftalen beløber sig til 400.000 kr., som årligt overføres tilministeriet på tillægsbevillingsloven.4.2.5.Personale og sekretariatCVKs økonomi5613242005311418200657162820074413212008631120200937919
CVK har særskilt bevilling på finansloven (§ 16.11.42). Bevillingen i 2009 er på 3,6 mio. kr., heraf 2,3 mio. kr. til
CVKs sekretariat består af 4 fuldtidsansatte medarbejdere: 1 sekretariatschef, 2 juridiske fuldmægtige og 1 kon-torfuldmægtig.4.2.6.Sagsgange
I det følgende beskrives sagsgangene i CVK mht. klage- og uenighedssager.Som tidligere nævnt er en af CVKs opgaver at fungere som ankeinstans for afgørelser truffet af de regionale ko-miteer (klagesager) og at afgøre sager, hvor der er uenighed blandt medlemmerne i de regionale komiteer(uenighedssager).Når en sag indbringes for CVK, forbereder CVKs sekretariatet sagen til mødet i CVK:•Modtagelse af sag i CVK:Det undersøges, om projektet er ”behørigt udformet”, dvs. at alle nødvendigedokumenter er til stede for behandlingen af sagen. Eventuelt manglende materiale rekvireres. Efter kon-statering af, om klagen er modtaget rettidigt (klagesager), sendes kvitteringsbrev til klager, og den regio-nale komité anmodes om en udtalelse.Det skal bemærkes, at CVK – ligesom de regionale komiteer – er bundet af en tidsfrist på 60 dage eftermodtagelsen af en behørigt udformet ansøgning, indenfor hvilken der skal træffes afgørelse i klagesa-gen, jf. komitélovens § 10, stk. 1. Komiteen kan sende én enkelt anmodning til forsker med anmodning
30
om yderligere oplysninger. Derved afbrydes tidsfristen, indtil de supplerende oplysninger er modtaget, jf.komitélovens § 10, stk. 3.•Behandling af sag i CVKs sekretariat:Sagsbehandleren i CVKs sekretariat udpeger to ”forbehandlere”(en fagperson og et lægmedlem), der skal stå for sagsfremlæggelsen på mødet i CVK. Sagens doku-menter sendes til forbehandlerne.•Sagsbehandler vurderer herefter bl.a. behovet for:oooooIndhentning af eventuelle informationer fra den forsøgsansvarlige om facts eller uklarheder i re-lation til ansøgningen.En udtalelse fra den regionale komité.Supplerende materiale fra forsker.Ekspertudtalelse. Denne indhentes som udgangspunkt altid i børnesager, medmindre der liggeren udtalelse fra den regionale komités behandling af sagen.Partshøring af den forsøgsansvarlige over eventuelle kommentar fra den regionale komité ellerekspertudtalelse.Herefter udarbejder sagsbehandleren et ”forklæde” til brug for CVKs medlemmer. I forklædet gives etkort resumé af sagen og dens juridiske aspekter. Særlige problemstillinger af relevans for drøftel-sen/afgørelsen påpeges, ligesom det indstilles om en eventuel godkendelse bør gives på betingelser ogi givet fald hvilke.•Behandling af sag i CVK:Sagen behandles på et møde i CVK, hvor der træffes afgørelse om, hvorvidtsagen skal godkendes eller ej. Herefter udarbejder sekretariatet hurtigst muligt udkast til afgørelse, somforelægges forbehandlerne og formandskabet. Eventuelle kommentarer indarbejdes, hvorefter afgørel-sen afsendes på vegne af formanden med kopi til den regionale komité og eventuelt Lægemiddelstyrel-sen. CVK får kopi af afgørelsen i forbindelse med materialet til det efterfølgende møde.Desuden indgår CVK i en række samarbejdsfora. De vigtigste er:•Samarbejde med Det Etiske Råd:CVK og Det Etiske Råd skal ifølge komitélovens § 5, stk. 2, samar-bejde om principielle etiske spørgsmål, der vedrører biomedicin. Samarbejdet foregår ved møder og fæl-les aktiviteter. Der afholdes mindst et årligt møde. Sekretariatsfunktionen går på skift mellem Det EtiskeRåd og CVKs sekretariat. Samarbejdsudvalget består af 4 medlemmer fra CVK (herunder formand ognæstformand) samt repræsentanter fra Det Etiske Råd. Jf. afsnit 4.4.4 for en nærmere beskrivelse afsnitflader til Det Etiske Råd.•Samarbejde med Lægemiddelstyrelsen:Der er nedsat et særligt koordineringsudvalg, som holder tomøder årligt. Sekretariatsfunktionen går på skift mellem Lægemiddelstyrelsen og CVKs sekretariat.Udvalget skal sikre en praktisk koordinering af procedurer mv. samt en løbende dialog. Baggrunden er,at projekter, hvori indgår klinisk afprøvning af lægemidler, der er omfattet af lov om lægemidler, skalgodkendes af både komitésystemet og Lægemiddelstyrelsen. Tilsvarende gælder klinisk afprøvning afmedicinsk udstyr. Udvalget består fra komitésystemets side af 2 repræsentanter fra CVKs sekretariatsamt 1 person fra hver af de regionale videnskabsetiske komiteers sekretariater. Jf. afsnit 4.4.1 for ennærmere beskrivelse af snitflader til Lægemiddelstyrelsen.
31
•
Samordningforum:I samarbejde mellem CVKs sekretariat og de regionale sekretariater er nedsat etsamordningsforum med det formål at skabe et forum for dialog mellem de regionale sekretariater og detcentrale sekretariat. Deltagere er repræsentanter fra de regionale sekretariater og fra CVKs sekretariat.Forummet skal bl.a. sikre koordinering i relation til lovfortolkning, principielle spørgsmål, vejledninger, ud-redninger mv. samt virke som omdrejningspunkt for arbejdet med kvalitetsudvikling af komitésystemet.Der er pt. nedsat to undergrupper om henholdsvis tjekliste for tillægsprotokoller og uddannelse af nyekomitémedlemmer i 2010.
•
Genterapiudvalget:Der er nedsat et kontaktforum mellem de godkendende myndigheder vedr. gente-rapi på mennesker med henblik på at sikre koordinering på området. Udover CVKs sekretariat bestårudvalget af Lægemiddelstyrelsen, Miljøstyrelsen, Sundhedsstyrelsen samt Arbejdstilsynet. Der afholdesmøder ca. hvert halve år efter behov.
4.3.4.3.1.
De regionale videnskabsetiske komiteerDe regionale komiteers opgaver
Den egentlige behandling af ansøgninger om gennemførsel af biomedicinske forskningsforsøg varetages af deregionale komiteer. Derudover har de regionale komiteer også til opgave at føre tilsyn med, at projektet udføres ioverensstemmelse med den meddelte tilladelse, jf. komitélovens § 22, samt en række opgaver i forhold til rådgiv-ning og vejledning af komitésystemets brugere.På landsplan er der i øjeblikket 11 regionale komiteer, som varierer i størrelse og omfang og i forhold til organise-ring, sagsbyrder, økonomi, sekretariat og sagsbehandlingsforløb. Dette gennemgås herunder.4.3.2.Organisering og sammensætning
De regionale komiteer er forankret i de fem regioner, og det er regionsrådene, der nedsætter de regionale komi-teer. Sammensætningen af de regionale komiteer er reguleret i komitélovens § 3, stk. 1 og 3. Heraf fremgår det,at en regional komité skal bestå af mindst 7 medlemmer, hvoraf 3 er aktive inden for den sundhedsvidenskabeligeforskning. Skønner regionsrådet, at der af hensyn til komiteens virke er behov for større komiteer, kan der udpe-ges 9, 11, 13 eller 15 medlemmer. Muligheden for at etablere komiteer med et større antal medlemmer blev ind-ført som en del af lovændringen i 1996 og skyldtes et daværende behov for at nedsætte underudvalg til behand-ling af projektansøgninger.Ved et medlemstal på 9, 11, 13 eller 15 skal 4 respektive 5, 6 eller 7 være aktive inden for den sundhedsviden-skabelige forskning. Dette indebærer, at lægmandsrepræsentationen vil være i overtal uanset komiteens størrel-se. Lægmændene er politisk udpegede af regionsrådene, mens de forskningsaktive udpeges efter indstilling frarelevante forskningsfaglige fora.I øjeblikket er de 11 regionale komiteer sammensat i overensstemmelse med tabel 2 herunder:
32
Tabel 2: Sammensætning af de regionale videnskabsetiske komiteerRegionHovedstadenSjællandSyddanmarkMidtjyllandNordjylland4.3.3.SagsbyrderAntal komiteer61121Antal medlemmerpr. komité111171175535366464Heraf forskereHeraf lægmænd
Antallet af behandlede sager har over tid været ret konstant. Siden 2004 har de regionale komiteer tilsammen be-handlet ca. 1.000 – 1.100 sager pr. år. Siden regionsdannelsen i 2007 har sagsbyrden fordelt sig mellem regio-nerne i henhold til tabel 3:Tabel 3: Antal anmeldte projekter2007HovedstadenSjællandSyddanmarkMidtjyllandNordjyllandI alt62634127266661.119200856538164242691.078200959454141255611.105
Langt de fleste sager godkendes, jf. figur 2. En del af de godkendelser, der er givet, vil være godkendelser meden eller flere betingelser, som efterfølgende bliver opfyldt. I 2008 er der således kun registreret 13 afslag på an-søgninger. Herudover vil der være en række sager, som afvises af komitésystemet, fordi sagerne ikke er anmel-delsespligtige i medfør af komitéloven.
Figur 2: Sager anmeldt til de videnskabsetiske komiteer fordelt på afgørelse, 200860050040030020012010070RegionHRegionSjRegionSRegionMIkkegodkendtRegionN2422581543
235
Godkendtoggodkendtmedbetingelse
33
Sagerne fordeler sig således, at lægemiddelforsøg udgør ca. en tredjedel af de anmeldte forsøg, mens forsøgmed medicinsk udstyr udgør ca. en fjerdedel, jf. figur 3.
Figur 3: Sager anmeldt til de videnskabsetiske komiteer fordelt på sagstype, 2008400350300250200150100500RegionHRegionSjLægemiddelforsøgRegionSForsøgmedmedicinskudstyrRegionMØvrigeRegionN371249231756592636149164349
151
4.3.4.
Økonomi
De regionale komiteer har udgifter til sekretariatsbetjening, diæter og rejsegodtgørelse mv., kontorhold, forplej-ning til møder samt aflønning af komitémedlemmer. En regional komitéformand aflønnes med indtil 35.000 kr. år-ligt, en næstformand med indtil 30.000 kr. og et menigt medlem med indtil 10.000 kr. årligt.Nedenstående tabel 4 indeholder en oversigt over totaludgifterne for de regionale videnskabsetiske komiteer.Tabel 4: Totaludgifter for de regionale videnskabsetiske komiteer, mio. kr. 2008UdgifterHovedstadenSjællandSyddanmarkMidtjyllandNordjyllandI alt7,00,51,62,00,711,8Indtægter1,20,10,30,50,22,3Nettoudgifter5,80,41,31,50,59,5
Komiteernes indtægter stammer fra gebyrer for behandling af projekter. Projekter, der anmeldes af en projektle-der fra en statsinstitution (med undtagelse af universiteterne), et privat firma, et privat hospital, en praktiserendelæge mv., pålægges gebyr. Projekter, der anmeldes fra regionernes egne institutioner, pålægges ikke gebyrer.Såfremt der er tale om samarbejdsprojekter, som både omfatter aktører fra regionens egne institutioner og eks-terne aktører, pålægges gebyr, hvis den eksterne aktør er forsøgsansvarlig.Gebyrsatsen er fastsat af regionerne i henhold til § 2 i bekendtgørelse nr. 795 af 24. september 1992 om gebyrfor behandling af biomedicinske forskningsprojekter i de regionale videnskabsetiske komiteer. Gebyret, som se-nest blev justeret i 2003, udgør 4.000 kr. for behandling af nye projekter og 1.500 kr. for behandling af tillægspro-tokoller, protokolændringer eller protokoludvidelser. For behandling af ændringer af deltagerinformation, efterføl-gende indsendelse af annoncetekst og lignende betales ligeledes gebyr.
34
4.3.5.
Personale og sekretariat
I hver region er et sekretariat, som betjener regionens komité(er). Sekretariaterne varierer i størrelse, jf. tabel 5,hvilket afspejler forskellen i sagsbyrden mellem de fem regioner.Tabel 5: Personale ved de regionale videnskabsetiske komiteer, 2009Akademiske medarbejdereHovedstadenSjællandSyddanmarkMidtjyllandNordjylland41 (har også andre opgaver i regionen)122 (har også andre opgaver i regionen)HK’ere51 (har også andre opgaver i regionen)210
Sekretariaterne omfatter juridiske medarbejdere samt HK’ere. I flere tilfælde har sekretariatsmedlemmerne ogsåandre opgaver i regionen. Reelle afsatte årsværk svinger således mellem ca. 0,3 og 9.Foruden betjening af komiteerne har sekretariaterne til opgave at gennemføre telefonisk og skriftlig vejledning afforskere om komitélovens regler – herunder spørgsmål om anmeldelsespligt. Endvidere holder sekretariaternesansatte oplæg/kurser i komitéloven og praksis mv. Omfanget varierer fra region til region.4.3.6.Sagsgange
Behandlingen af sager i de regionale komiteer kan opdeles flere faser, jf. nedenstående figur 4:
Figur 4: Beskrivelse af sagsgangen for behandling af et nyt forskningsprojekt
Anmeldel-se af nytforsk-ningspro-jekt
Forbere-delse afsag i se-kretariatet
Godken-delse
Vurdering af om an-søgningen er behørigtudformet. Indhentningaf supplerende oplys-ninger og dialog medforskere om komplet-tering af ansøgningen.
Behand-ling af sagi RVK
Anmodningom supple-rende mate-riale
Videresen-delse til CVK
35
Behandling af en ansøgning forudsætter, at ansøgningen er behørigt udformet, jf. komitélovens § 10. En behørigtudformet ansøgning skal indeholde en elektronisk udfyldt anmeldelsesblanket og en forsøgsprotokol.Til den elektronisk udfyldte anmeldelsesblanket skal nedenstående vedlægges:••Dokumentation for anmelders identifikation.En redegørelse for, at den forsøgsansvarlige har et erhverv, der er anerkendt til udførelse af forskningeller er beskæftiget med konkret forskningsarbejde.Der er yderligere krav i forbindelse med lægemiddelforsøg og forsøg med medicinsk udstyr, bl.a. om kopi af ud-fyldt ansøgning til Lægemiddelstyrelsen, CV med ansøgers kliniske erfaring, oplysning om erstatnings- eller godt-gørelsesordninger og oplysning om relevante klausuler i kontrakten mellem sponsor og forsøgsstedet, som hand-ler om økonomisk støtte til projektet samt om offentliggørelse af forsøgsresultater.Forsøgsprotokollen, som i henhold til CVKs vejledning skal udarbejdes på dansk, skal bl.a. indeholde nedenstå-ende:•••••••••••Forsøgets formål.Forsøgets metode.Statistiske overvejelser.Forsøgspersonerne, herunder inklusions- og eksklusionskriterier.Bivirkninger, risici og ulemper for forsøgspersonen.Økonomiske forhold.Vederlag eller andre ydelser til forsøgspersoner.Hvervning af deltagere.Tilgængeligheden af oplysninger for forsøgspersoner.Offentliggørelse af forsøgsresultater.Videnskabsetisk redegørelse.
Desuden skal forsøgsprotokollen vedlægges lægmandsresumé, skriftlig deltagerinformation, beskrivelse af pro-cedurer for afgivelse af mundtlig deltagerinformation, samtykkeerklæring, annoncemateriale til hvervning af delta-gere, spørgeskemaer m.v.Af komitélovens § 10 fremgår det, at sagsbehandlingstiden i de regionale komiteer ikke må overskride 60 dage.60-dages fristen starter i det øjeblik, at ansøgningen er behørigt udformet. Den tid, der går med at komplettere enansøgning, er således ikke indeholdt i de 60 dage. Komitélovens sagsbehandlingstider følger GCP-direktivet, jf.afsnit 3.4.1).60-dages fristen overholdes generelt i alle regionale komiteer.I det følgende gennemgås de fem faser i figur 4.•Anmeldelse af nyt forskningsprojekt:Ansøgninger fremsendes til den regionale komités sekretariat,som gennemgår om sagen opfylder komiteloven med tilhørende bekendtgørelser og CVKs vejledning.Pr. 1. oktober 2005 lanceredes et elektronisk anmeldelsessystem (www.drvk.dk/anmeldelse), som skalbenyttes af alle ansøgere. Til systemet er knyttet et sagsbehandlingsmodul, som benyttes af de regiona-le sekretariater i deres sagsbehandling. Systemet/databasen drives af Indenrigs- og Sundhedsministeri-et, som har indgået en databehandleraftale med alle regioner, hvorefter regionerne er dataansvarlige,
36
mens ministeriet og CVKs sekretariat er databehandlere. Uanset dette skal alle projekter indsendes ipapirform til de regionale komiteer (i ca. 9 -13 eksemplarer).De regionale komiteer opererer med forskellige frister for indsendelse af ansøgninger. Enkelte komiteeropererer med frister på 2 uger inden afholdelse af møde i komiteen, men andre kræver, at materialetindsendes mindst 2 weekender inden mødets afholdelse.•Vurdering af om ansøgningen er behørigt udformet og indhentelse af supplerende oplysningerm.v.:Erfaringer fra de regionale komiteer viser, at der i forbindelse med op mod 90 % af de indkomneansøgninger er behov for dialog og indhentning af supplerende oplysninger fra ansøger.•Forberedelse af sag i sekretariatet:De regionale komiteers sekretariater foretager en juridisk og i vis-se tilfælde også materiel sagsbehandling af de enkelte sager, dvs. sikrer at ansøgningerne er udarbejdeti overensstemmelse med komitéloven og tilhørende bekendtgørelser og vejledninger. En enkelt regionoplyser, at der til sagen kan udarbejdes et ’bemærkningsark’, hvor sekretariatet kan påtegne områder,som sekretariatet mener, at komiteen bør være særligt opmærksom på.•Behandling af sag i de regionale komiteer:Alle sager realitetsbehandles i de regionale komiteer. Derbehandles ca. 10 – 12 sager pr. møde og afholdes ca. 7 – 12 møder pr. år. Der udpeges én eller to for-behandlere til hver sag, som har det primære ansvar for at sætte sig ind i detaljerne i den pågældendesag. I enkelte regioner er der krav om, at den ene forbehandler skal være forsker, mens den anden skalvære lægmand. En komité kan bede en ansøger om at møde op ved et komitémøde, hvis komiteen me-ner, der er behov herfor.•Afgørelse:Langt de fleste sager godkendes af de regionale komiteer, dog oftest med bemærkninger el-ler betingelser. Godkendelse kræver enstemmighed. I visse tilfælde kræver de regionale komiteer, at derindsendes supplerende materiale, inden ansøgningen kan imødekommes. I tilfælde af afslag i den regi-onale komité kan ansøgeren indbringe afgørelsen for CVK. I tilfælde af uenighed kan den regionale ko-mité indbringe sagen for CVK.I forhold til spørgsmål om habilitet i komiteernes arbejde gælder forvaltningslovens almindelige regler.Tillægsprotokoller skal som udgangspunkt igennem samme sagsbehandling som nye sager. I enkelte regionerbehandles tillægsprotokollerne dog ikke i komiteen, men blot af formanden/formandskabet.
4.4.
Komitésystemets snitflader til øvrige myndigheder m.v.
Komitésystemet virker i tæt sammenhæng med en række øvrige myndigheder og organer. I det følgende beskri-ves snitflader i forhold til.••••Lægemiddelstyrelsen (afsnit 4.4.1).Forskningsrådene og arbejdet med god videnskabelig praksis (afsnit 4.4.2).Datatilsynet (afsnit 4.4.3).Det Etiske Råd (afsnit 4.4.4).
4.4.1. LægemiddelstyrelsenEt klinisk forsøg med lægemidler må kun udføres, når Lægemiddelstyrelsen har givet tilladelse til forsøget. Vedforsøg på mennesker skal der desuden foreligge en tilladelse fra en videnskabsetisk komité, jf. lægemiddellovens
37
§ 88, stk. 1. Forsøg med lægemidler på mennesker skal foregå i overensstemmelse med god klinisk praksis, jf.lægemiddellovens § 88, stk. 2.Lægemiddelstyrelsen vurderer sikkerhed (risici og ulemper) og mulighed for terapeutisk gevinst ved lægemiddel-forsøg, der har til formål at undersøge:•••Kliniske, farmakologiske eller farmakodynamiske virkninger.Bivirkninger.Absorption, distribution, metabolisme eller udskillelse ved forsøgslægemidler.
Definitionen af ”kliniske forsøg” med lægemidler på mennesker fremgår af § 2, nr. 1, i bekendtgørelse om kliniskeforsøg med mennesker. Udover at forsøget skal være sikkerhedsmæssigt forsvarligt for forsøgspersonerne, kræ-ves det, at forsøget er egnet til at frembringe ny viden og må antages at have en terapeutisk gevinst, der kan be-rettige risici ved forsøget.Kliniske afprøvninger af medicinsk udstyr må først iværksættes, når Lægemiddelstyrelsen har givet tilladelse her-til. Der skal desuden foreligge en tilladelse til afprøvningen fra en videnskabsetisk komité, jf. § 9, stk. 1, i bekendt-gørelse om medicinsk udstyr og § 6, stk. 1, i bekendtgørelse om aktivt, implantabelt medicinsk udstyr samt § 8a, ibekendtgørelse om medicinsk udstyr til in vitro-diagnostik (gælder for kliniske afprøvninger af medicinsk udstyr tilin vitro-diagnostik, der direkte/indirekte kommer i kontakt med det menneskelige legeme). En klinisk afprøvning erdefineret som ethvert forsøg på mennesker, der har til formål at afdække eller efterprøve sikkerheden og/ellerydeevnen af medicinsk udstyr, jf. bekendtgørelsen om medicinsk udstyr § 1, stk. 2, nr. 14, bekendtgørelsen omaktivt, implantabelt medicinsk udstyr § 1, stk. 2, nr. 13 samt bekendtgørelsen om medicinsk udstyr til in vitro-diagnostik § 1, stk. 2, nr. 14.Krav om tilladelse fra Lægemiddelstyrelsen omfatter alle kliniske afprøvninger af ikke CE-mærket medicinsk ud-styr samt CE-mærket udstyr, hvis formålet med afprøvningen er at anvende det medicinske udstyr til et nyt for-mål. Afprøvninger af CE-mærket medicinsk udstyr, der anvendes til dets erklærede formål, skal ikke godkendesaf Lægemiddelstyrelsen, jf. bekendtgørelsen om medicinsk udstyr § 9, stk. 13, bekendtgørelsen om aktivt, implan-tabelt medicinsk udstyr § 6, stk. 13, samt § 8a i bekendtgørelse om medicinsk udstyr til in vitro-diagnostik.Lægemiddelstyrelsen vurderer sikkerhed og mulig terapeutisk gevinst ved afprøvningen. Afprøvningen skal væresikkerhedsmæssigt forsvarlig og være egnet til at frembringe ny viden om udstyret. Den skal udføres efter en re-levant afprøvningsplan, der er videnskabeligt og teknisk tidssvarende, og som er udformet således, at den kanbekræfte eller afkræfte fabrikantens antagelser om udstyrets sikkerhed og ydeevne. Kliniske afprøvninger skalforetages i overensstemmelse med Helsinki-erklæringen. Det er nogle af forudsætningerne for, at Lægemiddel-styrelsen kan give tilladelse til en klinisk afprøvning. Der henvises til § 9, stk. 9, i bekendtgørelsen om medicinskudstyr og bilag X i direktiv 93/42/EØF samt § 6, stk. 9, i bekendtgørelsen om aktivt, implantabelt medicinsk udstyrog bilag 7 i direktiv 90/385/EØF.Det bemærkes, at § 15 i komitéloven omhandler særlige forhold, som komiteerne skal påse ved behandling afansøgninger om kliniske forsøg med lægemidler og medicinsk udstyr. Komiteerne skal bl.a. påse, at Lægemid-delstyrelsen er inddraget i godkendelsen af projektet, og størrelsen af og de nærmere regler for udbetaling af ho-norar eller eventuel kompensation til den forsøgsansvarlige og forsøgspersoner. Den, der udøver læge- ellertandlægevirksomhed, må ikke uden Lægemiddelstyrelsens tilladelse drive eller være knyttet til en virksomhed,der har tilladelse efter § 7 eller § 39, stk. 1, i lov om lægemidler, jf. apotekerlovens § 3, stk. 2. Det gælder også,hvis en læge har tilknytning til en lægemiddelvirksomhed i forbindelse med udførelsen af et klinisk lægemiddelfor-søg. Lægemiddelstyrelsen orienterer sponsor om apotekerlovens § 3, stk. 2, i forbindelse med behandling af an-søgning om tilladelse til kliniske forsøg – men tager ikke stilling til honorar i forbindelse med behandling af ansøg-
38
ningerne. Det sker efterfølgende på foranledning af lægens ansøgning om tilladelse til tilknytning til lægemiddel-virksomheden.4.4.2. Forskningsrådene og arbejdet med god videnskabelig praksisForskningsrådssystemet virker inden for alle videnskabelige forskningsområder, mens det videnskabsetiske komi-tésystem alene virker inden for det sundhedsvidenskabelige forskningsområde. Eventuelle snitflader kan derforalene forekomme i forhold til de organer, som varetager opgaver i relation til det sundhedsvidenskabelige forsk-ningsområde. I forskningsrådssystemet drejer det sig hovedsageligt om Det Frie Forskningsråd | Sundhed ogSygdom, Det Strategiske Forskningsråds for tiden nedsatte Programkomité for individ, sygdom og samfund og i etvist omfang Det Strategiske Forskningsråds Programkomité for sundhed, fødevarer og velfærd samt Udvalgenevedr. Videnskabelig Uredelighed (særligt Udvalget for Sundhedsvidenskabelig Forskning).•Det Frie Forskningsråd | Sundhed og Sygdom (FSS)FSS er et af Det Frie Forskningsråds fem faglige forskningsråd. FSS har som hovedopgave at indkaldeog behandle ansøgninger om støtte til forskningsaktiviteter inden for det sundhedsvidenskabelige forsk-ningsområde. I 2009 udgjorde den bevillingsmæssige ramme for FSSs fondsfunktion ca. 290 mio. kr.FSS indkalder og behandler ansøgninger om større beløb ca. to gange årligt, mens ansøgninger ommindre beløb behandles løbende. Vilkår for ansøgningerne offentliggøres i FSSs opslag, der ses påhjemmesiden www.fi.dk.En del af ansøgningerne sendes til en indledende, vejledende ekstern bedømmelse, men FSS, som be-står af anerkendte forskere, vurderer selv et stort antal ansøgninger internt. På baggrund af de i opslagetoffentliggjorte vurderingskriterier træffer FSS afgørelse i plenum efter mundtlig forhandling om hver ene-ste af de modtagne ansøgninger. Der udarbejdes ikke skriftlige bedømmelser af hver enkelt ansøgning,men alle afslag ledsages af en kort begrundelse.I opslaget er angivet en lang række krav til ansøgningerne, som bl.a. skal godtgøre den videnskabeligekvalitet af det ansøgte projekt. Bl.a. skal der, hvor det er relevant, redegøres for forskningens etiskeaspekter. FSS foretager ikke generelt en særlig prøvelse af de etiske aspekter ved et ansøgt projekt.FSS lægger til grund, at ansøgeren selv forholder sig til lovgivningen herom, herunder komitéloven, og atanden lovgivning i det hele taget er og vil blive overholdt.Ud over fondsfunktionen bistår FSS efter anmodning bestyrelsen for Det Frie Forskningsråd med forsk-ningsfaglig rådgivning til brug for ministeren, Folketinget, regeringen, offentlige og private institutioner.FSS har ingen forskningsfaglige rådgivningsopgaver i forhold til enkelte forskere.•Det Strategiske Forskningsråds programkomité for individ, sygdom og samfund og dele af aktivi-teterne i programkomiteen for sundhed, fødevarer og velfærd (programkomiteerne)Programkomiteerne er for tiden nedsat af Det Strategiske Forskningsråd til at udmønte forskningsbevil-linger inden for politisk fastsatte temaer. I 2009 drejer det sig om klinisk forskning, fra basal forskning tilindividualiseret behandling og sundhed. Der er i 2009 afsat ca. 240 mio. kr. til disse tre forskningstema-er.Programkomiteerne indkalder og behandler ansøgninger en gang årligt (marts måned). Vilkår for ansøg-ningerne offentliggøres i opslag, der ses på hjemmesiden www.fi.dk. Der er tale om en tofaset ansøg-ningsprocedure med en indledende prækvalifikation (fase 1) og en efterfølgende behandling af mere ud-førlige, endelige ansøgninger (fase 2). Alle fase 2-ansøgninger sendes til vejledende ekstern forsknings-faglig bedømmelse, og programkomiteerne træffer herefter hver for sig afgørelse i plenum efter mundtligforhandling om hver eneste af de modtagne ansøgninger på baggrund af de i opslaget offentliggjort vur-
39
deringskriterier. Programkomiteerne udarbejder ikke skriftlige bedømmelser af hver enkelt ansøgning,men alle afslag ledsages af en kort begrundelse.I opslaget er angivet en lang række krav til ansøgningerne, som bl.a. skal godtgøre den videnskabeligekvalitet af projektet, aktivitetens relevans i forhold til forskningstemaets formål samt aktivitetens potentiel-le effekt. Programkomiteerne stiller ingen særlige krav i relation til eventuelle etiske aspekter. Program-komiteerne lægger herved til grund, at ansøgeren selv forholder sig til lovgivningen herom, herunderkomitéloven, og at anden lovgivning overholdes.Programkomiteerne bistår efter anmodning bestyrelsen for Det Strategiske Forskningsråd med forsk-ningsfaglig rådgivning til brug for ministeren, regeringen, offentlige og private institutioner. Programkomi-teerne har ingen særlige forskningsfaglige rådgivningsopgaver ved siden af fondsfunktionen.•Udvalgene vedr. Videnskabelig Uredelighed (UVVU)UVVU har til opgave at behandle sager om videnskabelig uredelighed, der rejses ved anmeldelse. Derer nedsat tre udvalg, herunder Udvalget for Sundhedsvidenskabelig Forskning. Udvalgets eneste opga-ve er at reagere på og behandle anmeldelser af påståede tilfælde af videnskabelig uredelighed inden fordet sundhedsvidenskabelige område, dvs. forfalskning, fabrikering, plagiering og andre alvorlige brud pågod videnskabelig praksis, som er begået forsætligt eller groft uagtsomt ved planlægning, gennemførel-se eller rapportering af forskningsmæssige resultater.UVVU udgav i januar 2009 en opdateret udgave af Vejledninger i God Videnskabelig Praksis med særligfokus på sundhedsvidenskab, naturvidenskab og teknisk videnskab.6Det skal dog bemærkes, at det ikkeindgår i UVVU s formelle mandat at udgive vejledninger eller på anden måde proaktivt at deltage i un-dervisning i god praksis eller i forebyggelse af videnskabelig uredelighed. Det er, jf. universitetsloven,forskningsinstitutionernes eget ansvar at sørge for uddannelse af kommende forskere i at sikre god vi-denskabelig praksis og således forebygge videnskabelig uredelighed. UVVU har ingen forskningsfagligerådgivningsopgaver i forhold til enkelte forskere.4.4.3 DatatilsynetDatatilsynet er den statslige myndighed, der fører tilsyn med persondataloven (lov nr. 429 af 31. maj 2000 om be-handling af personoplysninger med senere ændringer). Datatilsynet kan ifølge persondataloven foretage inspekti-on af private forsknings- og statistikprojekter. Persondatalovens regler gælder bl.a. for behandling af personop-lysninger, hvis behandlingen foretages i videnskabeligt eller statistisk øjemed.Ved personoplysninger forstås oplysninger om personer, der direkte eller indirekte kan identificeres. Ved behand-ling forstås alle former for håndtering af oplysningerne, dvs. indsamling, registrering, opbevaring, anvendelse m.v.Behandles der oplysninger om enkeltpersoners rent private forhold (følsomme oplysninger) i et forsknings- ellerstatistikprojekt, skal projektet anmeldes til Datatilsynet og have Datatilsynets tilladelse. Datatilsynet opstiller enrække vilkår, som foruden lovens generelle bestemmelser skal iagttages ved projektets gennemførelse.Følsomme oplysninger er ifølge persondatalovens §§ 7 og 8 oplysninger om:•••Racemæssig eller etnisk baggrund.Politisk, religiøs eller filosofisk overbevisning.Fagforeningsmæssige tilhørsforhold.
6
Vejledningerne kan ses påwww.fi.dk.
40
•••
Oplysninger om helbredsmæssige, seksuelle og strafbare forhold.Oplysninger om væsentlige sociale problemer.Andre lignende privatlivsoplysninger.
Omfattet af udtrykket helbredsmæssige forhold er oplysninger om en persons tidligere, nuværende og fremtidigefysiske eller psykiske tilstand samt medicinbrug og misbrug af narkotika, alkohol og lignende nydelsesmidler.Omfattet af begrebet følsomme personoplysninger er også personhenførbart humant biologisk materiale (blod- ogvævsprøver m.v.).Projekter, der alene indeholder ikke-følsomme oplysninger om deltagerne, skal ikke anmeldes til Datatilsynet ellerhave tilladelse herfra. Lovens bestemmelser skal iagttages, men Datatilsynet stiller ikke konkrete vilkår for projek-tet.Efter en gennemgang af en anmeldelse udsteder Datatilsynet en tilladelse med vilkårene for projektet. Vilkårenefastsættes til beskyttelse af deltagernes privatliv og skal sikre, at personoplysningerne behandles i overensstem-melse med loven. Datatilsynets tilladelse er tidsbegrænset. Udløbsdatoen fremgår af tilladelsen. Anmeldelsen ogtilladelsen er gebyrfri.Datatilsynets behandling i forhold til biobanker er gennemgået i afsnit 6.3.1. Det bemærkes, at systematisk be-handling af følsomme oplysninger, fx biologisk materiale, til videnskabelige formål, der udføres for private, også eromfattet af persondataloven og dermed Datatilsynets kompetencer, uanset at materialet ikke indgår i en biobank,dvs. i en struktureret samling af biologisk materiale, men hvor materialet fx indsamles, analyseres og umiddelbartherefter destrueres. Dette fremgår også af Datatilsynets anmeldelsesskema "Privat forskning", hvor der er to ru-brikker - én for indsamling af biologisk materiale og én for oprettelse af en biologisk bank. Datatilsynet tager såle-des højde for den situation, at det biologiske materiale (typisk en blodprøve) ikke bliver opbevaret i længere tid,end den tid det tager at analysere den pågældende prøve.4.4.4 Det Etiske RådDet Etiske Råd er et uafhængigt råd. Rådet skal i sit virke arbejde ud fra respekt for menneskets og kommendegenerationers integritet og værdighed samt respekt for naturen og miljøet. Rådets virksomhedsområde er de eti-ske spørgsmål, der knytter sig til forskning i og anvendelse af bio- og genteknologier, der berører mennesker, na-tur, miljø og fødevarer. Rådets virksomhedsområde omfatter endvidere øvrige etiske spørgsmål, der knytter sig tilsundhedsvæsenet og den biologisk-medicinske forskning vedrørende mennesket.Rådet rådgiver Folketinget, ministre og offentlige myndigheder om etiske spørgsmål. Rådet følger desuden udvik-lingen og afgiver udtalelser eller redegørelser om almene og principielle etiske spørgsmål, som er knyttet til forsk-ning i og anvendelse af bio- og genteknologier inden for ét eller flere af følgende områder:•••Sundhedsområdet, herunder forplantningsteknologi, fosterdiagnostik samt brug af befrugtede menne-skelige æg, fosteranlæg og fostre.Natur- og miljøområdet, herunder hensyn til bevarelse af biologisk mangfoldighed samt en bæredygtigudvikling.Fødevareområdet, herunder spørgsmål om fødevareproduktion.
Rådet følger endvidere udviklingen og afgiver udtalelser eller redegørelser om de øvrige almene og principielleetiske spørgsmål, der knytter sig til sundhedsvæsenet og den biologisk-medicinske forskning vedrørende menne-sket, herunder anvendelse af nye behandlingsformer, ny diagnostisk teknik og ny medicinsk teknologi samtspørgsmål om registrering, videregivelse og anvendelse af oplysninger om arvelige sygdomme eller egenskaberhos enkeltpersoner eller grupper af personer.
41
Herudover varetager Rådet informations- og debatskabende aktiviteter om de etiske problemstillinger og udfor-dringer, som samfundet står over for. Rådet sørger for løbende at holde offentligheden orienteret om udviklingenog om sit arbejde og for, at de etiske spørgsmål gøres til genstand for debat i offentligheden. Rådet kan gøre brugaf offentlige høringer, nedsætte arbejdsgrupper m.v. til at udrede særlige spørgsmål.Det fremgår af komitélovens § 5, stk. 2, at CVK skal samarbejde med Det Etiske Råd, bl.a. ved fælles møder.Komiteen og rådet kan sammen udarbejde løbende rapporter om fælles principielle etiske problemstillinger, somhar været drøftet i fællesskab.I dag afholdes der et årligt møde mellem CVK og Det Etiske Råd. Desuden har CVK og Det Etiske Råd i 2006udgivet rapporten Obduktion og forskning på afdøde.
42
5. Internationale erfaringer - devidenskabsetiske komité-systemer i Norge, Sverige,Finland, Holland ogStorbritannien
Der sker en stigende internationalisering i disse år – både i forhold til det sundhedsvidenskabelige forskningsom-råde og i forhold til det videnskabsetiske område. Det er derfor vigtigt at se det videnskabsetiske område i en in-ternational kontekst og inddrage internationale erfaringer.Der er internationalt stor variation i organiseringen af de videnskabsetiske komitésystemer, både i forhold til hvor-dan komiteerne er opbygget og sammensat, hvilke opgaver de varetager, samt i forhold til hvordan anmeldelses-procedurerne er. Det er dokumenteret i flere rapporter, bl.a. fra den europæiske forskningsorganisation ”Euro-pean Clinical Research Infrastructures Network” (ECRIN), herunder i rapporten ”Clinical Research in Europe: inte-ractions with ethics comittees before, during and after a clinical trial” fra juni 2008, som sammenligner 10 EU-landes komitésystemer.Rapporten viser, at de forskellige landes komitésystemer varierer på en række parametre, bl.a. i forhold til antalletaf komiteer, antallet af medlemmer, andelen af lægmænd, hvilke forsøg som er anmeldelsespligtige, samt om kli-niske forsøg skal anmeldes til alle involverede komiteer i det pågældende land. Danmark er her kendetegnet vedat være et ”single opinion” system, hvilket betyder, at forsøg, som foregår flere forskellige steder i Danmark, aleneskal anmeldes til én komité, hvilket også anbefales i rapporten. Baggrunden for den store variation i de forskelligelandes komitésystemer skal i høj grad findes i kulturelle, sociale eller historiske faktorer.Med henblik på nærmere at belyse udvalgte landes komitésystemer, indeholder dette kapitel en beskrivelse af devidenskabsetiske komitésystemer i henholdsvis Norge, Sverige, Finland, Holland og Storbritannien med fokus påfølgende områder (beskrivelserne er sammenfattet i tabel 6):••••Komitésystemets organisation og opbygning.Opgaver.Anmeldelse af forsøg til komitésystemet.Tilsyn og kontrol.
Sammenligningen viser, at der generelt er stor variation i organiseringen af komitésystemerne, og at det danskekomitésystem har en række lighedstræk med de øvrige landes komitésystemer, men også en række særtræk.Det gælder fx flertallet af lægmænd i såvel CVK som de regionale komiteer, at de decentrale komiteer er udpegetaf et decentralt politisk niveau, CVKs størrelse, samt kravet om at forsøgsprotokollen skal indsendes på dansk.
43
Tabel 6: Sammenligning af de videnskabsetiske systemer i Norge, Sverige, Finland, Holland, Storbritannien og DanmarkNorgeJa (12 medl., heraf 2 læg-mænd)7 (9 medl.)Antal decentrale komiteerRådgivningKoordineringKlageinstansSverigeJa (7 medl., heraf 2 læg-mænd)12 (16 medl., heraf 5lægmænd)KlageinstansTilsynsmyndighedFinlandJa - ETENA (18 medl.) ogTUKIJA (10 medl.)30 (min. 7 medl.)ETENE: Etiske udtalelserog rådgivning af politikereTUKIJA: Klageinstans ogbehandling af internationa-le multicenterforsøgBehandle ansøgningerHollandJa (højest 15 medl., herafmindst 1 lægmand)30 (varierende antal medl.,dog min. 5)Akkreditere/supervisere/monitorere decentrale komi-teerKlageinstansBehandle ansøgningerKompetent myndighed ift.lægemiddelforsøgBehandle ansøgningerStorbritannienNej – central styrelse111 (7 – 18 medl., heraf 1/3lægmænd)Central styrelse:Akkreditere/supervisere/monitorere decentrale komi-teerUdstede vejledningerUddannelse af komitémed-lemmerBehandle ansøgningerTilsyn med projekterIkke oplyst.DanmarkJa (26 medl., lægmandsfler-tal)11 (7 – 11 medl., lægmands-flertal)RådgivningKoordineringKlageinstans
Central komite
Den centrale komités op-gaver
De decentrale komiteersopgaver
Behandle ansøgningerVejledning og rådgivningCentralt (fast sekr.leder).Decentralt (2-3 ansatte perkomité)Nej
Behandle ansøgninger
Behandle ansøgningerVejledning og rådgivningCentralt (4 ansatte).Decentralt - fem regionalesekretariater (1 – 9 ansatte)Nej
Sekretariatsfunktioner
Centralt (4 + videnskabeligsekr.). Decentralt (viden-skabelig sekr. + antal adm.sekr.)Nej
Ikke oplyst.
Centralt (14 ansatte + eks-terne rådgivere.Ja (udvalgte områder)
Behandler den centralekomité ansøgninger somførsteinstansKlageafgørelserVejledningerMøderForsøgsansvarligHvem anmelder forsøgJaMuligt at indsende for-søgsprotokol på engelskNejGebyrCa. 1.500 (2007)Årligt antal projektansøg-ningerKomitésystemet fører ikkekontrolDen centrale komité ertilsynsmyndighedJa (fast gebyr på 2.000 -16.000 SKR.)4.002 (2007)JaKlageafgørelserUdtalelser/vejledningerMøderSponsor
Ja (internationale muliti-centerforøg)
-
Udtalelser
Redskaber til sikring afensartethed og koordine-ring
AkkrediteringDirektiver/ guidelinesKlageafgørelserSponsorJa
Akkreditering, vejledning oguddannelse’Testsager’ForsøgsansvarligJa
KlageafgørelserVejledningerMøderForsøgsansvarligNej
ForsøgsansvarligJa
Ja (varierende op til 1.500euro)Opgøres ikke
Ja (varierende op til ca.5.000 Euro)Ca. 1600 (2008)
NejCa. 6.700
Ja (4.000 kr., 1.500 for til-lægsprotokoller)Ca. 1.000 – 1.100
Ikke systematisk kontrol
Opfølgning og kontrol
Betingelser ifm. godkendel-se
Ikke systematisk kontrol
De regionale komiteer skalføre kontrol, ikke systema-tisk kontrol
44
5.1.5.1.1.
Det norske videnskabsetiske komitésystemKomitésystemets organisation og opbygning
Det norske komitésystem består af en central komité ”NEM” (Den nasjonale forskningsetiske komité for medisinog helsefag) og 7 decentrale komiteer fordelt på de 4 helseregioner (4 komiteer i SØR-ØST). Der er i Norge ved-taget relativt ny lovgivning på området.7Den centrale komité - NEMNEM er nedsat af Kunnskapsdepartementet, som også fastlægger NEM’s ansvarsområder og udnævner med-lemmerne. NEM består af 12 medlemmer (antallet af fastsat ved lov), som er udpeget af ministeriet efter indstil-ling fra det norske forskningsråd. Det er ligeledes fastsat ved lov, at NEM skal have kompetence indenfor relevan-te forskningsdiscipliner, etik og jura, ligesom der også skal være lægmandsrepræsentation. P.t. har komiteen 2lægmænd.NEM har en fast sekretariatsleder, som tager sig af den løbende virksomhed til komiteen.Det kan i øvrigt nævnes, at NEM er én blandt flere nationale forskningsetiske komiteer, som tilsammen skal dæk-ke alle fagområder. Der er således også komiteer vedr. naturvidenskab og teknologi, samfundsvidenskab og hu-maniora, granskning af redelighed i forskning m.v. De forskellige nationale forskningsetiske komiteer har et sam-let sekretariat med fælles ansatte indenfor information og administration.De decentrale komiteerDe decentrale komiteer er nedsat centralt af Kunnskapsdepartementet, som også fastlægger komiteernes an-svarsområder og udnævner medlemmerne. De for øjeblikket 7 decentrale komiteer består alle af 9 medlemmer,som er udpeget af ministeriet efter indstilling fra relevante organer. Det er fastsat ved lov, at de decentrale komi-teer skal have kompetence indenfor relevante forskningsdiscipliner, etik og jura, ligesom de også skal have læg-mandsrepræsentation.De decentrale komiteer skal være tilknyttet de fire, norske medicinske fakulteter og sorterer administrativt underdisse. De decentrale komiteer har selvstændige sekretariater med ca. 2-3 ansatte per komité. De 4 komiteer iSØR-ØST har et fælles sekretariat.
Forslag om ændring af sekretariatsfunktionen i NorgeDet planlægges at ændre organiseringen af de decentrale komiteers sekretariater. Forslaget er at centrali-sere sekretariatsfunktionerne i ét forvaltningsorgan med en direktør, bl.a. med henblik på at sikre størreensartethed i sagsbehandlingen. Sekretariaterne vil dog fortsat være fysisk placeret regionalt på universite-terne.
5.1.2.
Opgaver
Den centrale komité – NEMNEMs opgaver er dels at være rådgivende og koordinerende instans i forhold til de decentrale komiteer, dels atfungere som klageinstans for projekter behandlet i de decentrale komiteer.
7
Lov nr. 44 af 20. juni 2008 om medisinsk og helsefaglig forskning (helseforskningsloven), som trådte i kraft 1. juli 2009 samt lov nr. 56 af 30. juni
2006 om behandling af etikk og redelighet i forskning.
45
Samarbejdet mellem NEM og de decentrale komiteer bliver varetaget ved møder mellem leder og sekretær fraalle komiteerne to gange årligt. Ligeledes mødes samtlige komitémedlemmer fra NEM og de decentrale komiteerårligt til et 2-dages møde.Derudover sikres koordinering og ensartethed i forhold til de regionale komiteer bl.a. ved hjælp af præcedensska-bende klageafgørelser, vejledninger (fx om emner hvor der har været uens sagsbehandling) samt kurser for deregionale komiteers medlemmer.De decentrale komiteerDe decentrale komiteer har til opgave:•••At behandle ansøgninger om godkendelse af biomedicinske forskningsprojekter.At vejlede og give råd om forskningsetiske spørgsmål.At arbejde for at gøre forskningsetiske principper kendt.
Komiteernes afgørelser kan påklages til NEM.Den nye helseforskningslov, som trådte i kraft den 1. juli 2009, indebærer, at de decentrale komiteer har overta-get en række opgaver, som tidligere var placeret hos Helsedirektoratet og Datatilsynet, bl.a. i forhold til godken-delse af forskningsbiobanker, dispensation fra tavshedspligt og behandling af personoplysninger. Lovens over-ordnede princip er ”en lov – en postkasse”; og postkassen er de decentrale komiteer. Det bemærkes dog, at dennorske Lægemidddelstyrelse forsat har egen postkasse.Komiteerne skal forelægges samtlige biomedicinske forskningsprojekter, hvor der indgår forsøg på mennesker,og som er af en sådan art, at det ikke er en del af en etableret behandlingsprocedure. Det gælder både terapeu-tisk og ikke-terapeutisk forskning på patienter og raske forsøgspersoner. Det bemærkes, at anonymt, biologiskmateriale ikke er anmeldelsespligtigt i Norge.5.1.3.Anmeldelse af forsøg til komitésystemet
Det er projektlederen af forsøget, der skal anmelde et forsøg (svarende til den forsøgsansvarlige i Danmark). An-søgningen skal indsendes ved hjælp af et elektronisk ansøgningsskema. Selve ansøgningen samt øvrige doku-menter skal som hovedregel indsendes på norsk, men engelske forsøgsprotokoller accepteres.Projektansøgninger bliver fordelt til den region, hvor projektlederen har sit hovedarbejdssted. Det gælder ogsåmulticenterforsøg. Hvis en region får uforholdsmæssigt mange ansøgninger, kan projektansøgningen dog blivefordelt til andre regioner. Der er tale om et ”overrislingsprincip”, hvor en komité max kan have 25 sager til behand-ling på et komitémøde. Yderligere sager vil blive fordelt til en anden komité.Der opkræves ikke gebyr for at behandle ansøgninger.I 2008 behandlede NEM 7 klagesager. I 2007 behandlede de decentrale komiteer ca. 1500 projektansøgninger.5.1.4.Tilsyn og kontrol
Komitesystemet fører ikke tilsyn med godkendte forskningsprojekter. Statens helsetilsyn fører tilsyn med medi-cinsk og sundhedsfaglig forskning og forvaltningen af forskningsbiobanker, og Datatilsynet fører tilsyn med bru-gen af sundhedsoplysninger.
46
5.2.5.2.1.
Det svenske videnskabsetiske komitésystemKomitésystemets organisation og opbygning
Det svenske komitésystem består af en central komité ”CEPN” (Centrale etikprövningsnämnden) og 12 decentra-le komiteer placeret i 6 regioner.Komitésystemet er reguleret i etikprøvningsloven.8Loven omfatter forskning på levende mennesker, forskning påafdøde og biologisk materiale fra mennesker samt forskning, som indebærer håndtering af personfølsomme op-lysninger, dvs. lovens genstandsområde er bredere end den danske lovgivning. Det bemærkes, at anonymt, bio-logisk materiale ikke skal anmeldes til komitésystemet i Sverige.Den centrale komité - CEPNCEPN er nedsat af regeringen. Det er fastsat ved lov, at CEPN skal bestå af en formand, som skal være eller tid-ligere have været dommer, og 6 medlemmer (4 med forskningsbaggrund og 2 lægmænd, som dog også godt kanhave en medicinsk baggrund). CEPN er en selvstændig myndighed, men er administrativt tilknyttet Vi-denskabsrådet.Til CEPN er tilknyttet et sekretariat, som består af en chefjurist og tre jurister samt en videnskabelig sekretær,som er medlem af CEPN og ansat på ca. 10 % af fuld tid. Den videnskabelige sekretær bistår med videnskabeligkompetence i sagsforberedelsen.De decentrale komiteerDe 12 decentrale komiteer er forankret i 6 regioner og har sæde ved universiteterne i Gøteborg (2), Linkøbing (1),Lund (2), Umeå (1), Uppsala (2) samt ved Karolinska Instituttet i Stockholm (4). Der er alene tale om administra-tiv tilknytning til universiteterne. Komiteerne har selvstændig beslutningskompetence.I hver region er mindst 2 komiteer – én som beskæftiger sig med medicinsk og én som beskæftiger sig med øvrigforskning). I alt findes 12 komiteer vedr. medicinsk forskning, dvs. svarende til de danske regionale komiteer, og 6komiteer vedr. øvrig forskning.Medlemmerne af de decentrale komiteer er ligeledes udnævnt af regeringen. Det fremgår af loven, at hver komitéskal have en formand, som skal være dommer eller tidligere have været dommer, og 15 medlemmer (10 med-lemmer med forskningsbaggrund og 5 lægmænd).Blandt medlemmerne med forskningsbaggrund udnævnes en videnskabelig sekretær, som sammen med for-manden har ansvar for at forberede og håndtere sagerne. De regionale komiteer har derudover en række admini-strative sekretærer. Gøteborg har 2,8, Linkøbing har 1,5, Lund har 2,5, Stockholm har 5, mens de administrativeopgaver i Umeå og Uppsala håndteres af universiteterne.5.2.2.Opgaver
Den centrale komité - CEPNCEPN har til opgave at:••Fungere som klageinstans for afgørelser truffet af de decentrale komiteer.Behandle sager, hvor et mindretal i en decentral komité ønsker sagen afgjort centralt.
8
Lov nr. 460 af 6. maj 2003 om etikprövning af forskning som avser människor med senere ændringer.
47
•
Fungere som tilsynsmyndighed vedr. overholdelse af etikprövningsloven samt retsforskrifter udstedt imedfør af loven.
Samarbejdet mellem CEPN og de decentrale komiteer bliver bl.a. varetaget ved et årligt nationalt møde mellemformændene for de regionale komiteer, de videnskabelige sekretærer og de administrative sekretærer med fokuspå specifikke emner, ligesom også Videnskabsrådet har en særlig referencegruppe med repræsentanter fra dedecentrale komiteer og CEPN, som mødes 3-4 gange årligt. Derudover sikres koordinering og ensartethed i for-hold til de regionale komiteer bl.a. ved hjælp af CEPN´s klageafgørelser, som er praksisgivende. CEPN udarbej-der ligeledes fortolkninger/vejledninger om udvalgte emner, hvor der har været tvivlsspørgsmål (fx om definitionenaf forskning).De decentrale komiteerDe decentrale komiteer har til opgave at behandle (medicinske) forskningsprojekter under hensyntagen til såvelforsøgspersonernes velfærd som samfundets og videnskabens interesser. Forsøgspersonernes velfærd kommeraltid i første række.De decentrale komiteers afgørelser kan indklages til CEPN. Derudover kan et mindretal af komiteens medlemmer(mindst 3) i tilfælde af uenighed om afgørelsen kan kræve, at sagen afgøres af CEPN.5.2.3.Anmeldelse af forsøg til komitésystemet
Det er forskningshovedmanden defineret som ”en statslig myndighed eller en fysisk eller juridisk person i hvisvirksomhed forskningen udføres”, der skal anmelde et forsøg (svarende til sponsor i Danmark).Ansøgningen skal indsendes på svensk i 18 eksemplarer (1 original og 17 kopier) til den komité, hvor sponsor hø-rer hjemme. Der er ikke krav om, at forsøgsprotokollen skal oversættes til svensk.Sagsbehandlingstiderne følger GCP-direktivets regler.De decentrale komiteer opkræver et gebyr på mellem 5.000 og 16.000 svenske kr. alt efter forskningsprojektetskarakter for at behandle en ansøgning. Gebyret for en ændringsansøgning er 2.000 svenske kr.I 2007 behandlede CEPN 39 klagesager. De decentrale komiteer behandlede i 2007 i alt 4002 sager.5.2.4.Tilsyn og kontrol
CEPN har til opgave at fungere som tilsynsmyndighed i forhold til overholdelse af etikprövningsloven samt deretsforskrifter, som er udstedt i medfør af loven. Det gælder dog ikke situationer, hvor andre myndigheder har til-synsbeføjelsen (fx Datainspektionen, Läkemedelsverket eller Socialstyrelsen).Tilsynet har til formål at sikre, at der ikke bedrives forskning, som er omfattet af loven, uden tilladelse fra en de-central komité, samt at de godkendte projekter udføres i overensstemmelse med den meddelte tilladelse. For atsikre dette har CEPN en række beføjelser, herunder til at få adgang til relevant information og dokumentation ogtil at få adgang til de konkrete forskningslokaliteter, men også til at udstikke påbud og udskrive bøder.Der er to indgange til CEPNs tilsyn, dels at følge op på konkrete anmeldelser, dels af egen drift at tage initiativ tilat føre tilsyn. For så vidt angår muligheden for at tage initiativer på egen drift, har CEPN besluttet at udvise forsig-tighed. Fx har CEPN endnu ikke gjort brug af muligheden for at få adgang til konkrete forskningslokaliteter. Det ersåledes relativt sjældent, at CEPN tager sager op af egen drift, men CEPN har i enkelte tilfælde fulgt op på, omen ansøgning med betinget godkendelse er blevet ændret i overensstemmelse med godkendelsens forudsætnin-ger.
48
CEPN udarbejder en årlig tilsynsplan, som beskriver mål og indsats for det kommende års tilsyn.
5.3.5.3.1.
Det finske videnskabsetiske komitésystemKomitésystemets organisation og opbygning
Det finske videnskabsetiske komitésystem er forankret mellem Undervisningsministeriet, Social- og Sundhedsmi-nisteriet og Land- og Skovbrugsministeriet. Det finske komitésystem består af seks centrale komiteer, som erspecialiserede til at håndtere forskellige områder. Det nationale rådgivende udvalg for sundhedsetik (ETENE) ogdennes underkomité for medicinsk videnskabsetik (TUKIJA) er de relevante komiteer i sammenligning med deøvrige landes videnskabsetiske komitésystemer.På det decentrale niveau består det finske system af 30 komiteer, som udpeges af Finlands 21 hospitalsregioner.Der skal som udgangspunkt være mindst én komité pr. region. Regioner kan dog gå sammen om at oprette de-centrale komiteer. Endelig er der enkelte større forskningsinstitutioner, der har lokale komiteer. Disse har dog in-gen formel autoritet.Rammerne for det finske videnskabsetiske komitésystem er fastlagt ved lov.9Det centrale niveau – ETENE og TUKIJAETENE (Det nationale rådgivende udvalg for sundhedsetik) er et forum for sundhedsetisk debat og består af enformand, en næstformand og 16 medlemmer, som repræsenterer patientforeninger, leverandører af sundheds-ydelser, sundhedsfaglige personer, jurister og forskere. Mindst fire personer er medlemmer af det finske parla-ment og udvælges så de afspejler parlamentets partipolitiske sammensætning. ETENE er forankret i det finskeSocial- og Sundhedsministerium.ETENE har underkomiteen TUKIJA (Underkomiteen for medicinsk videnskabsetik), som består af 10 medlemmermed baggrund i farmaci, genetik, epidemiologi og andre former for sundhedsvidenskab. Der er endvidere læg-mandsrepræsentation i underkomiteen samt en repræsentant for en patientforening.De decentrale komiteerDet er fastsat ved lov, at de decentrale komiteer skal bestå af en formand og mindst 6 øvrige medlemmer. Mindst2 medlemmer skal være lægmænd. Beslutning træffes ved flertal af mindst 4 personer. Blandt de 4 skal væremindst én lægmand samt formanden eller næstformanden.5.3.2.Opgaver
De centrale komiteer - ETENE og TUKIJAETENE er ikke involveret i den videnskabsetiske bedømmelse af forskningsprojekter, men har mere overordnedeopgaver som kan sammenlignes med de opgaver, Etisk Råd har i Danmark, herunder udarbejdelse af udtalelserom etiske problemstillinger.Det er underkomiteen TUKIJA, som fungerer som klageinstans for de 30 decentrale komiteer. TUKIJA er desudenførstebehandler på internationale multicenterforsøg. Endelig skal TUKIJA støtte de decentrale komiteer i centraleetiske spørgsmål.
9
Lag om medicinsk forskning 9.4.1999/488, som er revideret i 2004 (vedr. de regionale komitéer) og Decree on the National Advisory Board on
Health Care Ethics 494/1998 vedr. ETENE og TUKIJA.
49
Det decentrale niveauDe decentrale komiteer behandler ansøgninger om godkendelse af biomedicinske forsøg. Komiteerne behandlerendvidere ansøgninger vedr. vævsstudier, epidemiologiske studier og studier baseret på interviews. Komiteernekan ydermere vælge at behandle andre studier, der direkte eller indirekte involverer forsøgspersoner.De decentrale komiteer skal agere i henhold til de udtalelser om etiske problemstillinger, som udarbejdes afETENE. Disse udtalelser antager normalt meget konkret karakter, eksempelvis vedr. stamcelleforskning, forsk-ning vedr. inddragelse af børn, forskning med inddragelse af ældre mennesker mv.5.3.3.Anmeldelse af forsøg til komitésystemet
Ansøgningen om godkendelse af et biomedicinsk forsøg fremsendes af den forsøgsansvarlige forsker. Det finskeSocial- og Sundhedsministerium har udarbejdet et fælles ansøgningsskema, der gælder for alle regionale komite-er samt for ansøgninger til TUKIJA.Forsøgsprotokollen kan fremsendes på engelsk, men den skal være vedlagt et lægmandsresume på finsk (mak-simalt 5 sider).Sagsbehandlingstiderne følger GCP-direktivets regler.Forsøg, der omfatter private aktører, kan underlægges gebyrer. Den decentrale komité kan selv fastsætte geby-rets størrelse, dog maksimalt 1.500 euro. Sager, der førstebehandles i TUKIJA, og som involverer private aktører,er underlagt gebyr på 1.500 euro. Sager, der kun omfatter offentlige forskningsinstitutioner, er ikke underlagt ge-byr.Der udarbejdes ikke aktivitetsstatistik for komitesystemet i Finland med undtagelse af lægemiddelafprøvninger.Der blev i 2008 gennemført ca. 300 lægemiddelafprøvninger.5.3.4.Tilsyn og kontrol
Mulighederne for tilsyn og kontrol med forskerne er begrænsede i det finske system. Foruden godkendelse af for-søgsprotokoller og tillægsprotokoller forud for forsøgets igangsættelse, har de finske komiteer ikke mulighed for atgennemføre kontrol. De decentrale komiteer har således ikke mulighed for at afbryde et forsøg, når det først erigangsat.
5.4.5.4.1.
Det hollandske videnskabsetiske komitésystemKomitésystemets organisation og opbygning
Det hollandske komitésystem består af en central videnskabsetisk komité ”CCMO” (The Central Committee onResearch Involving Human Subjects) og ca. 30 decentrale komiteer (Medical Research Ethics Committees –MRECs), som er akkrediteret af CCMO. Komitésystemet er reguleret ved lov.10Biomedicinsk forskning, som involverer mennesker som forsøgsobjekter, skal vurderes af en videnskabsetisk ko-mité. I henhold til lov om embryoer skal også forskning på humane embryoer vurderes af komitésystemet.
10
Lov om medicinsk forskning, der involverer mennesker som forsøgsobjekter (WMO). Loven trådte i kraft i 1. december 1999 og er senest æn-
dret i marts 2006.
50
Den centrale komité – CCMOCCMO består af højest 15 medlemmer, som udpeges af sundhedsministeren. Det er fastsat ved lov, at CCMOaltid skal bestå af en eller flere læger samt eksperter i embryologi, farmakologi, sygepleje, adfærdsvidenskab, ju-ra, videnskabsmetodologi og etik. Derudover skal der også være en repræsentant, som ser på projektet med for-søgspersonens øjne.CCMO har desuden tilknyttet et sekretariat (pt. 14 personer) samt en række rådgivere vedr. reproduktion, gente-rapi, immunologi, xenotransplantation samt juridiske spørgsmål.De decentrale komiteer - MRECsDer er omkring 30 decentrale komiteer i Holland, som alle er akkrediteret af CCMO. Loven fastlægger en rækkekrav, som skal være opfyldt for, at en decentral komité kan blive akkrediteret, herunder at komiteens medlemmersom minimum skal omfatte en eller flere læger, eksperter i jura, videnskabsmetodologi og etik samt en repræsen-tant, som ser på projektet med forsøgspersonens øjne. En komité skal således som minimum bestå af 5 perso-ner. For at en komité skal kunne behandle kliniske forsøg med lægemidler, skal der også være eksperter i farma-kologi og klinisk farmakologi i komiteen.5.4.2.Opgaver
Den centrale komité – CCMOCCMO har til opgave at:•••••Akkreditere de decentrale komiteer på baggrund af de krav og forudsætninger, som lovgivningen udstik-ker.Supervisere/monitorere de decentrale komiteers arbejde, ligesom CCMO også kan vedtage suppleren-de direktiver/guidelines i forhold til komiteernes arbejdsgange m.v.Fungere som klageinstans.Føre register over alle vurderede projekter.Informere om lovens implementering.
Derudover er CCMO også selv en forskningskomité, som behandler bestemte typer forskningsprojekter som før-steinstans, herunder forskningsprojekter vedr. genterapi, xenotransplantation, heroinafhængighed, somatisk celle-terapi, vacciner m.v. samt forskning på genmodificeret organismer, embryoer m.v. CCMOs afgørelser kan påkla-ges til sundhedsministeren.I forlængelse af implementeringen af GCP-direktivet behandler CCMO også alle lægemiddelforsøg som kompe-tent myndighed, dvs. svarende til den funktion Lægemiddelstyrelsen har i Danmark. Alle forskningsprojekter vedr.lægemidler skal således indsendes til CCMO, der skal behandle sagerne som kompetent myndighed i henhold tilden europæiske regulering om lægemidler. I de situationer, hvor CCMO fungerer som førsteinstans, er det sund-hedsministeren, som er den kompetente myndighed.CCMO har en række redskaber til at sikre ensartethed og koordinering i forhold de decentrale komiteer. Bl.a. ikraft af akkrediteringssystemet. Lovgivningen fastsætter en række krav, som en komité skal opfylde for at bliveakkrediteret. Derudover har CCMO udarbejdet en række direktiver, som yderligere specificerer kravene til de re-gionale komiteers sammensætning (herunder specifikke krav til medlemmernes kompetencer), organisering ogarbejdsgange.CCMO har desuden lovhjemmel til at udstede guidelines samt til at tage akkrediteringen fra en komité, som ikkelængere lever op til de fastsatte krav, eller som ikke behandler et tilstrækkeligt antal ansøgninger. En akkrediteret
51
komité skal som minimum behandle 10 ansøgninger over en periode på 2 år. En nyakkrediteret komité skal dogde første 2 år som minimum behandle 10 ansøgninger om året.De decentrale komiteer - MRECsDe decentrale komiteer har til at opgave at behandle biomedicinske forskningsprojekter, som involverer forsøg påmennesker.De decentrale komiteer afgrænser selv, hvilket geografisk område de dækker, og hvilket gebyr de tager for at be-handle en sag. I praksis dækker hovedparten af komiteerne hele Holland. De fleste decentrale komiteer er tilknyt-tet en anden institution som fx et universitet eller et hospital. En komité, som er tilknyttet en anden institution, skalsom minimum have ét medlem, som ikke arbejder for den pågældende institution.5.4.3.Anmeldelse af forsøg til komitésystemet
Det er sponsor, som skal anmelde et forsøg, og sponsor afgør selv, hvilken komité der skal behandle et giventforskningsprojekt. Ansøgningen skal indsendes i ét eksemplar i papirform. Der er ikke krav om, at forsøgsproto-kollen skal oversættes til hollandsk, men hvis undersøgelsen skal optages i det kliniske forsøgsregister, skal derindsendes et resumé på hollandsk.Såvel de decentrale komiteer som CCMO har 8 uger til at behandle en anmeldelse. Denne frist kan forlængesmed yderligere 8 uger ved skriftlig orientering af anmelder. For så vidt angår lægemiddelforsøg gælder GCP-direktivets regler om en sagsbehandlingstid på højest 60 dage.Komiteerne har hjemmel til at opkræve gebyr for at behandle en ansøgning. CCMO opkræver ikke gebyr. De de-centrale komiteer afgør selv, hvor stort et gebyr de vil opkræve. Alle MRECs opkræver gebyr for at behandle for-søgsprojekter anmeldt af industrien. Dette varierer mellem ca. 1500 Euro og ca. 5.000 Euro. Flere MRECs op-kræver ikke gebyr for at behandle forskningsprojekter anmeldt af den institution, de er tilknyttet.I 2008 behandlede CCMO 68 sager som førsteinstans. De decentrale komiteer behandlede ca. 1600 sager.5.4.4.Tilsyn og kontrol
CCMO fører et register over alle vurderede projekter og udgiver en årlig rapport, som indeholder en oversigt overde forskningsprojekter, som er blevet behandlet af komitésystemet.Derudover anmoder komiteerne i forbindelse med godkendelse af et projekt ofte om at blive orienteret om start ogslutdato, tilføjelser til forsøgsprotokollen, eventuelle utilsigtede hændelser, status samt forsøgets resultater.
5.5.5.5.1.
Det britiske videnskabsetiske komitésystemKomitésystemets organisation og opbygning
Det britiske videnskabsetiske komitésystem ”National Research Ethics Service” (NRES) blev etableret som et na-tionalt offentligt system i 2004 og er reguleret ved lov.11Indtil da var systemet baseret på frivillighed og græsrods-engagement.NRES er forankret i ”National Patient Safety Agency”, som er en styrelse under det britiske sundhedsministerium.NRES består af et centralt sekretariat (NRES Head Office)12og 111 decentrale komiteer (RECs – Research
11
”The Medicines for Human Use (Clinical Trials) Regulations” fra 2004.
52
Ethics Committees, 2008). Det er Storbritanniens 10 sygehusregioner, der opretter de decentrale komiteer og ud-peger medlemmer. De decentrale komiteer skal dog godkendes og akkrediteres af ”The UK Ethics CommiteeAuthority” (UKECA), som er en slags centralkomité bestående af de fire sundhedsministre fra England, Skotland,Wales og Nordirland. UKECA sekretariatsbetjenes af NRES Head Office.Det britiske system adskiller sig således fra en række andre landes systemer ved ikke at have en egentlig fagligcentral komité.NRES Head OfficeNRES Head Office har 25 ansatte bestående af læger, kontorpersonale, budgetmedarbejdere og revisorer.De decentrale komiteer (RECs)Sammensætningen af de enkelte RECs er fastsat ved lov, og komiteerne skal have mindst 7 medlemmer ogmaksimalt 18 medlemmer. Mindst en tredjedel af medlemmerne skal være lægmænd, og mindst halvdelen aflægmændene må aldrig have været ansat i sundhedsvæsenet.I øvrigt skal det i sammensætningen tilstræbes at:•••••Medlemmerne skal have bred erfaring og viden, der sikrer, at de er i stand til at bedømme ansøgninger-ne.De enkelte komiteer skal afspejle den etiske debat i samfundet.Medlemmerne skal udpeges i deres personlige egenskab.Sammensætningen skal afspejle den offentlige opinion.Medlemmer skal afspejle alle samfundslag.
Medlemmerne er foruden sundhedsfagligt personale typisk statistikere, farmaceuter, akademikere, jurister, filosof-fer og teologer.Sygehusregionerne skal i henhold til loven stille sekretariatsfunktioner og sekretariatsmedarbejdere til rådighedfor de enkelte komiteer. Komitémedlemmerne arbejder frivilligt og modtager ingen aflønning.De decentrale komiteer er inddelt i tre forskellige typer, som har varierende kompetence i forhold til hvilke typer afforskningsprojekter, de kan behandle og godkende. Foruden de decentrale komiteer findes ”The UK Gene Thera-py Advisory Committee” (GTAC), som vurderer projekter, der omhandler genterapi og stamcelleforskning. Komi-teen dækker hele Storbritannien og skal foruden sagsbehandling rådgive sundhedsmyndighederne om brug afgen- og stamcelleteknologier i behandling.5.5.2.Opgaver
NRES Head OfficeNRES Head Office udstikker rammerne for aktiviteterne i det britiske videnskabsetiske komitésystem. Opgaverneomfatter:••Styring og uddannelse, herunder udvikling af styringsdokumenter for de 111 regionale komiteer samtuddannelse af de decentrale komiteers medlemmer.Budget, herunder ansvar for fordeling af midler mellem de regionale komiteer.
12
Der er mindre Head Offices in Skotland, Wales og Nordirland, som udfylder den samme rolle som det engelske.
53
••
Vejledning af ansøgere, herunder udarbejdelse af vejledninger og retningslinjer for ansøgere til de vi-denskabsetiske komiteer.Kontrol og rådgivning: NRES Head Office skal rådgive de britiske sundhedsmyndigheder i sager vedr.videnskabsetiske problemstillinger og kontrollere de decentrale komiteer. Dette gøres blandt andet viagennemførelse af brugertilfredshedsundersøgelser, akkreditering mv. Der har endvidere været gennem-ført konsistensanalyser af afgørelser på udvalgte områder. Dette gøres bl.a. ved at lade en række komi-teer behandle samme sag, og se hvor stor forskellen er.
•
Statistik og publicering, herunder vedligehold af database for anmeldte forsøg, udgivelse af årsrapporter,aktivitetsstatistik mv.
NRES Head Office fungerer ikke som klageinstans ved afgørelser truffet i en regional komité. Hvis en afgørelseindklages, oversendes den blot til en anden komité eller behandles i et ad hoc panel nedsat af UKECA. Den sid-ste mulighed anvendes dog sjældent.De decentrale komiteerDe decentrale komiteer forestår den egentlige behandling af ansøgninger. Alle forskningsprojekter, der omfatterNHS patienter, ansatte eller andre ressourcer, skal anmeldes til en komité. Anmeldelsespligten er således ikkebegrænset til forskningsprojekter, hvor der indgår forsøgspersoner, som det er tilfældet i Danmark.5.5.3.komité.Ansøgningen fremsendes via det integrerede forskningsansøgningssystem (IRAS), som både håndterer ansøg-ninger til lægemiddelmyndighederne, de videnskabsetiske komiteer og en række mindre regulerende organer.Forud for fremsendelse af ansøgningen skal man telefonisk reservere tid til behandling af ens ansøgning. Forde-ling af sager mellem komiteerne afhænger af sagstype, men geografien er ikke afgørende. En ansøger kan bedeom, at en navngiven komité behandler ansøgningen.Sagsbehandlingen må maksimalt tage 60 dage fra ansøgningen er afsendt, men den gennemsnitlige sagsbe-handlingstid var i 2008 35 dage. Fra sagen har været behandlet på et møde, må der maksimalt gå 10 dage, indenansøgningen er besvaret.Der anmeldes til stadighed færre og færre forskningsprojekter til de britiske komiteer. Der blev således anmeldt9.760 forsøg i 2004/2005, mens der i 2008/2009 blev anmeldt 6.761 forsøg. 5-10 % af sagerne afvises, mens ca.20 % godkendes i første omgang. De øvrige godkendes med betingelse eller sendes til second opinion.Anmeldelse af forsøg til komitésystemet
Det er projektlederen af forsøget (den forsøgsansvarlige), der står for anmeldelse af projektet til den decentrale
5.5.4.
Tilsyn og kontrol
Der foregår ikke systematisk kontrol med forskningsforsøgene, men en komité kan til enhver tid trække sin acceptaf et forskningsprojekt tilbage.
54
6. Analyse af problemstillinger ogudfordringer ved detnuværende videnskabsetiskekomitésystem
6.1.
Indledning – styrkelsen af et velfungerende komitésystem
Dette kapitel indeholder en analyse af de problemstillinger og udfordringer, som udvalget finder, eksisterer i for-hold til det nuværende videnskabsetiske komitésystem. Analysen bygger på medlemmernes bidrag, udvalgetsegne analyser samt de bidrag og inputs, udvalget og Indenrigs- og Sundhedsministeriet har modtaget fra interes-senter på området. Analysen er struktureret i forhold til følgende temaer:••••Komitésystemets struktur, herunder komiteernes sammensætning og rammevilkår (afsnit 6.2).Komitésystemets opgaver og opgaveportefølje, herunder opfølgning og kontrol (afsnit 6.3).Forsøgspersonens deltagelse i forsøg (afsnit 6.4).Komitésystems sagsbehandling og opgavevaretagelse (afsnit 6.5).
Udvalgets anbefalinger til indretningen af fremtidens videnskabsetiske komitésystemet tager udgangspunkt i den-ne analyse og beskrives i kapitel 7.Indledningsvist vil udvalget gerne understrege, at Danmark har et godt komitésystem med et godt ry – nationaltsom internationalt. Udvalget ser det derfor som sin opgave at identificere de relevante problemstillinger og udfor-dringer med henblik på at skabe rammerne for at gøre et godt komitésystem endnu bedre og fremtidssikre syste-met.Som det fremgår af kapitel 3, fik Danmark som det første land i verden et egentligt komitésystem i 1980. Syste-met var i først omgang en frivillig ordning, men blev lovreguleret i 1992. I forbindelse med at systemet blev lovre-guleret, var der altovervejende tale om en lovfæstelse af den hidtidige model. De efterfølgende lovrevisioner harogså primært været gennemført som følge af anden lovgivning og international regulering, hvilket indebærer, atden nuværende lov og det nuværende system er et konglomerat af den oprindelige aftalebaserede ordning ogsenere ændringer. Der har ikke i forbindelse med de foretagne lovrevisioner været foretaget en fuldstændig gen-nemgang af hele området med henblik på at vurdere, om den nuværende organisering af komitésystemet er denmest hensigtsmæssige set i lyset af den udvikling, der er sket i samfundet som helhed og på det videnskabse-tiske og det sundhedsvidenskabelige forskningsområde i særdeleshed.Overordnet indebærer den rivende udvikling, der sker i disse år med hensyn til den sundhedsvidenskabeligeforskning, en række ændrede rammevilkår for komitésystemet og de krav, der stilles til systemet.
55
Klinisk forskning foregår i stigende grad internationalt, og komitésystemet præges, som det fremgår af kapitel 3,af flere internationale retskilder, hvilket betyder, at det er nødvendigt at se det videnskabsetiske komitésystem ien international og ikke mindst europæisk kontekst. Det er vigtigt, at komitésystemet løbende opfanger og indar-bejder internationale tendenser. Udvalget er også opmærksomt på, at der i EU-regi på baggrund af et ”PublicConsultation Paper”, netop er gennemført en bred høring af GCP-direktivet og dets anvendelsesområde, som po-tentielt kan resultere i en revision af GCP-direktivet.13Dette kan også få konsekvenser for komitésystemet.Afgørelsen af, hvorvidt et givent forskningsprojekt placeres i Danmark, sker i stigende grad i international konkur-rence. Samtidig bliver sundhedsvidenskabelig forskning, særligt på lægemiddelområdet, i stigende grad gennem-ført multinationalt. Det understreger betydningen af et smidigt og effektivt komitésystem, og det sætter fokus påde områder, hvor det danske system skiller sig ud i international sammenhæng.I takt med den stigende faglige kompleksitet på området, som bl.a. indebærer, at nye forskningsområder løbendekommer til, sker der ligeledes en udvikling i retning af, at de faglige og etiske problemstillinger, som komitésyste-met skal forholde sig til, bliver mere komplekse. Det kan fx dreje sig om sager vedrørende stamcelleforskning,lægemidler indeholdende genmodificerede organismer eller xenogen celleterapi.
6.2.6.2.1.
Komitésystemets strukturOverordnet struktur
Decentral struktur med regionale komiteer udpeget af de fem regionerDet danske videnskabsetiske komitésystem er kendetegnet ved en decentral struktur med det særkende, at deregionale komiteer er udpeget af og forankret i de fem regioner, mens den centrale komité er udpeget af og for-ankret i statsligt regi i Indenrigs- og Sundhedsministeriet. Dette er et unikt kendetegn ved det danske system.Som det fremgår af kapitel 5, har både Norge, Sverige, Holland og England decentrale komiteer, men de er ikkeudpeget af et regionalt/lokalt politisk niveau. Her er de decentrale komiteer enten nedsat fra centralt hold, ellersom i Holland og England akkrediteret af den centrale komité.Systemets regionale forankring forstærkes ved, at det nuværende CVK er kendetegnet ved en stor regional re-præsentation. 22 af CVKs 26 medlemmer er også medlem af en regional komité.Udvalget ser både nogle fordele, men også en række ulemper ved den nuværende struktur. Fordelen er en bredforankring af komitésystemet, sammenhæng til det regionale sundhedsvæsen og nærhed til de større sundheds-videnskabelige forskningsmiljøer. Svagheden er, at opgavevaretagelsen i flere sammenhænge er uensartet påtværs af de regionale komiteer. Udvalget er i flere sammenhænge blevet gjort opmærksomt på, at der i dag eksi-sterer regionale forskelle i forvaltningen i de regionale komiteer vedrørende såvel procedurer som spørgsmål omlovfortolkning. Der er fx forskelligt, hvornår en sag bedømmes som værende behørigt udformet og dermed, hvor-når sagsbehandlingstiden på de 60 dage starter, ligesom også vurderingen af om et forsøg er anmeldelsespligtigtdivergerer, herunder kan komiteerne have forskellig opfattelse af, hvilken hjemmel, der skal anvendes til at vurde-re et projekt, jf. også afsnit 6.5.2.Denne uensartethed har en række aktører problematiseret overfor udvalget, herunder CVK, forskere og læge-middelindustrien. Det er udvalgets vurdering, at det både i forhold til at sikre forsøgspersonerne samme høje be-skyttelse i alle dele af landet og i forhold til at sikre, at de samme forhold gælder for forskere og virksomheder
13
”Assessment of the functioning of the “Clinical Trials Directive” 2001/20EC, Public Consultation Paper”, EU-Kommissionen, 09/10/2009.
56
over hele landet er nødvendigt at sikre en større ensartethed i sagsbehandlingen. Det gælder både i forhold tiladministrationen og de faglige vurderinger.Sammensætningen af CVK, de lovgivningsmæssige kompetencer, der er tillagt CVK, og det faktum, at de regio-nale komiteer er uafhængige myndigheder, indebærer ligeledes, at det er vanskeligt for det nuværende CVK atsikre koordinering og ensartethed på tværs af de regionale komiteer.Komitésystemet er ligeledes kendetegnet ved at være et toinstanssystem, hvor afgørelser truffet i de regionalekomiteer kan påklages til CVK. I den sammenhæng kan det være problematisk ud fra en retssikkerhedsmæssigbetragtning, at der er så stor personsammenfald mellem de regionale komiteer og CVK, dvs. mellem førstein-stans- og andeninstansmyndigheden, selvom de personer, der har været med til at behandle sagen i en regionalkomité, ikke deltager i behandlingen af sagen i CVK.På den baggrund har udvalget drøftet, om komitésystemets overordnede struktur bør ændres. Udvalget har i denforbindelse også set på, hvordan komitésystemerne er organiseret i landene omkring os, jf. kapitel 5. Udvalgethar overvejet forskellige modeller for komitésystemets fremtidige struktur, herunder en model hvor komitésyste-met centraliseres samt forskellige modeller, hvor den nuværende decentrale struktur bevares. Udvalget har drøf-tet fordele og ulemper ved de forskellige modeller. Udvalgets vurdering af en decentral struktur fremgår af oven-stående – bred forankring og sammenhæng til det regionale sundhedsvæsen og de større sundhedsvidenskabe-lige forskningsmiljøer.I forhold til en centraliseret model har udvalget drøftet, at den kan have en række positive elementer, bl.a. i for-hold til at sikre effektivitet og større ensartethed. Udvalget er ligeledes opmærksomt på, at en central model ikkeforhindrer, at der kan fysisk kan placeres komiteer regionalt, fx i forbindelse med de tre sundhedsvidenskabeligefakulteter. Det er dog samtidig udvalgets vurdering, at en centraliseret model har en række svagheder i forhold tilat sikre komitésystemet en bred forankring og sikre sammenhæng til det regionale sundhedsvæsen og den regio-nale forskningsindsats. Jf. også afsnit 6.2.2 for en analyse af komiteernes sammensætning og rammevilkår.6.2.2.Komiteernes sammensætning og rammevilkår
For at sikre en smidig sagsbehandling af høj faglig kvalitet er det vigtigt, at komiteerne besidder de rette kompe-tencer og har effektive beslutningsstrukturer. Specielt set i lyset af den stigende faglige kompleksitet inden forforskning.Sammensætningen af komiteerne skal ses i lyset af de opgaver, komitésystemet skal varetage. Hovedopgavenfor det videnskabsetiske komitésystem er som tidligere nævnt at sikre, at biomedicinske forskningsprojekter gen-nemføres videnskabsetisk forsvarligt. I forhold til at skabe mulighed for udvikling af ny, værdifuld viden går hensy-net til forsøgspersonernes rettigheder, sikkerhed og velbefindende forud for videnskabelige og samfundsmæssigeinteresser. Jf. afsnit 6.3 for en nærmere drøftelse af komitésystemets opgaver.Det dobbelte formål med komitésystemet afspejles i komitésystemets sammensætning, hvor der i såvel CVK somde regionale komiteer er flertal af lægmænd, hvilket er et særkende i international sammenhæng. Det er ligeledeset dansk særkende, at der ikke stilles kompetencekrav til lægmændene.Offentlige myndigheder skal inden for deres område arbejde for ligestilling og indarbejde ligestilling i al planlæg-ning og forvaltning, jf. lovbekendtgørelse nr. 1095 af 19. september 2009 om ligestilling af kvinder og mænd. Detfremgår desuden af ligestillingsloven, at regionerne skal sikre, at der indstilles lige mange kvinder og mænd til po-ster i råd, nævn, udvalg mv.
57
Udvalget har bemærket, at der i mange komiteer er en ligelig sammensætning med hensyn til køn, men at det ienkelte komiteer kan konstateres, at der ikke er en lige kønsmæssig fordeling.I det følgende analyseres henholdsvis sammensætningen af CVK og de regionale komiteer.6.2.2.1. CVKs sammensætningCVK har i dag 26 medlemmer. 4 af medlemmerne, herunder formanden, er udpeget af indenrigs- og sundheds-ministeren. De øvrige 22 medlemmer er regionalt indstillede – en forskningsaktiv og en lægmand fra hver af de 11regionale komiteer.Det er udvalgets vurdering, at det nuværende medlemstantal i CVK er for højt i forhold til at udgøre et forum fordrøftelse og debat samt i forhold til at sikre effektive sagsgange. Udvalget har i den forbindelse noteret, at de cen-trale videnskabsetiske komiteer i Norge, Sverige, Finland, Holland og England alle har et lavere antal medlemmerpå mellem 7 og 15 medlemmer, jf. tabel 6.Den nuværende udpegningsmetode indebærer, at antallet af medlemmer i CVK afhænger af antallet af regionalekomiteer, samt at CVK har en meget stor regional repræsentation og et stort personsammenfald mellem CVK ogde regionale komiteer. 22 af CVKs 26 medlemmer repræsenterer således førsteinstansmyndigheden.Udvalget har i den forbindelse overvejet, om det er hensigtsmæssigt, at antallet af medlemmer i CVK er variabeltsamt om den høje grad af regional repræsentation er hensigtsmæssig og retssikkerhedsmæssigt forsvarlig. Påden baggrund har udvalget drøftet, om den regionale repræsentation i CVK bør reduceres. Udvalget er dog sam-tidig opmærksomt på, at den regionale repræsentation i CVK bidrager til at sikre sammenhæng og koordineringmellem de regionale komiteer og CVK. Såfremt den regionale repræsentation i CVK reduceres, er der derfor vig-tigt på at være opmærksom på, hvordan der sikres koordinering og erfaringsudveksling på tværs af komitésyste-met. Udvalget har i den forbindelse overvejet, om der bør etableres et fælles kontaktforum mellem formandska-berne for CVK og de regionale komiteer.Sammensætningen af CVK indebærer ligeledes en høj grad af lægmandsrepræsentation. Både CVK og de regio-nale komiteer har flertal af lægmænd, der er politisk udpeget i forbindelse med regionernes konstitueringsaftaler. Iden sammenhæng har udvalget overvejet, om der fortsat skal være flertal af lægmænd, samt hvordan lægmæn-dene skal udpeges.Den nuværende udpegning af medlemmer til CVK bevirker samtidig, at det ikke er muligt at sikre, at en bred fag-lig kompetence er repræsenteret i CVK. CVK har fx forslået, at der skabes sikkerhed for, at en pædiater deltager iCVK.Udvalget har ligeledes drøftet, om der er andre faglige kompetencer, som bør være repræsenteret i CVK, herun-der farmakologi, psykiatri, embryologi og genetik. I den sammenhæng har udvalget samtidig drøftet, om CVKkunne suppleres med medlemmer med anden sagkundskab end den sundhedsfaglige/videnskabelige, herunderjurister, antropologer, filosoffer, teologer m.v. med henblik på at sikre en bred belysning af problemstillingerne.På denne baggrund er det udvalgets vurdering, at CVK fremover bør slankes samt sammensættes og udpegespå en anden måde med henblik på at sikre, at CVK fremover dels kan varetage opgaver, der i dag ikke kan løsesmed den nuværende sammensætning, dels bidrager til at det samlede videnskabsetiske komitésystem i højeregrad fremtidssikres og agerer proaktivt. Udvalget har i den forbindelse drøftet, at der er behov for at nytænkeCVK, både i forhold sammensætning og i forhold til opgaveportefølje.
58
I forhold til sammensætningen af CVK har udvalget set på organiseringen og sammensætningen af en række øv-rige råd og nævn, jf. nedenstående bokse
Organisering og sammensætningen af andre råd og nævn (I)PatientklagenævnetPatientklagenævnet er udpeget af indenrigs- og sundhedsministeren og er sammensat af:••••••Formand og p.t. 4 næstformænd, som skal være dommere8 medlemmer efter udtalelse fra Danske Regioner (må ikke være medlem af regionsråd)4 medlemmer efter udtalelse fra KL (må ikke være medlemmer af kommunalbestyrelsen)8 medlemmer efter udtalelse fra De Samvirkende Invalideorganisationer8 medlemmer efter udtalelse fra ForbrugerrådetEt antal medlemmer (omkring 75), der er fagligt uddannede inden for hvert af nævnets faglige områ-derVed afgørelsen af den enkelte sag sammensættes nævnet af formanden eller en af næstformændene samt tolægmandsrepræsentanter og to repræsentanter fra den gruppe af sundhedspersoner, sagen vedrører.Etisk RådEtisk Råd består af 17 medlemmer, som beskikkes af indenrigs- og sundhedsministeren efter følgende regler:••••••9 medlemmer udpeges af Folketingets udvalg vedr. Etisk Råd (må ikke være medlem af Folketinget,kommunalbestyrelse eller regionsråd)4 medlemmer udpeges af indenrigs- og sundhedsministeren1 medlem udpeges af miljøministeren1 medlem udpeges af ministeren for fødevarer, landbrug og fiskeri1 medlem udpeges af ministeren for videnskab, teknologi og udvikling1 medlem udpeges af økonomi- og erhvervsministeren
De ministerudpegede medlemmer skal have indsigt i de etiske, kulturelle, samfundsmæssige og andre fagligespørgsmål, der er af betydning for rådets arbejde. Ved udpegning og beskikkelse skal det sikres, at såvellægfolk som fagfolk er repræsenteret i rådet.
6.2.2.2. De regionale komiteers sammensætningSom det fremgår af afsnit 4.3, er de 11 regionale komiteer nedsat af regionsrådene og består af mindst 7 med-lemmer, men med mulighed for 9, 11, 13 eller 15 medlemmer. Der er altid flertal af lægmænd. Lægmændene erpolitisk udpegede af regionsrådene, mens de forskningsaktive udpeges efter indstilling fra de relevante forsk-ningsfaglige fora.Der har i udvalget været en diskussion af, om komiteernes nuværende forankring i hver af de fem regioner og dennuværende udpegningsmetode er hensigtsmæssig, herunder om den nuværende udpegning af lægmænd, hvorudpegningen i realiteten er baseret på medlemskab af et politisk parti, er hensigtsmæssig. Udvalget er i den for-bindelse opmærksomt på, at regionsrådenes medlemmer bredt repræsenterer hele befolkningen og derudoverkan udpege medlemmer uden for deres egen kreds. Enkelte medlemmer har foreslået, at lægmændene kunneindstilles i et samarbejde med Sundhedsbrugerrådene eller eventuelt fra fx patientforeninger.
59
Organisering og sammensætningen af andre råd og nævn (II)DyreforsøgstilsynetDyreforsøgstilsynet ledes af Rådet for Dyreforsøg, der består af 11 medlemmer og udpeges af justitsministe-ren:••••••••1 formand, der skal opfylde betingelserne for at kunne beskikkes som landsdommer1 medlem udpeges efter udtalelse fra Statens Sundhedsvidenskabelige Forskningsråd1 medlem udpeges efter udtalelse fra Statens Jordbrugs- og Veterinærvidenskabelige Forsknings-råd1 medlem udpeges efter udtalelse fra Sundhedsstyrelsen1 medlem udpeges efter udtalelse fra Dansk Industri1 medlem efter udtalelse fra de store sygdomsbekæmpende foreninger1 medlem efter udtalelse fra Det Dyreetiske Råd4 medlemmer efter udtalelse fra dyrebeskyttelsesforeninger
Justitsministeren skal ved sammensætningen af rådet så vidt muligt sikre, at der blandt rådets medlemmerer personer med indsigt i de faglige discipliner, der har særlig betydning for de opgaver, som er tillagt Dyre-forsøgstilsynet. Justitsministeren kan fastsætte, at visse afgørelser kan træffes af et udsnit af rådsmedlem-mer, af formanden eller af sekretariatet.Det Strategiske ForskningsrådDet Strategiske Forskningsråd består af en bestyrelse og et antal programkomiteer. Bestyrelsen består af 9medlemmer, som udpeges af ministeren for videnskab, teknologi og udvikling:••Formand og ét medlem udpeges af ministeren for videnskab, teknologi og udviklingDe øvrige medlemmer udpeges af ministeren efter åbent opslag.
Det er bestyrelsen for Det Strategisk Forskningsråd, som nedsætter programkomiteerne og fastsætter deoverordnede rammer for programkomiteernes arbejde. Bestyrelsen har i administrative anliggender instrukti-onsbeføjelser over for programkomiteerne.
Udvalget har ligeledes drøftet udpegningen af de regionale komiteers forskningsaktive medlemmer. I den forbin-delse har udvalget været meget opmærksomt på, at udpegningsmetoden har betydning for, hvor meritgivende deter at sidde i en regional komité. På den baggrund har udvalget drøftet forskellige udpegningsmetoder, herunder atden nuværende udpegningsmetode suppleres med, at de tre sundhedsvidenskabelige fakulteter får til opgave atindstille forskningsaktive medlemmer til de regionale komiteer. Alternativt at forskningsrådssystemet i form af be-styrelsen for de to forskningsråd (Det Strategiske Forskningsråd og Det Frie Forskningsråd) får til opgave at ind-stille et medlem til hver af de regionale komiteer.Der stilles i dag ikke krav om bestemte kompetencer hos hverken lægmændene eller de forskningsaktive. I densammenhæng har udvalget drøftet, hvorvidt der skal stilles krav til lægmændene, fx et krav om engelskkundska-ber set i lyset af, at en lang række interessenter finder det problematisk, at komitésystemet i dag stiller krav omdansksprogede forsøgsprotokoller.Udvalget har ligeledes overvejet, om formanden bør vælges blandt komiteens forskningsaktive med henblik på atsikre, at formanden har en faglig indsigt i projekterne.
60
Det er blevet fremhævet, at regionerne har vanskeligt ved at rekruttere primært forskningsaktive medlemmer til deregionale komiteer, bl.a. pga. arbejdsmængden. I dag honoreres arbejdet som formand med indtil 35.000 kr., ar-bejdet som næstformand med indtil 30.000 kr., og arbejdet som menigt medlem med indtil 10.000 kr. årligt. Det erogså blevet fremhævet, at medlemskab af en videnskabsetisk komité ikke er fagligt meritgivende på linje med fxmedlemskab af et forskningsråd. På den baggrund har udvalget overvejet, hvordan det kan gøres mere attraktivtat være medlem af en regional komité.6.2.2.3. Organisering af sekretariatsfunktionen og inddragelse af sagkyndige/ekspertbistandOrganisering af sekretariatsfunktionenKomitésystemets faglige kompetencer og koordineringen på tværs af komiteerne kan også sikres gennem sekre-tariatsfunktionerne.CVK har i dag et sekretariat på fire medarbejdere (en sekretariatschef, to juridiske fuldmægtige og en kontorfuld-mægtig), mens de fem regionale sekretariater har mellem to og ni medarbejdere (HK’ere og jurister). I flere tilfæl-de har de regionale sekretariatsmedlemmer dog også andre opgaver i regionen. Medarbejderne i CVKs sekreta-riat er ansatte i Indenrigs- og Sundhedsministeriet. Medarbejderne i de regionale sekretariater er regionalt ansatteog aflønnet. Jf. beskrivelsen i kapitel 4.På samme måde som selve komitésystemet består sekretariatsfunktionen således af et centralt og et regionaltniveau. Den decentrale organisering af sekretariatsfunktionen har både en række fordele og en række ulemper.Fordelen er, at de regionale sekretariater sidder tæt på de(n) regionale komité(er) og de lokale forskningsmiljøer,hvilket giver mulighed for tæt rådgivning og sparring. Ulempen er, at det kan være vanskeligt at sikre den nød-vendige ensartethed i sagsbehandlingen og den nødvendige koordinering på tværs af de regionale komiteer ogCVK.Udvalget er i den forbindelse opmærksomt på, at man i Norge overvejer at ændre organiseringen af sekretariats-funktionen. Med henblik på at sikre større ensartethed i den regionale sagsbehandling er det foreslået at organi-sere de regionale sekretariatsfunktioner i ét forvaltningsorgan med en direktør. Sekretariaterne vil dog fortsat væ-re fysisk placeret regionalt på universiteterne. Det bør i den sammenhæng bemærkes, at det norske komitésy-stem er et centralt opbygget og forankret system i modsætning til det danske. På den baggrund har udvalgetovervejet, om de regionale sekretariatsfunktioner bør organiseres anderledes.Udover selve organiseringen af sekretariatsfunktionen er det også relevant at se på den sagsforberedelse, somsker i sekretariaterne og i den forbindelse de faglige kompetencer, som er repræsenteret i sekretariaterne.Sekretariaterne gør et stort arbejde i forbindelse med forberedelse af sagerne. Der er imidlertid altovervejendetale om en juridisk sagsbehandling af de respektive sager, herunder en sikring af at ansøgningerne er udarbejdeti overensstemmelse med lovgivningen på området. Herudover har en enkelt region oplyst, at der til sagen kanudarbejdes et ”bemærkningsark”, hvor sekretariatet kan påtegne områder, som sekretariatet mener, at komiteenbør være særligt opmærksom på. Den faglige behandling af sagerne foretages af komitémedlemmerne, hvilket eren stor arbejdsopgave.Udvalget er i den forbindelse opmærksom på den svenske model, hvor alle komiteer nationalt som regionalt haren videnskabelig sekretær, som bistår formand og sekretariat med videnskabelig kompetence i sagsforberedel-sen. Den videnskabelige sekretær er medlem af komiteen og samtidig ansat i sekretariatet på ca. 10 pct. af fuldtid.
61
Inddragelse af sagkyndige/ekspertbistandEn anden måde, hvorpå komitésystemets faglige kompetencer kan styrkes, er ved inddragelse af ekspertbistandeller sagkyndige.En model man fx kender fra Patientklagenævnet, som råder over en lang række sagkyndige konsulenter fordeltpå fagområder, som udarbejder sagkyndige udtalelser i sagerne. Når Patientklagenævnet har modtaget sagen,efter at den har været til forbehandling hos Embedslægen, vurderer nævnets sekretariat, om sagen er tilstrække-ligt oplyst, og om sagen skal vurderes af nævnets sagkyndige konsulenter. Herefter udarbejder sekretariatet etforslag til afgørelse.Ligeledes har Patientforsikringen tilknyttet omkring 30 lægelige eksperter, der på konsulentbasis vurderer sager-ne i tæt samarbejde med Patientforsikringens jurister.Den nuværende komitélov giver allerede mulighed for, at komiteerne kan indhente ekspertbistand. Det fremgårsåledes af komitélovens § 9, stk. 4, at ”komiteerne skal gøre brug af konsulentbistand i de tilfælde, hvor de ikkeselv råder over fornøden faglig ekspertise til at bedømme forelagte projekter”. Det fremgår ligeledes, at når for-søgspersonen er mindreårig, under personligt værgemål eller varigt inhabil, skal der indhentes særlig ekspertisefra pædiater/eksperter med viden om den særlige tilstand, som personen befinder sig i.Det er imidlertid sjældent, at komiteerne anvender muligheden for at indhente ekspertbistand eller sagkyndige ud-talelser.
6.3.
Opgaver og opgaveportefølje
6.3.1. Komitésystemets opgaveområde6.3.1.1. Hvad er anmeldelsespligtigtKomitéloven fastlægger rammerne for hvilke projekter, komiteerne skal behandle. Den forsøgsansvarlige skalsom udgangspunkt anmelde ethvert biomedicinsk forskningsprojekt. Biomedicinske forskningsprojekter er i lovens§ 7 defineret som:”Et projekt, der indebærer forsøg på levendefødte menneskelige individer, menneskelige kønsceller, der agtesanvendt til befrugtning, menneskelige befrugtede æg, fosteranlæg og fostre, væv, celler og arvebestanddele framennesker, fostre og lignende samt afdøde. Endvidere omfattes forsøg, der har til formål at afdække eller efter-prøve de kliniske, farmakologiske eller andre farmakodynamiske virkninger, at identificere bivirkninger eller at un-dersøge farmakokinetik (optagelse, fordeling, nedbrydning eller udskillelse) med det formål at få viden om læge-midlers sikkerhed eller virkning. Endelig omfattes klinisk afprøvning af medicinsk udstyr, jf. dog stk. 2.”Det er blevet påpeget, at opgaverne for de videnskabsetiske komiteer ikke i alle tilfælde er helt klare, og at derkan opstå tvivl om, hvornår et projekt er anmeldelsespligtigt. Udvalget har derfor overvejet, om definitionen afanmeldelsespligtige projekter bør ændres, eller om andre tiltag kan medføre klarere regler for, hvornår et projektskal vurderes af en videnskabsetisk komité.Det har således været drøftet, hvorvidt der er behov for en præcisering af betegnelsen for den forskning, der be-handles i det videnskabsetiske komitesystem. I løbet af de seneste 10 år er begrebet sundhedsvidenskab såvelnationalt som internationalt (health science) blevet accepteret og indført som samlebetegnelse for forskning, somer rettet mod at belyse menneskets sygdomme og sundhed. Sundhedsvidenskab omfatter derfor både behand-
62
ling, undersøgelse, forebyggelse som rehabilitering. Dermed har underbetegnelser, som fx biomedicin, fået an-dre, afgrænsede betydninger. Udvalget har derfor drøftet, om det er hensigtsmæssigt at opretholde biomedicinsom samlebetegnelse for forskning, der behandles i det videnskabsetiske komitesystem.6.3.1.2. Bedømmelsen af projektet - om projektet bidrager til udvikling af ny, værdifuld videnKomitéloven fastlægger de retlige rammer for den videnskabsetiske bedømmelse af biomedicinske forskningspro-jekter. Formålet er at sikre, at biomedicinske forskningsforsøg gennemføres forsvarligt. Komiteerne kan såledeskun meddele tilladelse, hvis:••••De risici, der for forsøgspersoner kan være forbundet med at gennemføre projektet, hverken i sig selv el-ler i forhold til projektets forudselige fordele har et uforsvarligt omfang.Den forventede gevinst i terapeutisk henseende og for folkesundheden kan berettige projektet.Projektets videnskabelige standard opfylder kravet om, at projektet skal bidrage til udvikling af ny, værdi-fuld viden, jf. komitélovens § 1, stk. 3.Der er tilstrækkelig grund til at gennemføre projektet, og projektets konklusioner er berettigede.
Komiteen skal, jf. §§ 1, stk. 3, og 12, nr. 3, vurdere, om et projekts videnskabelige standard opfylder kravet om, atprojektet skal bidrage til udvikling af ny, værdifuld viden. Udvalget har i den forbindelse drøftet, hvorvidt det er ri-meligt, at de videnskabsetiske komiteer bedømmer forskningskvaliteten i de anmeldte projekter ud fra et kriteriumom, at projektet kan udvikle ny, værdifuld viden. I vurderingen inddrages i dag en række faktorer, bl.a. selve de-signet af forsøget, forsøgets metode, og om der foreligger allerede publicerede studier om samme emne.Det fremgår af GCP-direktivet, at den etiske komité bl.a. skal fremsætte udtalelser om forsøgsprotokollen, investi-gators egnethed og faciliteter. Det fremgår også af direktivet, at den etiske komité i forbindelse med vurdering afet projekt skal påse, om vurderingen af de forventede gevinster og risici er tilfredsstillende, og om konklusionerneer berettigede.Det kan være særdeles vanskeligt at vurdere, om et projekt kan bidrage til udvikling af ny, værdifuld viden. Beggebegreber indeholder en meget stor mulighed for skøn, som i flere tilfælde kan give anledning til tvivl. Det kan der-for overvejes, om kriteriet kan ændres.Udvalget har bl.a. drøftet, om komiteerne i stedet kunne påse, at et projekt tilvejebringer ny viden eller undersø-ger eksisterende viden, som kan berettige forsøgets gennemførelse.Ved afvejningen af om et projekt tilvejebringer ny viden eller undersøger eksisterende viden, som kan berettigeforsøgets gennemførelse, forudsættes der en vurdering af, at forsøgspersonerne ikke udsættes for unødvendigeeller urimelige indgreb. Formuleringen vil naturligvis også skulle fortolkes i overensstemmelse med princippernefor god videnskabelig praksis. Det bemærkes i den forbindelse, at det efter udvalgets opfattelse er en del af godvidenskabelig praksis, at et projekt bidrager til udvikling af ny viden.Udvalget finder generelt, at det er vigtigt at sikre, at godkendte projekter har den ønskelige videnskabelige kvali-tet, således at projekterne efter deres formål og metodik opfylder de grundlæggende krav til god videnskabeligstandard. Vedrørende vurdering af forskningskvaliteten skal det bemærkes, at andre organer i visse tilfælde ogsåvurderer forskningskvaliteten. Dette kan fx ske, når et projekt også bliver forelagt for forskningsrådene, eller nårLægemiddelstyrelsen vurderer ansøgninger fra lægemiddelvirksomheder. Som det fremgår nedenfor, er det imid-lertid andre kriterier, som ligger til grund for disse organers vurderinger.Vejledninger om god videnskabelig praksis udarbejdet af Udvalgene om Videnskabelig Uredelighed har væretdrøftet i udvalget. Vejledningerne behandler overordnet alle faser i et videnskabeligt forsøg – fra udformning af
63
forsøgsprotokoller til publikation. Vejledningerne baserer sig på, at ansvaret for at et forsøg udføres videnskabse-tisk forsvarligt ligger hos de forsøgsansvarlige forskningsinstitutioner og virksomheder, jf. også afsnit 4.4.2.6.3.1.3. Forskning med anonymt, biologisk materiale (ikke-personhenførbart)Udvalget har drøftet, om det bør være muligt at undtage anmeldelse af forskningsprojekter med anonymt, biolo-gisk materiale (blod, celler, væv, etc.). Problemstillingen er bl.a. blevet rejst af LIF. Udvalget er i den forbindelseblevet gjort opmærksom på, at der har været uklarheder om, hvorvidt forsøg med biologisk anonymt materialeskal anmeldes til komitésystemet. LIF har oplyst, at området omhandler tusindvis af biomedicinske laboratoriefor-søg, hvor forskere ønsker at anvende anonymt humant biologisk materiale.Ministeriet har i november 2007 slået fast, at anonymt, biologisk materiale skal anmeldes ifølge den nuværendekomitélov. Komitéloven skelner således ikke mellem ikke-anonymt og anonymt materiale i forhold til anmeldel-sespligten, men det anerkendes, at beskyttelseshensynet i de to situationer er forskelligt.Det bemærkes, at forskning med anonymt materiale ikke skal anmeldes til komitésystemet i Norge og Sverige, jf.afsnit 5.1 og afsnit 5.2.Udvalget har overvejet, om biologisk materiale, eventuelt afgrænset til specifikke dele såsom celler, cellelinjer,cellebestanddele fx celleekstrakter, cellehomogenater, proteiner, DNA, RNA, vævssnit, blod, plasma, serum, spyt,spinalvæske, synovialvæske eller urin fortsat bør være anmeldelsespligtigt, såfremt det er anonymt.Forslaget vil medføre, at komitésystemet afskæres fra at behandle forskningsprojekter, hvori der anvendes ano-nymt, biologisk materiale. I forbindelse med udvalgets overvejelser herom må mange interesser tages i betragt-ning. Det gælder først og fremmest forsøgspersonens interesser, men også forskningens vilkår. Endvidere må detogså tages i betragtning, at komitésystemet fortsat skal kunne fungere effektivt med mulighed for at prioritere res-sourcer og fokusere på de udfordrende områder, som komitésystemet ofte står over for.Hvorvidt selve anonymiteten skal være afgørende for, om projektet er anmeldelsespligtigt, indebærer således og-så en afvejning af hensynene til forsøgspersonerne, det danske forskningsmiljø og det videnskabsetiske komité-system.For så vidt angår beskyttelsesinteressen af forsøgspersonerne i situationer, hvor der er tale om fuldstændig ano-nymiseret materiale, kan denne vurderes som værende mindre væsentlig, da der ikke direkte er en person at be-skytte. Det er desuden ikke muligt at indhente et informeret samtykke fra vævsafgiveren.Der kan potentielt forekomme situationer, hvor forskning med anonymt, biologisk materiale kan tænkes føre til re-sultater, som eventuelt kan stigmatisere små grupper af mennesker med særlige kendetegn. I sådanne situatio-ner vil der være behov for, at der bliver foretaget en videnskabsetisk vurdering af forskningsprojektets karakter –et eventuelt samtykke fra vævsafgiver til anvendelse af materiale i anonymiseret form til forskning er i sådannesituationer ikke nødvendigvis en tilstrækkelig forudsætning for forsøgets gennemførelse. Det kan også mere ge-nerelt anføres, at uanset om materialet er anonymt, bør det videnskabsetiske komitésystem varetage hensynenetil, at forsøgene udføres videnskabsetisk forsvarligt. Endvidere kan det anføres, at en person, som har doneret envævsprøve til anonym anvendelse, kan have haft en formodning om, at forskning på vævet vil blive underkasteten videnskabsetisk vurdering – dette vil dog også afhænge af, hvilken information personen forinden har modta-get.6.3.1.4. BiobankerUdvalget har desuden fundet det hensigtsmæssigt at drøfte den nugældende regulering vedrørende biobanker.En biobank er en struktureret samling af menneskeligt biologisk materiale, der er tilgængeligt efter bestemte krite-
64
rier, og hvor oplysningerne, der er bundet i det biologiske materiale, kan henføres til enkeltpersoner. I Danmarkskelnes der mellem følgende fire hovedtyper af biobanker:••••Kliniske biobanker: Biobank, hvor indsamling sker med henblik på kliniske formål (forebyggelse, under-søgelse, diagnose, behandling, pleje m.v.).Forskningsbiobanker: I henhold til komitéloven er en forskningsbiobank en samling af biologisk materia-le, der indgår som en integreret del af et konkret biomedicinsk forskningsprojekt.Donorbiobanker: Biobank, hvor det biologiske materiale er indsamlet fra frivillige donorer, typisk raskepersoner, med henblik på behandling af en konkret patient eller en nærmere angivet patientgruppe.Biobanker til andre sundhedsformål: Biobanker, som ikke lader sig rubricere under de øvrige kategorieraf biobanker, men som alligevel har et sundhedsformål (fx en stamcellebiobank eller en produktionsbio-bank i privat regi).Datatilsynet har tidligere udtalt, at strukturerede samlinger af menneskeligt biologisk materiale kan anses for om-fattet af persondatalovens definition af et manuelt register.14Reguleringen af biobanker hviler derfor på, at al be-handling af biologisk materiale fra mennesker i en biobank systematisk analogiseres med al anden behandling afpersonoplysninger, dvs. er omfattet af persondatalovens almindelige regler.Udover persondataloven er biobankforskning i dag reguleret i komitéloven og sundhedsloven. Hvor regler i andenlovgivning end persondataloven giver vævsafgiver en bedre retsstilling, går de forud for regler i persondataloven.Komitésystemets kompetence i forhold til biobankforskning er fastlagt i ministeriets cirkulære af 13. juni 2005 omfortolkning af § 16, stk. 5, i lov om et videnskabsetisk komitésystem og behandling af biomedicinske forsknings-projekter i relation til forskningsbiobanker. Komitésystemets kompetencer omfatter alene forskningsbiobankersom defineret i ministeriets cirkulære af 13. juni 2005.Af cirkulæreskrivelsen fremgår det, at det, som komitéloven regulerer, er biomedicinske forskningsprojekter, dvs.konkrete forskningsprojekter på mennesker eller menneskeligt biologisk materiale, hvorimod komitésystemet ikkehar kompetence til at behandle andre spørgsmål.Det betyder, at udtagelse og anvendelse af menneskeligt væv m.v. til brug for et aktuelt, konkret biomedicinskforskningsprojekt skal vurderes af komitésystemet efter reglerne i komitéloven. En forskningsbiobank i komitésy-stemet skal således forstås som en biobank, der er en integreret del af et biomedicinsk forskningsprojekt, jf. In-denrigs- og Sundhedsministeriets cirkulære af 13. juni 2005.Det følger af komitéloven, at komiteen kun kan meddele tilladelse til et forskningsprojekt, hvis forsøgspersonenafgiver informeret samtykke, når personens væv i forbindelse med et konkret forskningsprojekt udtages med hen-blik på opbevaring i en forskningsbiobank.Biobanker, der etableres med henblik på eventuel fremtidig forskning (biobanker uden for et konkret forsknings-projekt), skal derimod ikke godkendes af komitésystemet, da det indsamlede biologiske materiale ikke umiddel-bart gøres til genstand for forskning. Sådanne biobanker med fremtidig forskning for øje skal udelukkende anmel-des til Datatilsynet, jf. ovenstående. Derfor opererer Datatilsynet også med en bredere definition af forskningsbio-banker, hvori der også indgår samling af biologisk materiale med henblik på fremtidig forskning. Det bemærkes,at selve udtagelsen (mængde, procedure mv.) af det biologiske materiale er underlagt de sædvanlige krav omudvisning af omhu og samvittighed (autorisationslovens § 17), ligesom vævslovens regler skal iagttages.
14
Datatilsynets udtalelse til Sundhedsministeriet er gengivet i årsberetningen for 2000.
65
Det har i udvalget været overvejet, hvorvidt komitésystemet fremover også bør godkende prøveudtagning medhenblik på fremtidig forskning. Set i lyset af at den nuværende danske regulering af biobanksområdet er velfunge-rende også i international sammenhæng, ønsker et flertal af udvalget at fastholde den nuværende regulering.Det bør desuden nævnes, at et biomedicinsk forskningsprojekt, hvori der indgår biologisk materiale fra en tidligereetableret biobank (registerforskning, jf. komitélovens § 8, stk. 3), skal anmeldes til og godkendes af komitésyste-met som alle andre biomedicinske forskningsprojekter. Det biologiske materiale bliver jo i så fald anvendt til kon-kret forskning og udgør en forskningsbiobank i komitélovens forstand.Det bemærkes i øvrigt, at en patient i medfør af sundhedslovens § 29 kan beslutte, at biologisk materiale, sompatienten afgiver eller har afgivet i forbindelse med behandling, kun må anvendes til behandling af den pågæl-dende og til formål, der har en umiddelbar tilknytning hertil. Patientens beslutning registreres i Vævsanvendelses-registeret, som Sundhedsstyrelsen driver. Den sundhedsperson, der er ansvarlig for opbevaring af biologisk ma-teriale, er forpligtet til at søge oplysninger i registeret, hvis opbevaret biologisk materiale ønskes anvendt til andetend behandling af patienten og formål, der har en umiddelbar tilknytning hertil.Brugen af væv fra en tidligere etableret biobank til et biomedicinsk forskningsprojekt kan i medfør af komitélovens§ 16, stk. 3, ske uden indhentelse af samtykke fra de personer, som oprindeligt gav vævet, hvis anvendelsen afdet biologiske materiale i forskningsprojektet ikke indebærer risici eller belastning for disse personer, eller hvisindhentning af samtykke er umulig eller uforholdsmæssig vanskelig. Det er den videnskabsetiske komité, der i detkonkrete tilfælde træffer afgørelse om undladelse af indhentelse af samtykke og således varetager individbeskyt-telseshensynet. Komiteens afgørelse skal baseres på de nævnte kriterier, og en eventuel tidligere tilkendegivelsefra giver af det biologiske materiale om, at det må benyttes til fremtidig forskning, kan ikke tillægges vægt.6.3.2. Opgaveportefølje og arbejdsdeling mellem CVK og de regionale komiteerSom det fremgår af kapitel 3 og 4 fungerer CVK som klageinstans for de regionale komiteer. CVK koordinererdesuden arbejdet i de regionale komiteer og kan fastsætte vejledende retningslinjer, ligesom CVK kan udtale sigom spørgsmål af principiel karakter, såfremt spørgsmålene ikke er tilknyttet til godkendelse af et konkret forsk-ningsprojekt.I lyset af overvejelserne i afsnit 6.2 om komitésystemets struktur har udvalget drøftet komitésystemets opgavepor-tefølje og opgavefordeling.Behandling af komplekse sagerCVK behandler i dag kun klagesager og uenighedssager. I Finland og Holland har den centrale komité ogsåegentlig sagsbehandlng på udvalgte sagsområder, jf. kapitel 5.Udviklingen på området for sundhedsforskning går stærkt, og udviklingen vil ofte medføre en række nye, kom-plekse videnskabsetiske problemstillinger. Nogle af disse problemstillinger kan være så vanskelige at vurdere, atder er behov for inddragelse af den ypperste faglige ekspertise på området for at vurdere et projekts videnskabse-tiske aspekter. Sagernes karakter og antal kan også gøre det vanskeligt at udvikle en tværregional praksis på om-rådet.For at sikre at de mest komplekse problemstillinger behandles så godt som muligt, har udvalget drøftet, om CVKskal behandle disse sagstyper, indtil en praksis er fastlagt. Det kan fx dreje sig om sager vedrørende stamcelle-forskning, lægemidler indeholdende genmodificerede organismer eller xenogen celleterapi. Det kan også drejesig om sager, hvor forsøgspersonen er særligt udsat, fx i forbindelse med akutforskning. Der kan således sondresbåde mellem sagstype og forsøgsdeltagere. Disse overvejelser skal ligeledes ses i sammenhæng med udvalgetsovervejelser om en anden sammensætning af CVK, jf. afsnit 6.2.2.1.
66
Udvalget har således overvejet nedenstående områder:1.Forsøg, hvor den sundhedsfaglige og/eller etiske kompleksitet stiller særlige krav til ekspertise-mæssig dybde og bredde i komiteen, fx lægemidler til avanceret terapiHerved forstås kliniske forsøg med lægemidler, som, såfremt der blev ansøgt om markedsføringstilladel-se, ville være omfattet af reglerne for den centraliserede EU-procedure for ”lægemidler til avanceret te-rapi”. Det er en kompliceret forsøgskategori, men den er forholdsvis klart afgrænset gennem EU’s regu-lering.15Inden for denne kategori vil være forsøg, der omfatter genterapi, somatisk celleterapi (hvor cel-lerne kan være af human eller animalsk (xenogen) oprindelse), og behandling med manipulerede væv(engineered tissues). Det vurderes desuden, at stamcellederiverede lægemidler ville være omfattet afbegrebet ”avanceret terapi” i EU-reguleringen, idet der her som hovedregel ville være tale om ”et pro-dukt, som indeholder eller består af celler eller væv, der er manipuleret, og som præsenteres som et eg-net middel til eller anvendes i eller gives til mennesker med henblik på at regenerere, reparere eller er-statte menneskeligt væv.”Eventuelt vil der være tale om kombinerede lægemidler, dvs. hvor der indgår en medicinsk udstyrsdeloveni den biologiske komponent, typisk en celle- eller vævskomponent. Det vil sige, at celler eller vævkombineres med fx celleprodukter, biomolekyler, biomateriale, kemiske stoffer, matricestøttematerialereller matricer. Dette ville også omfatte en del af de nanoteknologiske lægemidler, som forudses udviklet.Både med og uden kombination er der tale om vurderinger, der kræver multidisciplinær ekspertviden.2.Forsøg, hvor hensynet til beskyttelse af forsøgspersoner stiller særlige krav til den juridiske eks-pertise,og hvor der skal ske en afvejning i lys af sundhedsfaglige, forskningsfaglige eller andre vurde-ringer, som til dels har skønsmæssig karakter, og hvor det endvidere er ønskeligt at sikre en ensartetpraksis for vurdering og afgørelse, fx forsøg der inddrager mindreårige eller forskning med inhabile.Det kan fx udmøntes ved, at CVK behandler sager, hvor der ikke er tale om myndige, habile personer, jf.fx komitélovens §§ 17, 20 og 20 a.Som tidligere påpeget, er der væsentlige fordele ved at beholde den regionale forankring, bl.a. at regionerne harkendskab til det lokale forskningsmiljø samtidig med, at der løbende sættes regionalt fokus på de videnskabse-tiske regler. For at imødekomme dette hensyn kunne systemet indrettes dynamisk med henblik på, at de sagsty-per, som er udvalgt til behandling i CVK, over tid kan føres tilbage til de regionale komiteer. Det kunne såledesskabes mulighed for at tilbageføre områderne, når de ikke længere er nye og/eller komplicerede, og når der erudarbejdet en praksis på området.Det kan fx udmøntes ved, at CVK indstiller til ministeren, hvilke områder CVK kan behandle, hvorefter ministeren- eventuelt efter høring af Sundhedsstyrelsen, såfremt det måtte være nødvendigt - fastsætter de udvalgte områ-der. I forhold til selve periodens udstrækning kan det fx fastsættes, hvor mange sager eller over hvor lang tid, sa-gerne bør behandles centralt. Det kan fx dreje sig om behandling af ti sager eller behandling af sager over en 5-årig periode, hvorved praksis på området kan fastlægges.Når en sag starter i CVK, fjernes mulighederne for administrativ rekurs umiddelbart. Udvalget har derfor overvejetforskellige muligheder, herunder at selve sagsbehandlingen af ansøgning og retlige forhold i forbindelse hermedskal kunne påklages til Indenrigs- og Sundhedsministeriet. I forhold til selve det videnskabsetiske skøn og den15
Det fælles reguleringsgrundlag i EU er Europaparlamentets og Rådets forordning (EF) nr. 1394/2007 om lægemidler til avanceret terapi og om
ændring af direktiv 2001/83/EF og forordning (EF) nr. 726/2004.
67
faglige vurdering har udvalget overvejet, hvorvidt der her er behov for en klageadgang. Muligheden for admini-strativ rekurs må afvejes over for det faktum, at sagen vil blive behandlet med inddragelse af ekspert-sagkundskab.Løbende opfølgning på udviklingen på det videnskabsetiske områdeCVK skal følge forskningsudviklingen på sundhedsområdet og virke for forståelsen af de etiske problemstillinger,udviklingen kan medføre i forhold til offentligheden, myndigheder m.v., jf. komitélovens § 24, nr. 2. Udvalget aner-kender, at CVK allerede i dag gør en væsentlig indsats for at følge udviklingen på området, bl.a. i forbindelse medafholdelse af komitésystemets årsmøde. CVK har desuden et godt nordisk netværk og samarbejde.Udvalget har overvejet, om CVK kan være mere proaktiv i forhold til at opfange internationale tendenser ogstrømninger inden for det videnskabsetiske område. Udvalget har desuden overvejet, at CVK kan have til opgaveat sikre, at udviklingen på det videnskabsetiske felt synliggøres og indarbejdes i det danske videnskabsetiskekomitésystem.6.3.3. Arbejdsdeling mellem de regionale komiteerDen forsøgsansvarlige skal anmelde det biomedicinske forskningsprojekt til den regionale komité for det område,hvori den forsøgsansvarlige har sit virke, jf. komitélovens § 8. Udvalget har overvejet, hvorvidt dette er hensigts-mæssigt. Dette medfører, at nogle regioner modtager langt flere ansøgninger end andre regioner, jf. afsnit 4.3.Arbejdsdelingen mellem regionerne kan struktureres efter andre principper. Det kan fx ske efter fagområde, hvorregionerne kunne specialisere sig på forskellige områder. Det kan også ske ved skabe en tilfældig, regional forde-ling. Endelig er det også muligt at sætte en grænse for, hvor mange sager en komité kan behandle, hvorefter sa-gerne så kunne videresendes til en anden region med henblik på behandling, hvilket fx er tilfældet i Norge, hvorman har et såkaldt ”overrislingsprincip”, jf. afsnit 5.1.6.3.4. Komitésystemets snitflader til øvrige myndigheder m.v.6.3.4.1. LægemiddelstyrelsenLægemiddelstyrelsens virksomhed i forhold til kliniske forsøg med lægemidler og medicinsk udstyr er gennemgå-et i afsnit 4.4.1. Udvalget har i flere sammenhænge drøftet komitésystemets snitflader til Lægemiddelstyrelsen.Udvalget har bl.a. drøftet, at det er vigtigt at sikre tæt koordinering mellem de to instanser. Udvalget har ogsådrøftet, om både Lægemiddelstyrelsen og de videnskabsetiske komiteer vurderer den forskningsfaglige kvalitet.Lægemiddelstyrelsen vurderer, hvorvidt forskningen lever op til kravene fastsat i medfør af lægemiddelloven oglovgivning om medicinsk udstyr, mens komitésystemet vurderer, hvorvidt et forskningsprojekts videnskabeligestandard opfylder kravet om, at forskningsprojektet skal bidrage til udvikling af ny, værdifuld viden. Der er såledesikke fuldstændigt sammenfald mellem faktorerne for de to instansers vurderinger.6.3.4.2. Forskningsrådene og arbejdet med god videnskabelig praksisForskningsrådssystemet virker inden for alle videnskabelige forskningsområder, mens komitésystemet alene vir-ker inden for det sundhedsvidenskabelige forskningsområde. Eventuelle snitflader kan derfor alene forekomme iforhold til de organer, som varetager opgaver i relation til det sundhedsvidenskabelige forskningsområde. Forsk-ningsrådssystemet er beskrevet i afsnit 4.4.2.I komitésystemets behandling af ansøgninger indgår en vurdering af projektets videnskabelige standard, jf. komi-télovens § 12, men de to systemer sigter mod at iagttage forskellige hensyn. Forskningsrådssystemet fokusererprimært på forskningskvaliteten, mens komitésystemet iagttager den etiske dimension. Det bemærkes desuden,at organerne i forskningsrådssystemet som udgangspunkt ikke udarbejder skriftlig dokumentation for deres forsk-ningsfaglige bedømmelser.
68
Udvalget har i den forbindelse drøftet, at det med fordel fremover ved ansøgninger til forskningsrådene kunneindgå nærmere beskrivelser af videnskabsetiske overvejelser.6.3.4.3. DatatilsynetDatatilsynet er den statslige myndighed, der fører tilsyn med persondataloven. Datatilsynets opgaver er beskreveti afsnit 4.4.3. Der henvises desuden til afsnit 6.3.1 for en nærmere drøftelse af Datatilsynets rolle i forhold til bio-banker.6.3.4.4. Det Etiske RådDet fremgår af komitélovens § 5, stk. 2, at CVK skal samarbejde med Det Etiske Råd, bl.a. ved fælles møder. Idag afholdes et årligt møde mellem CVK og Det Etiske Råd. Desuden har CVK og Det Etiske Råd i 2004 udgivetrapporten Obduktion og forskning på afdøde.Udvalget er af CVK blevet gjort opmærksom på, at samarbejdsbestemmelsen i loven ikke er nødvendig. Det vur-deres, at CVK og Det Etiske Råd løbende har et velfungerende samarbejde. Ved at ophæve bestemmelsen kanDet Etiske Råd og CVK få frihed til at planlægge samarbejdet efter behov. Det kan desuden bemærkes, at CVKsforpligtelse til at følge forskningsudviklingen på sundhedsområdet og virke for forståelse af de etiske problemstil-linger allerede i forvejen fordrer et godt samarbejde mellem CVK og Det Etiske Råd.6.3.5. Kvalitetsudvikling, opfølgning og kontrolDet fremgår af komitélovens § 22, stk. 1, at det er de regionale komiteers anliggende og ansvar at føre tilsyn med,at det biomedicinske forskningsprojekt udføres i overensstemmelse med den meddelte tilladelse. Undtaget herfraer dog kliniske forsøg med lægemidler, jf. komitélovens § 22, stk. 6, hvor det alene er Lægemiddelstyrelsen, somvaretager tilsynet, jf. lægemiddellovens § 90.Det fremgår af lovbemærkningerne til bestemmelsen, at der er tale om en videreførelse og præcisering af dendaværende lovs bestemmelse om tilsyn, der gav de regionale komiteer mulighed for at udøve opsøgende, stik-prøvevis kontrol med forløbet af et godkendt forskningsprojekt. Det fremgår desuden af bemærkningerne, at be-stemmelsen kan udmøntes ved, at den regionale komité udpeger et egentlig kontrolkorps, som kan varetage op-gaven.Udvalget er i flere sammenhænge blevet gjort opmærksom på, at der kun i begrænset og meget varierende om-gang fokuseres på opfølgning og kontrol i forhold til de meddelte tilladelser, uagtet at dette er en lovfæstet opgavefor regionerne. Den kontrol, som udføres, sker primært ved, at den forsøgsansvarlige indkaldes til gennemgang afprojektet for den regionale komité. Der foretages ikke kontrol i form af eksempelvis tilsyn på forsøgsstedet.Det er udvalgets vurdering, at det ikke er tilfredsstillende, at der ikke sker en mere ensartet og målrettet opfølg-ning og kontrol med godkendte projekter. Det fremgår også specifikt af kommissoriet for udvalgets arbejde, at ud-valget skal komme med forslag til en fremtidig struktur, som sikrer ensartet og effektiv kontrol med godkendteforskningsprotokoller.Udvalget er i den forbindelse opmærksom på, at en arbejdsgruppe i regi af Danske Regioner bestående af re-præsentanter fra de regionale sekretariater, CVKs sekretariat samt Danske Regioner har udarbejdet notatet ”Vi-denskabsetisk kontrol – fælles grundlag for regionernes tilsyn” fra juni 2009. Notatet beskriver bl.a. en række me-toder til brug for de regionale komiteers tilsyn med, at biomedicinske forskningsprojekter udføres i overensstem-melse med den meddelte godkendelse. Indledningsvist fastslår arbejdsgruppen, at det bør prioriteres højt, at deretableres en ensartet landsdækkende kontrolfunktion på en måde, som sikrer, at regionerne lever op til deresmyndighedsansvar, jf. nedenstående boks.
69
Arbejdsgruppe i regi af Danske RegionerArbejdsgruppen har opstillet en række forskellige kriterier for valg af, hvilke konkrete forskningsprojekter, derskal udtages til kontrol:••••••Ved stikprøver.Temabaseret (fx børneforsøg eller voksne inhabile).Ud fra graden af intervention overfor forsøgspersonerne (forsøg der indebærer særligt indgribendeinterventioner).Ud fra om der anvendes nye interventioner.Ud fra varighed og omfang (forsøg der strækker sig over lange tidsrum eller omfatter særligt mangeforsøgspersoner).Ad hoc (som følge af forhold komitésystemet er blevet opmærksom på i forbindelse med fx anmel-delse eller sagsbehandlingen af forsøget).Tilsvarende lister arbejdsgruppen tre forskellige kontrolmetoder:•••Tilsyn på forsøgsstedet.Indkaldelse af den forsøgsansvarlige til gennemgang af projektet for den regionale komité.Inddragelse af forsøgspersoner.
På den baggrund opstiller arbejdsgruppen følgende konklusioner og anbefalinger:••••At de beskrevne metoder kan inspirere komitésystemet til at anvende en eller flere af de anbefaledemetoder.At de regionale komiteer årligt udvælger et antal forsøg til tilsyn.At metoderne kan anvendes fleksibelt, således at en komité kan anvende de metoder, som den fin-der mest anvendelige til de konkrete projekter.At der på en række områder udarbejdes standarder, herunder for hvordan eventuelle kontrolbesøgvarsles og gennemføres, og for hvordan en afrapportering efter kontrolbesøg kan disponeres.
På den baggrund har udvalget drøftet forskellige måder, hvorpå komitésystemets arbejde med opfølgning og kon-trol kan organiseres, herunder hvilke kriterier der skal lægges til grund for valg af forsøgsprojekter, der udtages tilkontrol. Udvalget har bl.a. overvejet, om kontrollen bør målrettes de forsøg, som ud fra en betragtning af forsøgs-personernes interesser kunne have særlig relevans. Udvalget er i den forbindelse opmærksom på, at Lægemid-delstyrelsens kontrol er kendetegnet ved en risikobaseret tilgang, hvor de forskellige lægemiddelforsøg vurderes iforhold til risiko for forsøgspersonerne.Udvalget har også drøftet, at der i forskningsverdenen allerede er en høj grad af egenkontrol.Det er ligeledes blevet betonet i udvalgets drøftelser, at kvalitetsudvikling og kontrol hænger tæt sammen, og atder i arbejdet med opfølgning og kontrol skal være et klart fokus på kvalitetssikring og kvalitetsudvikling med hen-blik på at sikre læring fremadrettet i systemet – dels af hensyn til forsøgspersonerne, dels af hensyn til et sikre enfortsat udvikling i kvaliteten i forskningen. Et vigtigt element i den sammenhæng er en højere grad af inddragelseaf forsøgspersonerne og deres oplevelser og erfaringer med at deltage i forsøg.
70
6.3.5.1. Komitésystemets beføjelser og sanktionsmuligheder i forhold til opfølgning og kontrolKomitésystemets sanktionsmuligheder er fastsat i komitélovens § 29. Iværksættes et projekt i strid med §§ 8 og 9(nye projekter) eller § 23 (tillægsprotokoller) eller i strid med vilkårene for tilladelsen, kan der ske politianmeldelse.Straffen er bøde eller fængsel indtil 4 måneder. Komitésystemet er således kun tillagt begrænsede sanktionsmu-ligheder ved lov, selvom det dog skal bemærkes, at forvaltningsretten giver komiteerne beføjelse til i et vist om-fang at tilbagekalde en godkendelse. Hensynet til menneskers liv, sundhed og velfærd vil næsten altid kunne be-grunde en tilbagekaldelse af en begunstigende forvaltningsakt afhængig af en konkret vurdering.Udvalget er opmærksomt på, at der i forskellige sammenhænge, bl.a. af CVK, er stillet forslag om, at komitésy-stemet får udvidet sine beføjelser og sanktionsmuligheder i forhold til at løfte kontrolopgaven. CVK har såledesforeslået, at:•Komitésystemet får adgang til relevante dele af patientjournalen i forbindelse med gennemførel-se af kontrolEfter sundhedslovens § 43, stk. 2, litra 3, kan der ske videregivelse af patientoplysninger i forbindelsemed myndighedskontrol, så længe der er tale om videregivelse fra en sundhedsperson, der varetageropgaver indenfor sundhedsvæsenet. Hvis der er tale om videregivelse af oplysninger fra patientjournaleri forbindelse med kontrol hos en forsker, der opererer i privat regi, vil det formentlig være nødvendigt atindhente et skriftligt samtykke fra forsøgspersonen efter sundhedslovens § 43, stk. 1, hvis komitésyste-met skal have adgang til relevante oplysninger i patientjournalen. Et sådant samtykke bortfalder efter etår, hvorfor det kan være hensigtsmæssigt at indføre en særskilt hjemmel i komitéloven til, at komitésy-stemet får adgang til relevante dele af patientjournalen i forbindelse med gennemførelse af kontrol.•Repræsentanter fra komitésystemet får ret til uden forudgående retskendelse at foretage kontrolpå virksomheder, sygehuse m.v.I forbindelse med ændringen af komitéloven i 2003 havde det daværende udvalg vedr. revision af komi-téloven anbefalet en hjemmel i komitéloven, således at repræsentanter for komitésystemet får ret tiluden forudgående retskendelse at foretage kontrol hos virksomheder, sygehuse. Forslaget blev ikkefulgt, da lovgiver valgte at afvente arbejdet i Retssikkerhedskommissionen, som bl.a. havde til opgave atse på administrative myndigheders adgang til at foretage tvangsindgreb uden for retsplejen.Komitésystemet kan derfor ikke i dag i modsætning til eksempelvis Lægemiddelstyrelsen foretagetvangsindgreb i form af at foretage fx uanmeldte inspektioner og kræve at få adgang uden retskendelse.Komitésystemets kontrolbesøg skal således foretages med udgangspunkt i almindelige forvaltningsretli-ge principper, bl.a. således at et eventuelt kontrolbesøg altid varsles på forhånd og aftales med den for-søgsansvarlige.•Komitésystemet får hjemmel til at stoppe et projektKomiteerne kan i henhold i komitéloven alene føre tilsyn med, at projekterne udføres i overensstemmel-se med den meddelte tilladelse, hvorimod der i komitéloven i modsætning til eksempelvis lægemiddello-ven ikke er særskilt hjemmel til at stoppe et projekt eller eventuelt udstede påbud. I forbindelse med im-plementering af GCP-direktivet fik Lægemiddelstyrelsen en særlig hjemmel til at standse et lægemiddel-forsøg eller kræve forsøget ændret, jf. lægemiddellovens § 90, stk. 5. Lægemiddelstyrelsen kan ogsåstandse en klinisk afprøvning af medicinsk udstyr eller kræve afprøvningen ændret, jf. § 9, stk. 7, i be-kendtgørelse om medicinsk udstyr, og § 6, stk. 7, i bekendtgørelsen om aktivt, implantabelt medicinskudstyr samt § 8a i bekendtgørelsen om medicinsk udstyr til in vitro-diagnostik.
71
6.3.5.2. Kontrol med lægemiddelforsøg og afprøvning af medicinsk udstyrSom tidligere fremhævet, er det Lægemiddelstyrelsen, som fører kontrol med kliniske lægemiddelforsøg og kliniskafprøvning af medicinsk udstyr. Det er derfor vigtigt, at der sker den nødvendige koordinering mellem Lægemid-delstyrelsen og komitésystemet. Komitésystemet kan komme med forslag til kliniske forsøg, der bør kontrolleresaf Lægemiddelstyrelsen. Lægemiddelstyrelsen har oplyst, at det kan være vanskeligt for Lægemiddelstyrelsen atkontrollere, at den forsøgsansvarlige overholder alle dele af den videnskabsetiske komités tilladelse og forudsæt-ningerne for denne. Det kan i øvrigt oplyses, at komiteerne har en stående invitation til at deltage i Lægemiddel-styrelsens inspektioner som observatører.6.3.5.3. Publicering af resultaterDet følger af komitélovens § 14, nr. 6, at en komité kun kan meddele tilladelse til et biomedicinsk forsøg, hvis dersker offentliggørelse af såvel negative som positive forsøgsresultater så hurtigt, som det er muligt og fagligt for-svarligt.Problemstillingen vedrørende selektiv publicering har været drøftet blandt udvalgets medlemmer. Udvalget harnoteret sig, at spørgsmål om transparens, offentliggørelse og publikation af forskningsresultater drøftes både na-tionalt og internationalt i regi af EU og WHO. Udvalget finder det vigtigt, at komitésystemet i forbindelse med kon-trol- og opfølgningsarbejdet sætter fokus på den faktiske offentliggørelse af forsøgsresultater.Udvalget har på baggrund af ovenstående overvejet mulighederne for at sikre fokus på komitélovens bestemmel-se om, at alle resultater af forskningsprojekter offentliggøres. Udvalget har i den forbindelse overvejet, at komite-erne kan inddrage dette aspekt i forbindelse med opfølgning og kontrol af et projekt, jf. også komitélovens § 22,stk. 2. Det er udvalgets opfattelse, at den forsøgsansvarlige skal kunne redegøre for publikationsmæssigespørgsmål vedrørende forskningsresultaterne. Såfremt det konstateres, at resultaterne ikke er offentliggjort, skalden forsøgsansvarlige efter anmodning kunne begrunde, hvorfor resultaterne ikke er offentliggjort. Udvalget finderdesuden, at komitésystemet bør opfordre til offentliggørelse på internettet, såfremt den forsøgsansvarlige måttehave svært ved at få publiceret sine resultater i videnskabelige tidsskrifter.
6.4.
Forsøgspersoners deltagelse i forsøg
6.4.1. Informeret samtykkeDet fremgår af komitéloven, at det videnskabsetiske komitésystems opgave er at sikre, at biomedicinske forsk-ningsprojekter gennemføres videnskabsetisk forsvarligt. I forhold til at skabe mulighed for udvikling af ny, værdi-fuld viden går hensynet til forsøgspersonens rettigheder, sikkerhed og velbefindende forud for videnskabelige ogsamfundsmæssige interesser.Dette er et af de grundlæggende vilkår for komiteernes virke i dag. For at sikre forsøgspersonernes rettigheder erder blandt andet fastsat regler om informeret samtykke, som fremgår af komitélovens kapitel 5. Det bemærkes, atreglerne om information og samtykke desuden er nøjere beskrevet i bekendtgørelse nr. 806 af 12. juni 2004 ominformation og samtykke ved inddragelse af forsøgspersoner i biomedicinske forskningsprojekter.•Biomedicinske forskningsprojekter, der berører myndige personerDet fremgår af komitélovens § 16, at en komité kun kan meddele tilladelse til at indlede og fortsætte etbiomedicinsk forskningsprojekt, hvis den myndige forsøgsperson har afgivet informeret samtykke. Det erdesuden en betingelse, at forsøgspersonerne skriftligt og mundtligt vil få oplysninger om projektets ind-hold, forudselige risici og fordele, og at der vil blive indhentet og givet informeret samtykke.
72
•
Biomedicinske forskningsprojekter, der berører mindreårige, personer under personligt værge-mål og voksne inhabileEn komité kan kun meddele tilladelse til at indlede og fortsætte et biomedicinsk forskningsprojekt, derberører mindreårige, hvis der er indhentet stedfortrædende samtykke fra forældremyndighedens indeha-ver, jf. komitélovens § 17. Det stedfortrædende samtykke skal være udtryk for den mindreåriges interes-se. Komiteen kan desuden kun meddele tilladelse, hvis den mindreårige vil modtage information fra enperson med kendskab til det område, som projektet vedrører, og som tillige har de pædagogiske forud-sætninger for at kunne formidle indholdet til den aldersgruppe, som projektet omfatter.En komité kan kun meddele tilladelse til at indlede og fortsætte et biomedicinsk forskningsprojekt, derberører personer under værgemål, der omfatter personlige forhold, herunder beføjelse til at meddelesamtykke til deltagelse i biomedicinske forskningsprojekter, jf. værgemålslovens § 5, hvis der er indhen-tet stedfortrædende samtykke fra værgen, jf. komitélovens § 17.Komiteen kan kun meddele tilladelse til at indlede og fortsætte et biomedicinsk forskningsprojekt, der be-rører voksne inhabile, hvis der er indhentet stedfortrædende samtykke fra den nærmeste pårørende ogden praktiserende læge alternativt Sundhedsstyrelsen. Det stedfortrædende samtykke skal være udtrykfor forsøgspersonens interesse. Komiteen kan kun meddele tilladelse, hvis forsøgspersonen vil modtageinformation, der er afpasset personens forståelsesevne.
•
Dispensation fra samtykkekravet vedrørende 15-17-årigeFor de 15-17-årige, som ikke er myndige, kan en komité dispensere fra kravet om samtykke fra foræl-dremyndighedens indehaver, jf. komitélovens § 17, stk.1, hvis den pågældende selv afgiver informeretsamtykke, jf. komitélovens § 19. Dispensationen skal ske under hensyntagen til projektets karakter, risi-ko og belastning. Det fremgår af § 19, stk. 2, at hvis den umyndige 15-17-årige selv afgiver informeretsamtykke efter stk. 1, skal forældremyndighedens indehaver have samme information og inddrages iden 15-17-åriges stillingtagen.
Udvalget har i forbindelse med udvalgets arbejde inddraget komitélovens regler om informeret samtykke, menudvalget har ikke koncentreret sig om revision af disse lovbestemmelser. Udvalget konstaterer, at reglerne sikrerforsøgspersonernes retssikkerhed. Som det fremgår af nedenstående, har udvalget imidlertid indgående drøftetbestemmelserne vedr. stedfortrædende samtykke i akutte situationer.Udvalget har desuden noteret sig, at det ikke inden for gældende regler er muligt at udføre forskning i forbindelsemed retslægelige obduktioner. I den forbindelse henvises der til rapporten ”Obduktion og forskning på afdøde”,som Det Etiske Råd og CVK udgav i 2006. Det bemærkes, at det anbefales i rapporten, at det bør være muligt atforske i forbindelse med retslægelige obduktioner, og det foreslås i rapporten, at man i den forbindelse følger desamtykkeregler, der gælder for lægevidenskabelige obduktioner og biomedicinske forskningsprojekter, der udfø-res i forbindelse hermed.6.4.2. Forskning i akutte situationer6.4.2.1. Gældende regler vedr. forskning i akutte situationerDer er fastsat særlige regler for de situationer, hvor et forskningsprojekt kun kan gennemføres i akutte situationer,og hvor et informeret samtykke i mange situationer ikke vil kunne afgives som ovenfor grundet karakteren af situ-ationen.Om forskning i akutte situationer, hvori der ikke udføres kliniske forsøg med lægemidler, er det fastsat i komitélo-vens § 20, at hvis karakteren af et projekt betyder, at det kun kan gennemføres i akutte situationer, hvor forsøgs-
73
personen ikke er i stand til at afgive et informeret samtykke, og det ikke er muligt at indhente et stedfortrædendesamtykke, kan projektet gennemføres, hvis det på længere sigt kan forbedre personens helbred. Den forsøgsan-svarlige skal snarest muligt efterfølgende søge indhentet informeret samtykke eller stedfortrædende samtykke.Af vejledning nr. 9688 af 6. oktober 2008 om anmeldelse m.v. af et biomedicinsk forskningsprojekt til det vi-denskabsetiske komitésystem fremgår nedenstående:”Det stilles som krav, at forsøgspersonens helbred på længere sigt formodes at kunne forbedres. Sådanne forsøgkan ikke gennemføres med lægemidler, men kan gennemføres i andre forsøg, herunder forsøg med medicinskudstyr.”Om klinisk forskning med lægemidler i akutte situationer er der fastsat særlige regler i komitélovens § 20 a. Detfremgår heraf, at hvis et biomedicinsk forskningsprojekt indebærer kliniske forsøg med lægemidler, og hvis karak-teren af forsøget betyder, at det kun kan gennemføres i akutte situationer, hvor forsøgspersonen ikke er i stand tilat afgive et informeret samtykke, og det ikke er muligt at indhente et stedfortrædende samtykke fra værgen, for-ældremyndighedens indehaver eller fra nærmeste pårørende og den praktiserende læge - alternativt embedslæ-gen - kan projektet gennemføres, hvis der er indhentet stedfortrædende samtykke fra forsøgsværgen. Den for-søgsansvarlige skal snarest muligt efterfølgende søge indhentet informeret samtykke eller stedfortrædende sam-tykke fra værgen, forældremyndighedens indehaver eller fra nærmeste pårørende og den praktiserende læge -alternativt embedslægen.Af lovbemærkningerne fremgår desuden:”Herudover gælder det særlige krav til forskning i akutte situationer, at de kliniske forsøg med lægemidler kun måiværksættes, hvis forsøgspersonens fysiske eller mentale tilstand, som gør det umuligt at opnå informeret sam-tykke og et almindeligt stedfortrædende samtykke, samtidig er en nødvendig forudsætning for forskningsprojek-tets udførelse, og at forsøget på længere sigt potentielt kan forbedre personens helbred.”Det fremgår af komitélovens § 7, nr. 8, at der ved forsøgsværge forstås en enhed bestående af to læger, der iakutte situationer, jf. § 20 a, kan give stedfortrædende samtykke på den inhabile forsøgspersons vegne. Forsøgs-værgen skal varetage forsøgspersonens interesser og være uafhængig af den forsøgsansvarliges interesser ogaf interesser i forskningsprojektet i øvrigt.Det bemærkes, at der af retssikkerhedsmæssige årsager ikke må være personsammenfald mellem de to læger,som udgør forsøgsværgen, og den forsøgsansvarlige, som ønsker forsøgspersonens deltagelse i et klinisk for-søg. Forsøgsværgen er to læger, som skal fungere som tredjemænd, der uafhængigt af den forsøgsansvarligesinteresser varetager forsøgspersonens interesser. Disse uvildige tredjemænd må således findes blandt nogle forforskningsprojektet "udenforstående" læger, der ikke tidligere har deltaget i eller fremover skal deltage i det forsk-ningsprojekt, som forsøgspersonen ønskes inddraget i. Det bør endvidere - hvor det er muligt - undgås, at beggede to læger i lægeenheden befinder sig i et underordnelsesforhold i forhold til den forsøgsansvarlige. Det forud-sættes desuden, at mindst én af lægerne i enheden, som udgør forsøgsværgen, har faglig indsigt på området, såforsøgsværgen kan varetage forsøgspersonens interesser ud fra sit kendskab til det biomedicinske forskningspro-jekt og forsøgspersonens tilstand, herunder om de fordele og risici, som fremgår af informationsmateriale til detgodkendte forsøg. Forsøgsværgen kan afgive et mundtligt samtykke, fx telefonisk, dog først efter forsøgsværgenskonkrete vurdering af oplysninger om den pågældende forsøgspersons tilstand m.v. Det er derfor ikke muligt atgive et generelt samtykke på forhånd eller til forsøg med forsøgspersoner med bestemte typer af akutte traumeretc.
74
Det bemærkes, at de danske regler om akutforskning i forhold til lægemiddelforsøg er baseret på GCP-direktivet,jf. afsnit 3.4.1. Det følger bl.a. af direktivets præambel pkt. 4 og 5, at der forud for kliniske forsøg med lægemidlerpå personer, som ikke er i stand til at give deres samtykke, bør indhentes et skriftligt samtykke fra patientensværge. Det stedfortrædende samtykke skal gives i samråd med den behandlende læge. Begrebet værge fastsæt-tes i national ret. Direktivet nævner ikke muligheden for at forske uden samtykke eller med efterfølgende samtyk-ke.6.4.2.2. Internationale erfaringerDe lande, som det danske system er sammenlignet med i kapitel 5, har – som det ses af nedenstående – megetforskellige regler om forskning i akutte situationer med lægemidler.Tabel 7: Sammenligning af mulighederne for gennemførelse af forskning med lægemidler i akutte si-tuationer i nabolandeneNorgeMulighed forforskning iakutte situati-oner med ef-terfølgendesamtykke6.4.2.3. Vanskeligheder vedr. de nuværende regler om forskning i akutte situationerLægeforeningen og andre har over for udvalget påpeget en række vanskeligheder vedrørende reglerne om forsk-ning i akutte situationer. For så vidt angår forskning i akutte situationer, som ikke involverer lægemidler, har Læ-geforeningen anført, at kriteriet om, at forsøget skal have udsigt til at kunne gavne den enkelte forsøgsperson kanvære problematisk i forhold til at udvikle prognosen for andre med samme diagnose eller tilstand.Ja, undersærlige for-udsætningerSverigeNejFinlandNejHollandJa, undersærlige for-udsætningerStorbritan-nienJaNejDanmark
Eksempel – forskning i akutte situationer uden brug af lægemidler, hvor forsøget skal komme den en-kelte til gavnI et forskningsprojekt, som involverer patienter med udposning på legemspulsåren, vil man i en blodprøve må-le koncentrationen af en markør fra bindevæv, som formodes at korrelere til sværhedsgraden af udposningen.Mange personer lever med en udposning på legemspulsåren i mange år, uden at dette giver anledning tilsymptomer eller sygdom. Progression af sygdommen er uforudsigelig, og det er vanskeligt at sige, hvornår eneventuel operation med fjernelse af udposningen bør ske. Risikoen ved sygdommen er, at udposningen plud-selig brister, og patienten bliver akut dårlig. Tilstanden er forbundet med høj dødelighed.I forskningsprojektet ønsker man at måle den nye markør hos patienter med forskellig sværhedsgrad af denneudposning. I den forbindelse ønsker man også at måle markøren hos patienter, hvor udposningen er bristetfor at vurdere, hvilken koncentration markøren har hos disse patienter. Tilstanden er ofte karakteriseret ved, atpatienten mister bevidstheden, når udposningen brister.Den forsøgsansvarlige anmoder derfor i ansøgningen til den videnskabsetiske komité om, at man i forsk-ningsprojektet må inkludere forsøgspersoner, jf. komitélovens § 20, da der ikke er tale om et lægemiddelfor-søg. Men da forskningsprojektet ikke kommer den inhabile forsøgsperson til gavn (men derimod andre patien-ter med tilsvarende sygdom), kan der ikke gives tilladelse til, at projektet gennemføres.
75
Som nævnt i afsnit 3.4.2 har Danmark underskrevet en tillægsprotokol til bioetikskonventionen. Protokollen omfat-ter alle former for biomedicinske forskningsaktiviteter, der indebærer direkte intervention på mennesker. I tillægs-protokollens artikel 19 (2) åbnes der mulighed for godkendelse af forsøg med forskning i akutte situationer, selvom det ikke på længere sigt vil forbedre den konkrete patients helbred, når det dog skaber gevinster for den på-gældende patientgruppe. Dette kan dog kun ske under forudsætning af, at forsøget kun indebærer minimale risicifor og minimal belastning af patienten.Lægeforeningen har desuden påpeget en række problemstillinger i forhold til forskning i akutte situationer medlægemidler efter komitélovens § 20 a. Det er i den forbindelse anført, at indhentning af et stedfortrædende, infor-meret samtykke ved hyperakutte tilstande ikke er praktisk muligt. Det er også anført, at det vil være uetisk at ud-skyde forskning for at afvente, at der indhentes stedfortrædende samtykke for patienten.
Eksempel – forskning i akutte situationer med lægemidlerI et forskningsprojekt ønsker man at vurdere effekten af ny medicin ved behandling af hjertestop i forhold tilstandardbehandling. Overlevelse efter hjertestop er tæt knyttet til den tid, der går inden behandlingen iværk-sættes. Indhentning af stedfortrædende samtykke vil være uetisk i dette tilfælde, da behandlingen skal iværk-sættes straks og således ikke kan afvente indhentelse af stedfortrædende samtykke. Patienten vil altså væredårligere stillet ved deltagelse i forskningsprojektet, end hvis vedkommende modtager standardbehandlinguafhængigt af, om den nye medicin er bedre end standardbehandlingen.
Udgangspunktet for behandling i det danske sundhedsvæsen er, at behandlingen er evidensbaseret. En forud-sætning for at få skabt evidens er, at behandlingen er undersøgt hos patienter, hvor indikationen foreligger. Uan-set hvor stærke indicier der måtte være på, at den nye behandling er bedre end standardbehandlingen, så kanspørgsmålet om den bedste behandling ikke afklares, før der har været en afprøvning i form af en klinisk under-søgelse hos den pågældende patientgruppe.Det er udgangspunktet, at forsøg med nye lægemidler i første omgang gennemføres med myndige og habile for-søgspersoner. Dette giver en indsigt i forventelige effekter og bivirkninger, inden behandlingen eventuelt indføresi behandlingen til andre patientgrupper. Men man kan desværre ikke altid slutte, at den pågældende behandlingogså vil have den samme effekt og den samme forekomst af bivirkninger hos forskellige patientgrupper. Den be-vidsthedssvækkede patient kan risikere at opleve en anden effekt eller opleve andre bivirkninger.Det etiske skisma ligger i ønsket om hver gang at give patienten den bedst mulige behandling. Såfremt et nyt læ-gemiddel efter endt undersøgelse har vist bedre effekt end standardbehandlingen, er de etiske overvejelser altandet lige lettere at håndtere, end hvis det derimod måtte vise sig, at det nye lægemiddel forværrer prognosen.Sidstnævnte situation kan opfattes som et overgreb på inhabile forsøgspersoner. Det må erkendes, at der - selvmed de bedste forundersøgelser og oplæg til ny forbedret behandling - uvægerligt vil forekomme forskningspro-jekter, hvor den nye behandling ikke viser den forventede gunstige effekt - eller måske er forbundet med uerkend-te bivirkninger. Derfor er det væsentligt, at al ny medicin undersøges i den rette patientpopulation, inden det ind-føres i standardbehandlingen. Dette er baggrunden for den evidensbaserede behandling, som forskningen skaberfundamentet for.Ovenstående må ses i lyset af, at alternativet til ikke at gennemføre forskningsprojekter i akutte situationer, hvorforsøgspersonen ikke kan samtykke, kan være, at kritisk syge patientgrupper ikke kan inddrages og få gavn afnye lægemidler – eller at gruppen vil være henvist til at skulle behandles ud fra resultater opnået fra en anden pa-tientpopulation.
76
På den baggrund har det været foreslået for udvalget, at der bør være mulighed for at inddrage patienter udenstedfortrædende samtykke i forskning i akutte situationer med lægemidler. Såfremt interventionen har til udsigt atforbedre prognosen for forsøgsdeltageren, eller hvis interventionen formodes at forbedre prognosen for andremed samme sygdom, lidelse eller tilstand under forudsætning af at interventionen er forbundet med minimal risikoeller besvær, skal det være muligt at inkludere uden indhentning af informeret eller stedfortrædende informeretsamtykke. Denne mulighed må udelukkende anvendes ved hyperakutte tilstande, hvor en tidsmæssig forsinkelseaf behandlingen i sig selv er forbundet med en forværring af prognosen for den pågældende sygdom, tilstand ellerlidelse. Lægeforeningen har desuden opstillet en række forslag, bl.a. inddragelse af uvildige eksperter, som skalsikre, at eksterne faglige vurderinger indgår i forbindelse med denne type af forskningsprojekter.Udvalget har overvejet Lægeforeningens bemærkninger til den nuværende lovgivning på området for forskning iakutte situationer.
6.5. Sagsbehandling og procedurer6.5.1. Arbejdsgange og beslutningsprocedurerUdvalget har diskuteret komiteernes arbejdsgange og beslutningsprocedurer med henblik på at skabe mere dy-namik og fleksibilitet i arbejdet i komiteerne.6.5.1.1. FlertalsbeslutningerDe regionale komiteer træffer i dag beslutning ved enstemmighed. Det forudsættes i komitélovens § 9, stk. 3, atkomiteerne ikke træffer deres afgørelser ved afstemninger, men ad argumentationens vej søger at opnå enighed ibedømmelsen af et forskningsprojekt. Udvalget har drøftet, om det er den mest hensigtsmæssige beslutnings-form. Udvalget har bl.a. drøftet, i hvilket omfang komitémedlemmernes adfærd påvirkes af kravet om enstemmig-hed. Udvalget har endvidere diskuteret rimeligheden i, at alle medlemmer de facto har vetoret i forhold til de en-kelte ansøgninger.Medlemmer i udvalget har anført, at konsensuskulturen kan betyde, at enkelte medlemmer af de regionale komi-teer tilbageholder deres synspunkter vedrørende konkrete elementer i en sag, fordi de ikke ønsker at være årsagtil, at en sag må sendes til behandling i CVK. Andre har anført, at kravet om enstemmighed kan være med at sik-re en bred belysning af problemstillingerne.På den baggrund har det været diskuteret, om man i det fremtidige komitésystem skal træffe afgørelser ved fler-tal, således at en sag godkendes, hvis et flertal er enige herom. Udvalget har endvidere diskuteret, om man skulleoperere med dobbelt flertal, således at der både skal være flertal blandt lægfolk og fagfolk, og hvor formanden(fagperson) og næstformanden (lægperson) begge skal være en del af flertallet. Stemmelighed skulle i forbindel-se med flertalsafgørelser håndteres ved at lade formandens stemme være den afgørende.6.5.1.2. Formandskompetence til selvstændigt at træffe afgørelse i sager, som er ukomplicerede og ruti-neprægedeSom det fremgår af afsnit 6.5.1.1, kan de regionale komiteer kun godkende en ansøgning om et forskningspro-jekt, såfremt der er enighed i komiteen.Det har været drøftet i udvalget, om der bør være mulighed for, at formanden eller formandskabet i ukomplicere-de og rutineprægede sager selvstændigt kan træffe afgørelse. Dette kan skabe et mere fleksibelt og effektivt ko-mitésystem, hvor ressourcerne kan fokuseres på de mere udfordrende ansøgninger. I enkelte regionale komiteerbehandles tillægsprotokoller i dag af formanden/formandskabet.
77
6.5.2. Ensartethed og gennemsigtighedUdvalget vil gerne påpege, at ensartethed og gennemsigtighed er nødvendigt for at sikre, at alle ansøgere fårsamme behandling, uanset hvilken komité der behandler deres ansøgning. Ensartethed og gennemsigtighed ersåledes centrale elementer i sikringen af fair sagsbehandling, som skal bidrage til at fastholde tilliden til det vi-denskabsetiske komitésystem fremadrettet.Allerede i dag eksister der er en række initiativer til at sikre ensartethed og gennemsigtighed i sagsbehandling ogafgørelser.6.5.2.1. Eksisterende rammer for sikring af ensartethed og gennemsigtighedEnsartethed i sagsbehandlingen understøttes af en række forhold i det eksisterende videnskabsetiske komitésy-stem:•Fælles tidsfrister:Det fremgår af komitélovens § 10, at der skal være truffet afgørelse i alle sager inden60 dage fra modtagelse af en behørigt udformet ansøgning. Fristen kan forlænges til 90 dage i særligetilfælde, hvor der er tale om behandling af en ansøgning om godkendelse af forsøg med genterapi, so-matisk celleterapi eller lægemidler, der indeholder genmodificerede organismer. Fristen på 90 dage kanforlænges med yderligere 90 dage i tilfælde af høring af offentlige råd og nævn. Ved behandling af enansøgning om godkendelse af xenogen celleterapi gælder ingen tidsmæssige begrænsninger i fristen formeddelelse af tilladelse.•Fælles regler for indhentelse af supplerende oplysninger:Inden for den periode, hvor ansøgningenbehandles, kan komiteen sende en enkelt anmodning om oplysninger ud over, hvad ansøgeren alleredehar forelagt. De oven for nævnte tidsfrister afbrydes, indtil de supplerende oplysninger er modtaget.•Fælles formkrav til ansøgningerne:Der er fælles nationale retningslinjer til udformningen af ansøg-ningerne. Disse retningslinjer er beskrevet i CVKs vejledning.•Fælles elektronisk anmeldelsesblanket:Der er etableret et fælles elektronisk ansøgningssystem foralle de regionale komiteer, som sikrer ensartede procedurer i forbindelse med indleveringen af anmel-delsesblanketten.•Drøftelse af særlige sager på CVKs møder:På CVKs møder kan de regionale repræsentanter frem-lægge behandlede sager, som de mener kan have interesse for de øvrige CVK-medlemmer. Dermed gi-ves også indblik i de sagsbehandlingsprocedurer, som er lagt til grund for behandlingen af den pågæl-dende sag.•Fælles uddannelsesmøde i CVK:Nye medlemmer tilbydes én-dagskurser afholdt af CVKs sekretariat.Her gives introduktion til lovgivningen på området samt konkrete projekter til drøftelse.•Sekretariaterne kan deltage i CVKs møder:De regionale sekretariater kan deltage i CVKs møder somobservatører. Hermed orienteres sekretariaterne om CVKs afgørelser og ræsonnementerne bag, hvilketkan bidrage til, at CVKs praksis implementeres regionalt.•Komitésystemets årsmøde.På årsmødet er der mulighed for at drøfte praksis og principielle spørgs-mål og udviklingstendenser.
78
Herudover er der ikke standarder for sagsbehandlingsprocedurerne. CVK har ikke beføjelser til at regulere disseprocedurer. De enkelte regionale komiteer tilrettelægger sagsbehandlingen, som de finder det mest hensigts-mæssigt. Det kan medføre, at der er forskellig praksis på tværs af regionerne for, hvor lang tid der går fra en an-søgning er indsendt til den behandles på et møde i en komité. Der er endvidere forskellig praksis for, i hvilket om-fang de regionale sekretariater går i dialog med forskerne for at sikre, at ansøgningen kan betragtes som behørigtudformet.Udvalget anerkender styrken ved, at de regionale komiteer kan tilrettelægge arbejdet, så det fungerer mest hen-sigtsmæssigt i dagligdagen. Omvendt kan det fra ansøgerens synspunkt være uhensigtsmæssigt, at sagerne ikkebehandles efter samme procedurer.Udvalget har ikke kendskab til, at der er systematiske forskelle mellem komiteerne i forhold til den måde, afgørel-serne træffes på. Udvalget understreger dog, at det er vigtigt, at de afgørelser, der træffes i de regionale komite-er, er ensartede for sammenlignelige sager. Udvalget anerkender, at der i sagens natur kan være variation i denmåde, hvorpå der træffes afgørelser i de forskellige komiteer, da alle afgørelser indeholder skønsmæssige vurde-ringer, bl.a. i forhold til deltagerinformations udformning, informationens relevans for forsøgspersonen og forsø-gets hypotese.6.5.2.2. Metoder til sikring af større ensartethed og gennemsigtighedFor fremadrettet at fastholde og styrke ensartethed og gennemsigtighed i sagsbehandling og afgørelser har ud-valget bl.a. drøftet nedenstående forslag:Vejledning i tvivlsspørgsmål og udarbejdelse af retningslinjer og bindende forskrifterCVK koordinerer arbejdet i de regionale komiteer. Det har været drøftet, hvorvidt de regionale komiteer bør kunnekonsultere CVK ved tvivlsspørgsmål. Set i lyset af den foreslåede sammensætning af CVK, vil CVK kunne rådgi-ve regionerne i større omfang end nu. Omvendt må klageadgangen til CVK også iagttages, således at der ikkesker uhensigtsmæssige sammenblanding af sagsbehandlingen mellem de to instanser. Der henvises desuden tilforvaltningslovens § 3, stk. 1, nr. 4. Indskrænkes vejledningen til at yde generel rådgivning om lovfortolkning ogom praksis, vil der ikke indtræde inhabilitet. Men tilkendegiver klageinstansen derimod en forholdsvis præcis ogendelig opfattelse vedr. en konkret sags udfald, vil der foreligge toinstansinhabilitet i forhold til en senere klage-sag.En anden mulighed, som har været fremført for udvalget, er, at CVK tillægges kompetence til at fastsætte bin-dende forskrifter for komitésystemets arbejde. Det skal dog hertil bemærkes, at de regionale komiteer i den gæl-dende lovgivning som udgangspunkt er selvstændige i alle henseender i relation til CVK. En anden løsning kansåledes være, at CVK efter høring af de regionale komiteer i større grad end i dag indstiller forslag til regler, somministeren herefter kan tage stilling til. Dette skal ses i sammenhæng med udvalgets overvejelser om en andensammensætning af CVK, jf. afsnit 6.2.2.1.Herudover kan CVK i større omfang udarbejde retningslinjer for enkelte områder, dog naturligvis uden at fratageskønnet fra de regionale komiteer. Identifikation af områder, hvor retningslinjer bør foreligge, kan bl.a. ske påbaggrund af erfaringer opsamlet i forbindelse med kvalitetsudvikling og kontrol, jf. afsnit 6.3.6, eller efter dialogmed de regionale komiteer, fx i forbindelse med samordningsforum eller lign.Kvalitetsudvikling i komitésystemetUdvalget har ligeledes drøftet, hvordan der løbende kan arbejdes med kvalitetsudvikling og kvalitetssikring i for-hold til komitésystemet. Udvalget har på den baggrund drøftet nedenstående muligheder:
79
•
Gennemførelse af testsager:Forslaget indebærer, at CVK skal udarbejde en fiktiv sag, som CVK sen-der til alle regionale komiteer i fuld åbenhed om formålet. Alle regionale komiteer behandler sagen ogudarbejder et svar samt en kort beskrivelse af hvilke opmærksomhedspunkter, der knytter sig til sagen.De respektive afgørelser gøres efterfølgende tilgængelige for alle komiteer, og CVK udarbejder en sam-let evaluering. Udvalget anerkender, at gennemførelse af testsager er ressourcekrævende. Der er dogenighed om, at gennemførelse af testsager kan bidrage til harmonisering i sagsbehandlingen og bidragetil at fremme videndelingen mellem de regionale komiteer.
•
Gennemførelse af audits:Forslaget indebærer, at CVK får mulighed for at evaluere og gennemlæsesager, der allerede er behandlet i de regionale komiteer og give kommentarer til sagsbehandlingen. For-slaget er mindre ressourcekrævende end forslaget om testsager, hvilket gør den attraktiv. Udvalget an-erkender dog også, at metoden ikke i samme omfang som testsager kan anvendes til at sammenlignesagsbehandlingen mellem de forskellige komiteer.
Eksempel – Abortankenævnets tilsyn med de regionale samrådAbortankenævnet har i dag en forpligtelse til at føre tilsyn med de regionale samråd med det formål at sikre enensartet behandling af sagerne i hele landet. Forpligtelsen bliver opfyldt ved, at samrådene indsender ca. � afde sager, de har haft under behandling til gennemsyn i Ankenævnet. De sager, hvor et eller flere af medlem-merne har fundet anledning til bemærkninger, bliver herefter drøftet på de faste møder, hvor det besluttes, omder skal gives bemærkninger til samrådet om sagen.
•
Styrkelse af uddannelsesprogram af nye medlemmer:Mulighederne for at udvide det eksisterendeuddannelsesprogram har været drøftet i udvalget. Der er enighed om, at det er væsentligt for komité-medlemmerne at være bekendte med deres rolle som forvaltningsmyndighed og de regler, der knyttersig hertil. Der er endvidere enighed om nødvendigheden af, at komitémedlemmerne har et indgåendekendskab til komitéloven og får en introduktion til videnskabsetik som begreb. Det er efter udvalgets op-fattelse uklart, om de eksisterende kursusrammer er tilstrækkelige for at sikre dette.
ÅrsberetningerI dag skal både de regionale komiteer og CVK afgive en årsberetning, der indeholder en redegørelse for komite-ernes virksomhed og praksis i det forløbne år, jf. komitélovens § 6. I årsberetningerne beskrives væsentlige vi-denskabsetiske problemer, som komiteerne har drøftet, og der redegøres for begrundelserne for udfaldet af væ-sentlige sager. Beretningen skal desuden indeholde en liste over alle anmeldte projekter.Formålet er at sikre, at offentligheden løbende har indseende med, hvilke problemer komiteerne behandler, oghvilke synspunkter, der har været lagt til grund for vurderingen.Bestemmelsen om årsberetninger stammer fra den første komitélov i 1992. Det har overfor udvalget været anført,at bestemmelsen stammer fra en tid, hvor der ikke fandtes hjemmesider. CVK har desuden oplyst, at CVKshjemmeside løbende holdes opdateret med alle de informationer, som årsberetningen normalt indeholder. Detbemærkes, at ikke alle de regionale komiteers hjemmesider er opdateret i samme omfang som CVKs hjemme-side. Årsrapporterne udkommer i dag på meget varierende tidspunkter.Det er muligt at revidere årsberetningernes udformning på flere måde, hvorved formålet – nemlig at sikre offent-ligheden viden om hvilke problemer komiteen behandler og hvilke synspunkter, der har været lagt til grund forvurderingen – kan iagttages. Det kan fx ske ved, at komiteerne løbende opdaterer deres respektive hjemmesidermed information om behandling af projekter og vurderingerne heraf. Det kan også ske ved, at komiteerne og CVK
80
sammen udarbejder en fælles årsberetning for hele komitésystemet, som både beskriver praksis på udvalgte om-råder og udvælger et antal sager, som gennemgås. En sådan årsberetning kunne vedlægges en samlet liste medangivelse af anmeldte projekter opdelt i forhold til komiteerne.En samlet årsberetning vil både kunne bidrage til åbenhed og gennemsigtighed og vil desuden sikre fokus på ud-viklingstendenser indenfor det videnskabsetiske område.6.5.3. Anmeldelse og sagsbehandlingSom tidligere nævnt er det sundhedsvidenskabelige forskningsområde kendetegnet ved en stigende internationa-lisering. Fra dansk side er der en klar interesse i at fastholde Danmark som et attraktivt sted at udføre kliniskforskning. Det understreger betydningen af et smidigt og effektivt dansk komitésystem.Der er over for udvalget blevet påpeget en række udfordringer og svagheder ved selve sagsbehandlingen i detdanske komitésystem. Udvalget har derfor behandlet nedenstående problemstillinger, som kan virke hindrendefor udviklingen af forskning i Danmark.6.5.3.1. Dansksprogede protokollerNår den forsøgsansvarlige skal anmode om en godkendelse af et forskningsprojekt, skal den forsøgsansvarligebl.a. indsende en forsøgsprotokol til den videnskabsetiske komité. Det fremgår af CVKs vejledning, at en forsøgs-protokol er et dokument, som beskriver målsætning, udformning, metodologi, tilrettelæggelse, statistiske overve-jelser, videnskabsetiske overvejelser, økonomiske forhold, publikationsmæssige forhold og information af deltage-re om et biomedicinsk forskningsprojekt m.v. Nedenstående skal vedlægges forsøgsprotokollen:•••••••LægmandsresuméSkriftlig deltagerinformationBeskrivelse af procedurer for afgivelse af mundtlig deltagerinformationSamtykkeerklæringAnnoncemateriale til hvervning af deltagereSpørgeskemaerØvrigt materiale, som uddybes specifikt i de følgende afsnit
Materialet skal være skrevet på dansk. Ved multicenterforsøg, hvor en engelsk protokol er godkendt i udlandet,skal der indsendes en dansk protokol til komiteen. Den danske protokol behøver ikke nødvendigvis at være enfuldstændig oversættelse af den engelske protokol, men der er tale om en selvstændig dansk protokol, som skalleve op til vejledningens krav. Den danske protokol er gældende for de danske forsøgssteder. Det kan dog i etvist omfang i multinationale projekter accepteres, at statistikafsnit ikke oversættes til dansk.Forsøgsprotokollen skal også vedlægges et lægmandsresumé, som skal indeholde en almen forståelig beskrivel-se af projektet. Beskrivelsen skal dække protokollens grundlæggende forhold i en kortfattet form. Lægmandsre-sumeet skal således indeholde beskrivelse af forsøgsprotokollens oplysninger om formål, metode, bivirkninger,risici og ulemper, forsøgspersoner, herunder inklusions- og eksklusionskriterier, oplysninger om ekstern økono-misk, støtte fra private virksomheder og fonde samt en videnskabsetisk redegørelse uden brug af tekniske/fagligeudtryk. Lægmandsresuméet indgår som en del af komiteens bedømmelsesgrundlag. Formålet er at give komite-ens lægmænd mulighed for at forholde sig videnskabsetisk til projektet.Det bemærkes, at Lægemiddelstyrelsen ikke har et tilsvarende krav om dansksprogede forsøgsprotokoller. Læ-gemiddelstyrelsen foretager således godkendelser på baggrund af det engelsksprogede materiale.
81
En protokoloversættelse koster omkring 75.000 – 100.000 kr. LIF har oplyst, at oversættelsen af en protokol kunanvendes til de videnskabsetiske komiteers arbejde, da de internationale studier udfærdiges på engelsk for at sik-re konsistens mellem de deltagende aktører i de forskellige lande. Det kan desuden konstateres, at de øvrigenordiske lande samt Holland modtager protokoller på engelsk, jf. kapitel 5.Det bemærkes, at det overfor udvalget har været anført, at det i forbindelse med multicenterforsøg, som foregår iflere lande samtidig, kan være uhensigtsmæssigt både at have en engelsk version af en forsøgsprotokol, som ergrundlaget for forskningssamarbejdet, samtidig med at der foreligger en dansk version, som er gældende for dendel af forsøget, som udføres i Danmark. Oversættelsen til dansk kan således medføre risiko for unøjagtigheder ogmedføre fortolkningstvivl.Det kan overvejes, hvorvidt kravet om dansksprogede protokoller kan fjernes. I vurderingen af om de danskspro-gede protokoller kan afskaffes må faktorer såsom sammensætningen af komiteerne og deres kompetencer samtdet øvrige materiale, som indsendes til komiteerne, inddrages. Vedr. overvejelse om sammensætning af komite-erne henvises til afsnit 6.2. I forhold til det øvrige materiale, som komiteerne modtager fra de forsøgsansvarlige,kunne der være mulighed for at udvikle materialet. Det kan fx ske ved, at lægmandsresumeet forbedres og udvik-les til et mere dækkende protokolresume, udarbejdet på dansk.6.5.3.2. Ansøgningsproceduren – indsendelse af ansøgning, harmonisering af ansøgningsskemaer, elek-tronisk modtagelse og tidsfristerIndsendelse af ansøgningDet er ikke nødvendigvis den samme person/virksomhed, der ansøger om tilladelse til et klinisk forsøg hos hen-holdsvis Lægemiddelstyrelsen og komitésystemet.Ansøgning om tilladelse til et klinisk forsøg skal indgives til Lægemiddelstyrelsen af den person, virksomhed ellerinstitution, der påtager sig ansvaret for igangsætning, ledelse og eventuelt finansiering af et klinisk forsøg (spon-sor), jf. lægemiddellovens § 88, stk. 3. Sponsor er defineret i GCP-bekendtgørelsens § 2, nr. 5. Sponsor og in-vestigator kan ifølge denne bestemmelse være én og samme person – men det er ofte ikke tilfældet. Investigatorer defineret som en læge/tandlæge, der er ansvarlig for den praktiske gennemførelse af et klinisk forsøg på et be-stemt forsøgscenter, jf. GCP-bekendtgørelsens § 2, nr. 6. I bekendtgørelserne om medicinsk udstyr skal ansøg-ning om tilladelse til klinisk afprøvning af medicinsk udstyr indgives af den forsøgsansvarlige, jf. § 9, stk. 2, i be-kendtgørelsen om medicinsk udstyr, § 6, stk. 2 i bekendtgørelsen om aktivt, implantabelt medicinsk udstyr og §8a i bekendtgørelsen om medicinsk udstyr til in vitro-diagnostik. Den forsøgsansvarlige er defineret som den per-son, institution eller virksomhed, der påtager sig ansvaret for iværksættelse og gennemførelse af en klinisk af-prøvning.Ansøgningen til den regionale videnskabsetiske komité skal indsendes af den ”forsøgsansvarlige”, jf. komitelo-vens § 8, stk. 1. Den forsøgsansvarlige er defineret som en person, der udøver et erhverv, der er anerkendt til ud-førelse af forskning, fx via en ansættelse som forsker eller ph.d.-studerende eller på anden vis ved beskæftigelsemed konkret forskningsarbejde, og som er ansvarlig for den praktiske gennemførelse af forsøget på et bestemtforsøgssted, jf. komitelovens § 7, nr. 4. Det er dermed den ansvarlige for den praktiske gennemførelse af forsøget(investigator), der er ansvarlig for anmeldelse/ansøgning til den videnskabsetiske komité.I praksis vil det ofte være forskellige personer, der sender ansøgning ind til henholdsvis Lægemiddelstyrelsen ogden regionale videnskabsetiske komité. Det forudsætter effektiv koordinering hos de ansøgende for at sikre, atder arbejdes med samme forsøgsprotokol, og at relevante oplysninger tilgår begge myndigheder i fornødent om-fang. Der er set eksempler på afvigelser, fx i forhold til forsøgsperioden, fordi der ikke har fundet tilstrækkelig ko-ordinering sted.
82
Det bemærkes desuden, at det i Sverige og Holland er sponsoren, der indsender ansøgningen til den videnskabs-etiske komité.På den baggrund har udvalget overvejet, om det bør være én person, sponsoren, som indsender ansøgningen tilbåde Lægemiddelstyrelsen og den videnskabsetiske komité. Udvalget har også overvejet om, såfremt sponsor oginvestigator/den forsøgsansvarlige ikke er den samme, at begge personer bør skrive under på ansøgningen tilden videnskabsetiske komité. Dette kunne bidrage til at styrke koordinationen mellem sponsor og den forsøgsan-svarlige, ligesom det ville synliggøre begge personers involvering og ansvar i ansøgningsprocessen.Det bemærkes i øvrigt, at den forsøgsansvarlige er ansvarlig for den praktiske gennemførelse af forsøget, herun-der ansvarlig for, at det i situationer med delegation til kliniske forskere, som er tilknyttet projektet, sikres, at dissepersoner er indforstået med projektets forsøgsprotokol og eventuelle vilkår, som kan være fastsat i forbindelsemed godkendelsen fra det videnskabsetiske komitésystem. Den forsøgsansvarlige er således naturligvis forpligtettil at instruere andre tilknyttede forskere i forbindelse med en eventuel delegation.AnsøgningsskemaerneSom led i en mere smidig sagsbehandling har det været drøftet, hvorvidt selve ansøgningsskemaerne for læge-middelforsøg, som både skal anmeldes til Lægemiddelstyrelsen og de videnskabsetiske komiteer, kan harmoni-seres. CVK har i den forbindelse oplyst, at CVKs sekretariat medio 2009 har drøftet spørgsmålet med de regiona-le videnskabsetiske komiteers sekretariater. Det blev i denne sammenhæng konkluderet, at det ikke er muligt pånuværende tidspunkt at anvende en harmoniseret anmeldelsesblanket af nedenstående årsager:••••••EMA-skemaet, som anvendes til ansøgninger til Lægemiddelstyrelsen, indeholder ikke et egentligt sags-behandlingsystem.16Komitésystemet har ikke mulighed for at trække oplysninger fra EMAs database.EMA-skemaet giver ikke mulighed for, at der kan vedhæftes protokoller til selve skemaet.EMA-skemaet er engelsksproget, mens komitésystemet anvender dansk som anmeldelsessprog.EMA-skemaet indeholder mange oplysninger, som ikke er relevante for komitésystemet. Dette kan med-føre risiko for uoverskuelighed.Eventuelle ønsker om ændringer i EMA-skemaet sker centralt via EMA, hvilket vil give meget lidt smidig-hed for komitésystemet.Det blev ligeledes påpeget, at en stor del af de forsøg, som behandles i komitésystemet, ikke er lægemiddelfor-søg.Udvalget har drøftet vigtigheden af, at de forsøgsansvarliges veje ind i det samlede offentlige system bør lettes.Det konstateres, at der på nuværende tidspunkt er en række praktiske hindringer for at harmonisere ansøgnings-skemaerne.Elektronisk indsendelse af alt materiale til komitésystemetI dag udfyldes ansøgningsblanketten elektronisk af den forsøgsansvarlige, mens protokollen sendes i papirversi-on sammen med en udskrift af ansøgningsblanketten til de regionale komiteer. En enkelt komité modtager dog idag også protokollerne elektronisk.
16
Det europæiske lægemiddelagentur European Medicines Agency, EMA, har udarbejdet et ansøgningsskema, som anvendes ved anmeldelse afkliniske forsøg til Lægemiddelstyrelsen.
83
Udvalget har drøftet, om det kan lette ansøgningsprocessen for den forsøgsansvarlige, hvis materialet kan ind-sendes elektronisk. Dette vil påføre en mindre, øget byrde for sekretariaterne i forhold til produktion af eventuellepapirkopier til brug for udvalgsmøder. Dette må dog afvejes i forhold til den generelle udbredelse af elektronisksagsbehandling i offentligt regi.Tidsfrister og vurdering af, hvorvidt en ansøgning er behørigt udformetDet er over for udvalget blevet påpeget, at der er forskellig praksis i komiteerne for, hvornår en sag anses somværende behørigt udformet. Det har været anført, at der ikke er ens praksis for, hvorvidt komiteerne i vurderingenaf, om en sag er behørigt udformet både lægger vægt på de formelle krav og det materielle indhold.Det bemærkes, at sagsbehandlingsfristen på 60 dage, jf. komitélovens § 10, starter, når ansøgningen er behørigtudformet. Den tid, som eventuelt går med at indhente supplerende oplysninger til en ufuldstændig ansøgning, ersåledes ikke indeholdt i de 60 dage.I Lægemiddelstyrelsen starter sagsbehandlingstiden med at løbe fra den dag, hvor ansøgningen stemples sommodtaget, under forudsætning af at ansøgningen er behørigt udformet. De dage, som styrelsen anvender til atundersøge, om ansøgningen er behørigt udformet, indgår i den samlede sagsbehandlingsfrist på 60 dage, så-fremt ansøgningen ved modtagelsen i Lægemiddelstyrelsen er behørigt udformet. Ved vurderingen af om ansøg-ningen er behørigt udformet tjekkes det, om ansøgningen er vedlagt forsøgsprotokollen og de nødvendige bilag.Der tages ikke stilling til ansøgningens materielle indhold.Såfremt ansøgningen, som sendes til Lægemiddelstyrelsen, ikke er behørigt udformet, kontakter styrelsen denforsøgsansvarlige med en anmodning om indsendelse af det nødvendige materiale. Sagsbehandlingsfristen vilherefter løbe fra den dag, hvor det supplerende materiale er modtaget, og hvor ansøgningen således er behørigtudformet.Såfremt Lægemiddelstyrelsen undervejs har spørgsmål til ansøgningens indhold, vil sagsbehandlingstiden i sty-relsen - modsat komitésystemet - ikke blive sat i bero, mens spørgsmålene afklares.Udvalget har på baggrund af ovenstående overvejet, hvorvidt der er behov for at få fastlagt krav til, hvornår enansøgning kan anses som værende behørigt udformet. Udvalget har desuden overvejet den i loven fastsatte tids-frist på 60 dage.6.5.3.3. Delegation fra den forsøgsansvarlige i forbindelse med underskrift på samtykkeerklæringerDet fremgår af § 4, stk. 4, i bekendtgørelsen om information og samtykke ved inddragelse af forsøgspersoner ibiomedicinske forskningsprojekter, at den forsøgsansvarlige senest i forbindelse med forsøgspersonens afgivelseaf samtykke skal attestere, at den skriftlige information er udleveret til forsøgspersonen, og at afgivelsen afmundtlig information har fundet sted. Af samme bestemmelses stk. 5 fremgår, at et informeret samtykke skal væ-re skriftligt, dateret og underskrevet eller afgivet ved brug af elektronisk signatur. Samtykket skal afgives til denforsøgsansvarlige eller en dertil bemyndiget person med direkte tilknytning til forskningsprojektet.Attestationen kan først afgives, når information er givet, og når afgivelsen af samtykket har fundet sted. Det frem-går videre, at det er den forsøgsansvarlige person, der skal underskrive attestationen.Såfremt et multicenterforsøg er organiseret med en hovedforsøgsansvarlig og et antal forsøgsansvarlige, der stårfor den praktiske gennemførelse af forsøget på forskellige andre forsøgssteder, er det den forsøgsansvarlige pådet givne forsøgssted, som skal attestere samtykkeerklæringen. Dette forudsætter dog, at den forsøgsansvarlige
84
på det pågældende sted opfylder betingelserne i lovens § 7, nr. 4. Er dette ikke tilfældet, kan den pågældendeikke være forsøgsansvarlig og vil følgelig ikke kunne underskrive attestationen.Det er overfor udvalget påpeget, at kravet om underskrift fra den forsøgsansvarlige er uhensigtsmæssigt, da detikke nødvendigvis vil være den forsøgsansvarlige, der faktisk afgiver informationen til forsøgspersonen.Udvalget har på baggrund heraf overvejet, hvorvidt mulighederne for delegation i forbindelse med underskrift fraden forsøgsansvarlige på samtykkeerklæringer kan gøres smidigere.6.5.3.4. Indberetninger af oplysningerNår et forsøg er godkendt og påbegyndt, kan en komité følge projektets forløb og kræve, at den afsluttendeforskningsrapport eller publikation sendes til komiteen. Der er desuden fastsat regler for, hvilke oplysninger derskal indberettes i forbindelse med forsøgets forløb, jf. nedenfor.•Indberetningspligten i biomedicinske forsøg, bortset fra lægemiddelforsøgDen forsøgsansvarlige skal omgående underrette komiteen, hvis der under projektet optræder alvorligebivirkninger eller alvorlige hændelser. Indberetningen skal ledsages af kommentarer om eventuelle kon-sekvenser for forsøget. Hvis det drejer sig om alvorlige bivirkninger eller alvorlige hændelser, som er enfølge af projektet, skal den forsøgsansvarlige meddele de oplysninger, som komiteen beder om.Den forsøgsansvarlige skal en gang årligt i hele forsøgsperioden indsende en liste over alle alvorligeventede og uventede bivirkninger og alle alvorlige hændelser, som er indtruffet i perioden. Indberetnin-gen skal være ledsaget af en vurdering af forsøgspersonernes sikkerhed, jf. komitélovens § 22, stk. 4.•Indberetningspligten i lægemiddelforsøgOmgående indberetning af alvorlige, uventede og formodede bivirkninger skal alene ske til Lægemiddel-styrelsen. Til den videnskabsetiske komité skal sponsor eller den forsøgsansvarlige en gang årligt i heleforsøgsperioden indsende en liste over alle alvorlige ventede og uventede bivirkninger og alle alvorligehændelser, som er indtruffet i perioden, jf. komitélovens § 22, stk. 4. Indberetningen skal være ledsagetaf en vurdering af forsøgspersonernes sikkerhed. For så vidt angår indholdet af oplistningen af bivirknin-ger følger komiteen retningslinjerne fra Lægemiddelstyrelsen.Det følger af GCP-direktivets artikel 17, stk. 2, at forskningsprojektets sponsor en gang om året skalsende en liste til den etiske komité over alle formodede alvorlige bivirkninger, som er indtruffet inden fordette tidsrum, og en rapport om forsøgspersonernes sikkerhed. Indberetninger af utilsigtede hændelserer således ikke omfattet af GCP-direktivets artikel 17, stk. 2.LIF har overfor udvalget påpeget forskellen mellem direktivets bestemmelse og den danske bestemmel-se. Udvalget har overvejet, hvorvidt en ændring af bestemmelsen i komitélovens § 22, stk. 4, vil havekonsekvenser for komitésystemets muligheder for at udøve sin virksomhed. Det kan hertil anføres, at deter Lægemiddelstyrelsen, som fører kontrol med kliniske lægemiddelforsøg, jf. lægemiddellovens § 90.6.5.3.5. Styrket informationsindsatsDe videnskabsetiske komiteer rådgiver i betragteligt omfang forskere om komitésystemet og andre beslægtedespørgsmål – fx relationen til Datatilsynet og Lægemiddelstyrelsen. Især uerfarne eller urutinerede forskere harbehov for vejledning fra komitésystemets sekretariater.For at sikre et fortsat effektivt komitésystem, som også kan understøtte udviklingen af god forskning i Danmark,har udvalget overvejet, om tværgående informationsinitiativer kan vejlede forskerne, således at der skabes et
85
samlet overblik over de offentlige aktører på området. Det er udvalgets vurdering, at sådanne tværgående infor-mationsinitiativer kunne være et nyttigt supplement til den konkrete vejledning, som allerede finder – og fortsatskal finde – sted i de videnskabsetiske komiteer og deres sekretariater.6.5.3.6. Publikation af projekter, der ikke er anmeldelsespligtigeEn videnskabsetisk godkendelse af et forskningsprojekt kan være en betingelse for, at en forsker kan få offentlig-gjort sine resultater i anerkendte, faglige tidsskrifter. Ikke alle typer af forskningsprojekter er anmeldelsespligtige,jf. afsnit 3.3. Dette gælder fx registerforskningsprojekter og kvalitetsudviklingsprojekter. Forskere, som har udar-bejdet et sådant projekt, kan derfor modtage et ”letter of exemption” fra en videnskabsetisk komité, som oplyser,at projektet ikke er anmeldelsespligtigt i Danmark.Det har over for udvalget været anført, at et sådant brev ikke er nok for at få de videnskabelige resultater publice-ret i faglige tidsskrifter.Det er omvendt oplyst over for udvalget, at det er uproblematisk at få publiceret resultater af ikke-anmeldelses-pligtige forskningsprojekter, blot forskeren kan oplyse, at denne har spurgt den relevante komité, og at komiteenhar oplyst, at forskningsprojektet ikke er anmeldelsespligtigt. Dette gælder både for Ugeskrift for Læger og inter-nationale faglige tidsskrifter. Det kan desuden bemærkes, at det tilsvarende i Sverige og Norge er muligt at få ud-stedt et ”letter of exemption” i tilfælde, hvor et givent forskningsprojekt ikke er anmeldelsespligtigt. Det er oplyst,at disse lande ikke har kendskab til eventuelle problemer i forbindelse med publikation af forskningsresultater somfølge af en manglende godkendelse, når der er udstedt et ”letter of exemption”.
86
7. Udvalgets 40 anbefalinger tilindretningen af fremtidensvidenskabsetiske komitésystem
7.1. Indledning – forankring, udvikling og tendenserDette kapitel indeholder udvalgets anbefalinger til indretningen af fremtidens komitésystem. Udvalget præsentererud fra en samlet vurdering 40 konkrete forslag og anbefalinger, som kan skabe rammerne for at gøre et godtdansk komitésystem endnu bedre. Til gavn for både forsøgspersoner og forskningen.Ambitionen er et komitésystem, som på én og samme tid sikrer forsøgspersonernes integritet og velfærd og giverbefolkningen tillid til at deltage i sundhedsvidenskabelige forsøg, samt bidrager til at sikre dansk sundhedsforsk-ning en international førerposition.For at sikre et sådan system er det efter udvalgets opfattelse vigtigt, at brede interesser og forskellige holdningerrepræsenteres af både fagfolk og lægmænd. Det understøttes af, at det videnskabsetiske komitésystem er demo-kratisk forankret og virker uafhængigt af andre instanser. Den demokratiske forankring er med til at sikre en re-præsentation af befolkningens holdninger til den videnskabsetiske kultur, som til stadighed forandres og nuance-res i takt med forskningens udvikling. Komitésystemet påvirkes naturligt af andre systemer og interessenter, somkomiteerne skal spille sammen med. Det drejer sig om det politiske system, både nationalt og regionalt, borgere,patienter og forsøgspersoner, erhvervslivet og forskningsverdenen.
Figur 5: Det videnskabsetiske komitésystem i Danmark - interessenter og indflydelse
Borgere,patienter ogforsøgsper-soner
Forskningogforsknings-institutioner
Detvidenskabsetiskekomitésystem
Det politiskesystem –nationalt ogregionalt
Erhvervslivog industri
87
Komitésystemet må således ses som et uafhængigt system, der præges af bevægelser på andre områder. Deopgaver, som komitésystemet selvstændigt skal løse, herunder det skøn som komiteerne skal foretage i forbin-delse med vurderingen af en sag, må således ses i den kontekst, som systemet befinder sig i, jf. figur 5.Udvalgets anbefalinger hviler på en række overordnede tendenser og pejlemærker, som udvalget ser på området.
Overordnede tendenser og pejlemærker for udvalgets anbefalinger:••••••God videnskabsetik og god forskning går hånd i hånd.Sundhedsvæsenets ”triangel”: God forskning – godt sundhedsvæsen – god patientbehandling.Forsøgspersonernes rettigheder, sikkerhed og integritet – patienternes interesser i udvikling af nyebehandlingsmetoder.Stigende internationalisering af videnskabsetik og forskning – stigende konkurrence om dansk delta-gelse.Stigende faglig kompleksitet.Harmonisering – effektivisering – gennemsigtighed i sagsbehandlingen.
God videnskabsetik og god forskning går hånd i håndUdvalget vil gerne bidrage til at tegne et billede af, at god videnskabsetik og god forskning er hinandens forud-sætninger. God videnskabsetik understøtter kvaliteten i forskningen og skal tænkes med fra start til slut – fra ide-en til et forskningsprojekt opstår til den afsluttende publicering af projektets resultater. Deri ligger også, at alforskning i udgangspunktet har en etisk dimension, og at Danmark skal have et komitésystem, som kan håndteredette.Det er en tendens, udvalget også har identificeret internationalt, og som bl.a. kommer til udtryk i rapporten ”Ethicsfor Researchers”, som EU-Kommissionen udgav i 2007 i forbindelse med det 7. rammeprogram.
“Ethics is often misunderstood by researchers as hindering scientific progress. While it is true that ethics isclosely linked with law, rules and regulations, it does not go against research… By considering ethical issuesfrom the conceptual stage of a proposal, the quality of research is enhanced.”Citat fra “Ethics for Researchers”, Facilitating Research Excellence I FP7, Den Europæiske Kommission,2007.
Udvalget ser også, at udviklingen går i retning af højere grad af direkte og synlig ansvarlighed for opfyldelse afprincipperne om god videnskabsetik hos de forsøgsansvarlige. Vejledningerne om god videnskabelig praksis,som er udarbejdet af Udvalgene vedr. Videnskabelig Uredelighed, baserer sig således på, at ansvaret for, at etforsøg udføres videnskabsetisk forsvarligt, ligger hos de forsøgsansvarlige og deres respektive forskningsinstitu-tioner og virksomheder. Det fremgår også direkte af universitetslovens formålsbestemmelse, at ”universitet harforskningsfrihed og skal værne om denne og om videnskabsetik”, jf. § 2, stk. 2.Udvalget ønsker med sine anbefalinger at støtte op om denne udvikling.
88
Sundhedsvæsenets ”triangel”: God forskning – godt sundhedsvæsen – god patientbehandlingFigur 6: Sundhedsvæsenets ”triangel”: God forskning – godt sundhedsvæsen – god patientbehandling
God forskning
God patientbehandling
Godt sundhedsvæsen
Udgangspunktet for udvalgets anbefalinger er, at det er en afgørende forudsætning for et moderne og velfunge-rende sundhedsvæsen med behandling af høj kvalitet, at sundhedsforskningen er i top. Den tætte sammenhængmellem forskning og kvalitet i behandlingen understreges også i sundhedsloven. Dansk sundhedsforskning ermed helt fremme. Sundhedsforskningen er det største forskningsfelt herhjemme, og kvaliteten og produktivitetener høj, hvilket bl.a. giver sig udslag i, at dansk sundhedsforskning på flere områder hører til i verdenseliten.17Detkommer patienterne til gavn i form af forbedret behandlingskvalitet.Den position skal bevares – og om muligt styrkes. Her spiller komitésystemet også en rolle, ligesom det er vigtigtat sikre, at der er nem adgang til forskning og til at deltage i forsøg.Forsøgspersonernes rettigheder, sikkerhed og integritet – patienternes interesser i udvikling af nye behandlings-metoderKomitésystemet blev oprettet i en kontekst, hvor det entydigt handlede om at beskytte forsøgspersonen modeventuelle overgreb. Udvalget er meget enigt i, at det fremmeste formål med komitésystemet er at sikre forsøgs-personernes rettigheder, sikkerhed og integritet. Men det er udvalgets vurdering, at det også er vigtigt at væreopmærksom på, at danske patienter har en berettiget forventning om at modtage den nyeste og bedste behand-ling og dermed også en interesse i, at der gennemføres videnskabelige forsøg. Dette forhold er også kommet tiludtryk i de senere år, bl.a. gennem udtalelser fra patientforeninger.Det er udvalgets vurdering, at det er vigtigt også at holde sig dette perspektiv for øje i forbindelse med indretnin-gen af fremtidens komitésystem. Men således at hensynet til at undgå at udsætte forsøgspersoner for unødig risi-ci altid har førsteprioritet. Den enkelte forsøgsperson skal kunne nære tillid til, at der er de rigtige rammer for atdeltage i sundhedsvidenskabelige forsøg.
“…Informeret samtykke er hjørnestenen i langt den største del af biomedicinsk forskning herhjemme… Men vimangler mulighed for også at kunne forske på patienter, der ikke kan give informeret samtykke. De patienterhar efter min mening lige så stor ret til at få evidensbaseret behandling, som man har, når man kan give in-formeret samtykke. Vi ved jo, at det er forskning, som bringer os videre...”Overlæge Hanne Berg Ravn i Ugeskrift for Læger 1009; 171(41):2966
17
”Dansk sundhedsforskning – status og perspektiver”, Ministeriet for Sundhed og Forebyggelse, 2008.
89
Stigende internationalisering af videnskabsetik og forskning – stigende konkurrence om dansk deltagelseDer sker en stigende internationalisering disse år – både i forhold til det sundhedsvidenskabelige forskningsom-råde og på det videnskabsetiske område. Det er derfor vigtigt, at den internationale udvikling vedr. fortolkning ogforvaltning af videnskabsetiske principper løbende opfanges og integreres i dansk praksis. Samtidig er det ogsåvigtigt, at man fra dansk side aktivt søger at påvirke den internationale udvikling.Kliniske forsøg foregår ligeledes i stigende grad internationalt på tværs af grænser, hvilket betyder, at afgørelsenaf, hvorvidt et givent forsøg placeres i Danmark, i højere grad sker i international konkurrence. Vel at mærke eninternational konkurrence, som bliver hårdere og hårdere. Samtidig bliver flere og flere biomedicinske forsøg,særligt lægemiddelforsøg, multinationale.Udvalget har i den forbindelse noteret sig rapporten ”Klinisk forskning i Danmark – tid til handling” udarbejdet i DetNationale Samarbejdsforum for Sundhedsforskning.Fra dansk side er der en klar interesse i at fastholde Danmark som et attraktivt sted at udføre klinisk forskning.Det understreger betydningen af et smidigt og effektivt dansk komitésystem, som løbende opfanger og indarbej-der relevante internationale tendenser.Stigende faglig kompleksitetDet sundhedsvidenskabelige forskningsområde er i rivende udvikling. Nye – og stadigt mere komplekse – meto-der og forskningsområder kommer til, bl.a. indenfor stammecelleforskning og forskning med biologiske lægemid-ler. Den stigende faglige kompleksitet stiller nye krav til komitésystemet.Harmonisering – effektivisering – gennemsigtighed i sagsbehandlingenUdvalget er meget optaget af, at der skal sikres større ensartethed og gennemsigtighed i sagsbehandlingen bådeaf hensyn til forsøgspersonerne og af hensyn til forskerne, som har en berettiget forventning om ensartet, åbenog effektiv sagsbehandling, uanset hvor i landet de henvender sig. Ensartethed og gennemsigtighed er centraleelementer i sikringen af fair sagsbehandling og kan bidrage til fremadrettet at fastholde tilliden til det videnskabse-tiske komitésystem.7.1.1. Udvalgets anbefalingerMed udgangspunkt i ovenstående præsenterer udvalget i det følgende sine anbefalinger til indretningen af fremti-dens komitésystem. Som det fremgår af kapitel 6, har udvalget haft omfattende overvejelser og drøftelse vedrø-rende udvalgets 40 anbefalinger. Udvalgets medlemmer er enige om størstedelen af udvalgets anbefalinger,mens visse anbefalinger er udtryk for et flertal af medlemmers holdning. Danske Regioners repræsentant har øn-sket at få medtaget en mindretalsudtalelse i forhold til nogle af udvalgets anbefalinger. Mindretalsudtalelsen ermedtaget som bilag 3 til betænkningen.Anbefalingerne er struktureret i forhold til fire temaer:••••Komitesystemets struktur, herunder komiteernes sammensætning og rammevilkårKomitésystemets opgaver og opgaveportefølje, herunder opfølgning og kontrolForsøgspersonens deltagelse i forsøgKomitésystems sagsbehandling og opgavevaretagelse
90
7.2. En fremtidssikret struktur7.2.1. Komitésystemets fremtidige struktur – regionale komiteer og en nytænkt national komitéDer har i udvalget været en grundig drøftelse af, hvordan fremtidens komitésystem skal indrettes. Udvalget harovervejet forskellige modeller for komitésystemets fremtidige struktur, herunder en model hvor komitésystemetcentraliseres samt forskellige modeller, som tager udgangspunkt i en decentral struktur.Det er udvalgets vurdering, at det er vigtigt at sikre et system, som både har bred legitimitet og folkelig forankring,og som samtidig er effektivt og gennemsigtigt. Et system som dels sikrer forsøgspersonernes integritet og vel-færd og giver befolkningen tillid til at deltage i sundhedsvidenskabelige forsøg, dels sikrer gode rammevilkår fordansk sundhedsforskning.Det er udvalgets vurdering, at disse hensyn bedst tilgodeses, hvis komitésystemet forankres i politisk udpegedesystemer. Det giver bred legitimitet og sikrer ejerskab og ansvar for det arbejde, som udføres i komiteerne. Dendemokratiske forankring er med til at sikre en repræsentation af befolkningens holdninger til den videnskabse-tiske kultur, som til stadighed løbende forandres og nuanceres i takt med forskningens udvikling.Det er samtidig udvalgets vurdering, at det er nødvendigt med to niveauer – et nationalt niveau og et regionaltniveau – med hver deres opgaveportefølje og ansvarsområde.
Udvalget anbefaler:1.2.Regionale komiteer forankret i de fem regioner.En styrket national komité med udvidet opgaveportefølje og flere beføjelser.
Anbefaling 1: Regionale komiteer forankret i de fem regionerDet er udvalgets vurdering, at det danske komitésystem skal bygge på et antal decentrale komiteer forankret idet decentrale politiske system, som har ansvaret for sundhedsområdet, dvs. de fem regioner. De regionale ko-miteer skal have ansvaret for langt hovedparten af sagsbehandlingen i forhold til behandling af ansøgningerbortset fra forsøgsprojekter på nye og komplekse forskningsområder.Det er udvalgets vurdering, at det har en række fordele, at de regionale komiteer forankres i de fem regioner.Komitésystemets opgaver har tæt sammenhæng med regionernes øvrige opgaver. Det gælder særligt sund-hedsvæsenet, og den forpligtigelse regionerne i henhold til sundhedsloven har til at understøtte forskning. Foran-kringen af de regionale komiteer i det regionale, politiske system understreger regionernes ansvar for god praksispå området og synliggør samtidig det politiske ansvar for forskningens vilkår. Den regionale forankring er såledesogså med til at styrke forståelsen og accepten af forskningens betydning på regionalt politisk niveau.Udvalget ser også positive elementer i en centraliseret model, bl.a. i forhold til at sikre effektivitet og større ensar-tethed i sagsbehandlingen. Udvalget er ligeledes opmærksomt på, at en central model ikke forhindrer, at de de-centrale komiteer fysisk kan placeres regionalt, fx i forbindelse med de tre sundhedsvidenskabelige fakulteter.Samlet er det udvalgets vurdering, at den decentrale struktur er med til at give komitésystemet en bred forankringog dermed legitimitet.På den baggrund anbefaler udvalget, at de regionale komiteer forankres i de fem regioner, samt at medlemmer-ne udpeges af regionsrådene. Jf. afsnit 7.2.2.2 for en nærmere drøftelse heraf.
91
Anbefaling 2: En styrket national komité med udvidet opgaveportefølje og flere beføjelserLigesom for de regionale komiteer anbefaler udvalget, at den nationale komités legitimitet understreges ved enklar politisk forankring. På den baggrund anbefaler udvalget en national videnskabsetisk komité, som udnævnesaf indenrigs- og sundhedsministeren.Det er endvidere udvalgets vurdering, at der er behov for en stærk og uafhængig national komité, som kan agereproaktivt, håndtere komplekse problemstillinger og bidrage til at sikre ensartethed i sagsbehandlingen på tværsaf de regionale komiteer.I forhold til det nuværende CVK anbefaler udvalget derfor, at antallet af medlemmer i den nationale komité redu-ceres til 13 medlemmer. Udvalget anbefaler ligeledes, at den nationale komité får en række nye opgaver og til-lægges yderligere beføjelser, herunder at komiteen sagsbehandler forsøgsprojekter på nye forskningsområder,samt i større omfang skal udarbejde retningslinjer og vejledninger og indstille forslag til forskrifter til indenrigs- ogsundhedsministeren. Jf. afsnit 7.2.2.1, afsnit 7.3.2 og afsnit 7.5.2 for en nærmere drøftelse heraf. Der er såledestale om en nytænkt national komité med udvidet opgaveportefølje og flere beføjelser.For at understrege, at der er tale om en nytænkning af komiteens rolle, anbefaler udvalget samtidig, at det nuvæ-rende CVK omdannes til Den Nationale Videnskabsetiske Komité. Derved understreges komiteens rolle som deninstans, der opfanger og tegner den til enhver tid gældende danske praksis indenfor sundhedsvidenskabelig vi-denskabsetik.7.2.2. Bred sammensætning af den nationale komité og de regionale komiteerSammensætningen af både den nationale komité og de regionale komiteer skal sikre tilstedeværelse af de nød-vendige kompetencer i forhold til, at komiteerne kan løfte sine opgaver på en velkvalificeret og smidig måde. Der-for hænger udvalgets anbefalinger i forhold til sammensætningen af såvel den nationale komité som de regionalekomiteer naturligvis sammen med den opgaveportefølje og den arbejdsdeling, udvalget anbefaler i forhold til dennationale komité og de regionale komiteer, jf. afsnit 7.3.
Udvalget anbefaler:3.4.Bred sammensætning af den nationale komité og de regionale komiteer med både lægmænd og fag-kyndige.Øget fokus på ligestilling i sammensætningen af komiteerne.
Anbefaling 3: Bred sammensætning af den nationale komité og de regionale komiteer med både lægmænd ogfagkyndigeUdvalget har haft en overordnet drøftelse af sammensætningen af komiteerne, herunder af lægmandsrepræsen-tationen.Set i lyset af komitésystemets opgaveportefølje mener udvalget, at det er relevant, at komiteerne består af bådelægmænd og fagkyndige. Komitésystemet er herigennem med til at sikre befolkningens tillid til sundhedsviden-skabelige forsøg, og hermed også til at den sundhedsvidenskabelige forskning på længere sigt sikres tilgang affrivillige forsøgspersoner. Samtidig bidrager komitésystemets fokus på videnskabsetik til at øge kvaliteten afforskningen. Som tidligere fremhævet er det udvalgets klare vurdering, at god videnskabsetik og god forskning erto sider af samme sag.
92
Lægmandsrepræsentationen bidrager til at udvide perspektivet på forsøg, der inddrager mennesker i forhold til devidenskabelige og samfundsmæssige interesser, som potentielt kunne kompromittere forsøgspersonernes rettig-heder, sikkerhed og velbefindende. Man kan sige, at lægmændene skal kunne foretage vurderinger ved at sættesig i forsøgspersonernes sted uafhængigt af andre interesser.Det er på den baggrund udvalgets anbefaling, at der både i den nationale komité og de regionale komiteer delsskal være medlemmer med den relevante videnskabelige indsigt, så de kan gennemskue og vurdere projekter-ne, herunder de risici og fordele der måtte være forbundet med projektet, dels medlemmer der kan foretage envurdering af, om de risici er acceptable at udsætte forsøgspersoner for, også ud fra en lægmandsvinkel.Anbefaling 4: Øget fokus på ligestilling i sammensætningen af komiteerneUdvalget konstaterer, at der i enkelte komiteer ikke er en lige fordeling af kvinder og mænd. Udvalget finder detvigtigt, at der i forbindelse med nedsættelse af komiteerne også inddrages ligestillingsmæssige aspekter, jf. ogsåligestillingslovens §§ 4 og 10a. Udvalget vil derfor gerne opfordre til, at der sikres balance mellem kønnene i ko-miteerne.7.2.2.1. En nytænkt national komité på 13 medlemmer udpeget af indenrigs- og sundhedsministerenFor at kunne løfte de nye opgaver, som komiteen får, anbefaler udvalget, at den nationale komité sammensættesog udpeges på en anden måde end det nuværende CVK.Udvalget anbefaler:5.6.7.En nytænkt national komité med 13 medlemmer og regional repræsentation i form af et medlem frahver region.Etablering af effektivt kontaktforum mellem formandskaberne i den nationale komité og de regionalekomiteer.Ansvaret for at udpege medlemmer til den nationale komité forankres hos indenrigs- og sundheds-ministeren.
Anbefaling 5: En nytænkt national komité med 13 medlemmer og regional repræsentation i form af et medlem frahver regionUdvalget anbefaler, at den nationale komité får et fast medlemstal på 13 medlemmer. Det er udvalgets opfattelse,at et medlemstal på 13 vil være en hensigtsmæssig størrelse til at løfte komiteens opgaver og til at skabe mulig-heder for kvalificerede debatter.Det er vigtigt for udvalget, at den nationale komité består af medlemmer, som kan løfte de nye opgaver. På denbaggrund har der i udvalget været en diskussion af sammensætningen af den nationale komité, herunder om derskal være regional repræsentation i komiteen og i hvilket omfang.Det er udvalgets vurdering, at regional repræsentation i den nationale komité kan være med til at sikre sammen-hæng til det regionale sundhedsvæsen og de regionale forskningsmiljøer, ligesom det kan være med til at sikreregional opbakning og implementering af nationale beslutninger og udmeldinger. Regional repræsentation bidra-ger således til komiteens legitimitet og til at sikre sammenhæng mellem komitésystemets nationale og decentraleniveau. Det er ligeledes udvalgets vurdering, at det er væsentligt, at der blandt medlemmerne er erfaring fra denregionale sagsbehandling.Det er dog samtidig udvalgets opfattelse, at den regionale repræsentation i den nationale komité skal reduceresmarkant i forhold til det nuværende CVK, dels for at sikre et hensigtsmæssigt medlemstal, dels fordi det ud fra en
93
retssikkerhedsmæssig betragtning vurderes uhensigtsmæssigt, hvis der er for stort personsammenfald mellemførsteinstans- og andeninstansmyndigheden, selvom de personer, der har været med til at behandle en sag i enregional komité, ikke deltager i behandlingen af sagen i den nationale komité.På den baggrund anbefaler udvalget, at der skal være regional repræsentation i den nationale komité i form af étmedlem fra hver af de fem regioner. Udvalget anerkender dog samtidig, at der ligger en væsentlig kommunikati-onsopgave hos det regionale medlem, specielt i regioner med flere komiteer, i forhold til at sikre, at samtlige regi-onale komitémedlemmer løbende orienteres om arbejdet i den nationale komité.Anbefaling 6: Etablering af effektivt kontaktforum mellem formandskaberne i den nationale komité og de regionalekomiteerDet er udvalgets vurdering, at det er vigtigt sikre koordinering på tværs af komitésystemet. For effektivt at imøde-komme behovet for koordinering og erfaringsudveksling anbefaler udvalget, at der etableres et kontaktforum mel-lem formandskaberne i den nationale komité og de regionale komiteer. Udvalget foreslår, at dette forum mødesregelmæssigt, som minimum to gange årligt. Det foreslås også, at repræsentanter fra sekretariaterne deltager imøderne.Kontaktforummet skal spille en synlig rolle som platform for erfaringsudveksling baseret på konkrete sager, udvik-ling i sagsbehandlingspraksis, drøftelse af principielle spørgsmål, kvalitetsudvikling af komitésystemet, samt un-derstøtte implementeringen af centrale retningslinjer og vejledninger.Udvalget anbefaler ligeledes, at det nuværende fælles årsmøde for hele komitésystemet fastholdes.For at bidrage til løbende orientering og læring på tværs af komitésystemet, foreslår udvalget ligeledes, at dennationale komités afgørelser sendes til samtlige komiteer, jf. anbefaling 22.Anbefaling 7: Ansvaret for at udpege medlemmer til den nationale komité forankres hos indenrigs- og sundheds-ministerenDet er vigtigt for udvalget at sikre den rette sammensætning af den nationale komité. Ikke mindst set i lyset af atudvalget anbefaler en ændret arbejdsdeling mellem den nationale komité og de regionale komiteer, og at den na-tionale komité fremover skal spille en mere proaktiv og styrende rolle. Det er udvalgets overordnede anbefaling,at den nationale komité skal sammensættes bredt, så der dels er medlemmer med den relevante videnskabeligeindsigt, så de kan gennemskue og vurdere projekterne og de risici og fordele, der måtte være forbundet med pro-jektet, dels medlemmer der kan foretage en vurdering af, om risici er acceptable at udsætte forsøgspersoner for,om informationsskrivelserne er forståelige osv.Derudover har udvalget overvejet, om der er konkrete kompetencer/specialer, som bør være repræsenteret i dennationale komité, fx jura, pædiatri, farmakologi, psykiatri, embryologi, genetik, antropologi, psykologi, teknisk vi-denskab m.v. Udvalget mener dog ikke, at det specifikt skal fremgå af loven, hvilke kompetencer/specialer derbør være repræsenteret i den nationale komité, da det vil være for ufleksibelt.I stedet anbefaler udvalget, at det samlede ansvar for sammensætning og udpegning af medlemmer til den natio-nale komité forankres hos indenrigs- og sundhedsministeren, og at det således bliver op til ministeren at sikre, atrelevante kompetencer/specialer er repræsenteret.I forhold til den konkrete sammensætning af den nationale komité anbefaler udvalget som tidligere nævnt, at derskal være regional repræsentation i form af ét medlem fra hver af de fem regioner med henblik på at sikre dennødvendige sammenhæng til det regionale niveau. Dette kan fx ske ved, at hver region indstiller fire medlemmer
94
to kvinder og to mænd – to forskningsaktive og to lægmænd med henblik på, at ministeren i den endelige udpeg-ning kan sikre den hensigtsmæssige balance mellem forskningsaktive og lægmænd.For at sikre den nødvendige sammenhæng til det arbejde, som sker i regi af Forskningsrådene, anbefaler udval-get ligeledes, at komiteen suppleres med to medlemmer efter samlet indstilling fra bestyrelserne for de to forsk-ningsråd (Det Strategiske Forskningsråd og Det Frie Forskningsråd).Udvalget har ligeledes overvejet, om udvalgte organisationer eller faggrupper skal have mulighed for at indstillemedlemmer til den nationale komité. Det er imidlertid udvalgets vurdering, at det er vigtigere at fokusere på outputforstået som medlemmernes kompetencer, end på input forstået som hvem der indstiller medlemmer. I den for-bindelse har udvalget ladet sig inspirere af forskningsrådssystemet, hvor hovedparten af medlemmerne udpegesaf ministeren efter åbent opslag.På den baggrund anbefaler udvalget, at 5 af den nationale komités medlemmer udpeges af indenrigs- og sund-hedsministeren i samråd med videnskabsministeren efter åbent opslag. Denne model giver alle aktører på områ-det mulighed for at stille forslag, herunder faglige organisationer og selskaber, patientforeninger m.v., og kansamtidig bidrage til at øge opmærksomheden på og prestigen ved medlemskab af den nationale komité.I den endelige udpegning af den nationale komités 13 medlemmer er det ministerens ansvar at sikre, at komiteenhar den rette balance mellem forskningsaktive og lægmænd, samt at de nødvendige faglige kompetencer og spe-cialer er repræsenteret. Udvalget vil i den forbindelse understrege, at udvalget ønsker at sikre en bred sammen-sætning af den nationale komité. På den baggrund anbefaler udvalget følgende sammensætning og udpegning afden nationale komité, jf. nedenstående boks:
Udvalgets anbefalinger til sammensætning og udpegning af den nationale videnskabsetiske komité:••••Formand udpeget af indenrigs- og sundhedsministeren5 medlemmer udpeget af indenrigs- og sundhedsministeren efter indstilling fra regionerne2 medlemmer udpeget af indenrigs- og sundhedsministeren efter samlet indstilling fra bestyrelsernefor de to forskningsråd (Det Strategiske Forskningsråd og Det Frie Forskningsråd)5 medlemmer udpeget af indenrigs- og sundhedsministeren i samråd med videnskabsministeren ef-ter åbent opslag
7.2.2.2. De regionale komiteer forankres bredt i de fem regionerUdvalget anbefaler:8.9.De regionale komiteer forankres bredt i de fem regioner, og medlemmerne udpeges af regionsråde-ne.Flertal af lægmænd i de regionale komiteer.10. Medlemsantal på 7, 9 eller 11 medlemmer i de regionale komiteer.11. Formændene for de regionale komiteer vælges blandt komiteernes forskningsaktive.12. Det skal være mere attraktivt at være komitémedlem.
95
Anbefaling 8: De regionale komiteer forankres bredt i de fem regioner, og medlemmerne udpeges af regionsråde-neSom beskrevet i afsnit 7.2.1 anbefaler udvalget, at de regionale komiteer forankres i de fem regioner, da det sik-rer sammenhæng til det regionale sundhedsvæsen og regionernes forpligtigelse til at sikre udviklings- og forsk-ningsarbejde. På den måde sikres komitésystemet en bred forankring og dermed legitimitet.I forlængelse heraf ønsker udvalget at understrege mulighederne for, at regionerne i samarbejde kan etablere vi-denskabsetiske komiteer. Det kunne fx være aktuelt i forhold til regioner, der har relativt få sager, jf. anbefaling23. Udvalget ønsker ligeledes at understrege, at den nuværende mulighed for, at en region kan oprette flere ko-miteer, videreføres.Udvalget anbefaler, at medlemmerne udpeges af regionsrådene, eventuelt i samarbejde med Sundhedsbrugerrå-dene. I forhold til udpegningen af lægmænd har udvalget drøftet, bl.a. på forslag fra Danske Patienter, hvorvidt deregionale komiteer skulle have repræsentation fra patientforeninger, eventuelt som supplement til de politisk ud-pegede lægmænd. Der var ikke bred tilslutning til dette i udvalget.Udvalget har drøftet, hvorvidt der skal stilles krav til lægmændene, fx et krav om engelskkundskaber. Udvalgetfinder ikke dette hensigtsmæssigt. Udvalget anbefaler i stedet, at lægmandsresumeet udbygges og forbedres,såfremt kravet om en dansksproget protokol fjernes, jf. anbefaling 34 for en nærmere drøftelse heraf.I forhold til udpegningen af forskningsaktive medlemmer anbefaler udvalget, at den nuværende udpegningsmeto-de suppleres med, at de tre sundhedsvidenskabelige fakulteter får til opgave at indstille forskningsaktive med-lemmer til de regionale komiteer.Anbefaling 9: Flertal af lægmænd i de regionale komiteerUdvalget anbefaler, at den nuværende overvægt af lægmænd i de regionale komiteer fastholdes. Begrundelsenfor, at der i forbindelse med lovfæstelsen af komitésystemet i 1992 blev indført flertal af lægmænd, var at sikre, atbefolkningen kan have tillid til, at det ikke er forskerne, der selv bestemmer, hvilke forsøg de skal have lov til atgennemføre18. Det er udvalgets vurdering, at det danske særkende med flertal af lægmand bidrager til relevantedialoger og velafbalancerede afgørelser i de regionale komiteer og har været med til at sikre befolkningens tillid tilsundhedsvidenskabelig forsøg. Derfor finder udvalget det ikke relevant at ændre komitésystemet på dette områ-de.Anbefaling 10: Medlemsantal på 7, 9 eller 11 medlemmer i de regionale komiteerUdvalget har, jf. afsnit 6.2.2.2, drøftet medlemsantallet i de regionale komiteer. Med henblik på et effektivt samar-bejde i komiteerne og set i lyset af at de regionale komiteer ikke på nuværende tidspunkt består af mere end 11medlemmer, anbefaler udvalget, at medlemsantallet i de regionale komiteer kan være på 7, 9 eller 11 medlem-mer.Anbefaling 11: Formændene for de regionale komiteer vælges blandt komiteernes forskningsaktiveMed henblik på at sikre at formanden har en faglig indsigt i projekterne, anbefaler udvalget, at formændene for deregionale komiteer vælges blandt komiteernes forskningsaktive. Udvalget anbefaler samtidig, at næstformandenvælges blandt lægmedlemmerne med henblik på at sikre den nødvendige balance.
18
Jf. betænkning nr. 1185 ”Forskning på mennesker – etik/jura”, som et udvalg under Sundhedsministeriet afgav i 1989, samt Etisk Råds debatop-
læg ”Debatoplæg om et kontrolorgan” (1989), som begge blev udarbejdet forud for udarbejdelsen af den første komitélov,
96
Anbefaling 12: Det skal være mere attraktivt at være komitémedlemUdvalget er meget optaget af, hvad der kan gøres for at gøre det mere attraktivt at være medlem af en regionalkomité. Ikke mindst set i lyset af at det i dag er vanskeligt at rekruttere særligt forskningsaktive medlemmer til ko-miteerne.Udvalget ønsker grundlæggende at parallelisere komitésystemet med tilsvarende organer og har identificeret togrundlæggende udfordringer – dels at det ikke er fagligt meritgivende at sidde i en videnskabsetisk komité på linjemed fx medlemskab af et forskningsråd eller Det Etiske Råd, dels at arbejdsmængden er stor.Udvalget har derfor drøftet, hvad der kan bidrage til at gøre det mere meritgivende. Et vigtigt element i den sam-menhæng er, hvem der indstiller de forskningsaktive medlemmer. Som det fremgår af anbefaling 8, anbefaler ud-valget, at den nuværende udpegningsmetode suppleres med, at de tre sundhedsvidenskabelige fakulteter får tilopgave at indstille forskningsaktive medlemmer til de regionale komiteer. Det er udvalgets vurdering, at det vil bi-drage til at øge prestigen og synligheden ved arbejdet.Udvalget har herudover drøftet, om arbejdsmængden kan reduceres. Som det fremgår af afsnit 7.2.2.3, anbefalerudvalget, dels at sekretariatsfunktionen styrkes med henblik på, at der kan ske en større sagsforberedelse på se-kretariatsniveau, dels at der gøres brug af sagkyndige. Det er ligeledes udvalgets vurdering, at den ændrede ar-bejdsdeling mellem den nationale komité og de regionale komiteer, herunder forslaget om at forskningsprojekterpå nye forskningsområder fremover skal starte i den nationale komité, vil bidrage til at reducere og målrette ar-bejdsopgaven for de regionale komitémedlemmer.Udvalget har også drøftet honorarstørrelserne. Udvalget anbefaler, at komitémedlemmerne får et rimeligt honorar,der afspejler vigtigheden af arbejdet i de videnskabsetiske komiteer og er sammenligneligt med honorarer i lig-nende organer. Udvalget anbefaler ligeledes, at honorarstørrelserne ikke længere angives i komitéloven, da detvurderes som både atypisk og uhensigtsmæssigt.Det er ligeledes udvalgets forventning, at udvalgets 40 anbefalinger tilsammen indeholder et generelt løft af helekomitésystemet og en generel synliggørelse af komiteernes vigtige arbejde, som vil bidrage til at gøre det mereattraktivt at være komitémedlem.7.2.2.3. Styrkelse af sekretariatsfunktionerne og større inddragelse af sagkyndige/ekspertbistandUdvalget anbefaler:13. Sekretariatsfunktionerne organiseres regionalt og nationalt som komiteerne.14. Styrkelse af sekretariatsfunktionerne med sundhedsvidenskabelige kompetencer.15. Større faglig sagsforberedelse i sekretariaterne.16. Større inddragelse af sagkyndige/ekspertbistand.
Anbefaling 13: Sekretariatsfunktionerne organiseres regionalt og nationalt som komiteerneUdvalget har ligeledes drøftet, hvordan sekretariatsfunktionerne organiseres mest hensigtsmæssigt, herunder omman skulle ændre organiseringen af sekretariatsfunktionen bl.a. med det formål at bidrage til at sikre større ensar-tethed i sagsbehandlingen.Udvalget har således overvejet, om man skulle samle de regionale sekretariatsfunktioner i ét forvaltningsorganmed én direktør, som det planlægges i Norge, jf. afsnit 5.1. Nogle af de regionale sekretariater er i dag små oghar ganske få sager, hvorfor der kunne være gevinster ved en samlet sekretariatsfunktion. Omvendt giver den
97
regionale organisatoriske forankring af sekretariaterne mulighed for tæt koordinering med de(n) regionale komi-té(er), i særdeleshed formanden, og de regionale forskningsmiljøer, ligesom den nuværende organisering sikreret samlet regionalt ansvar for det decentrale niveau, herunder et samlet økonomisk ansvar. Det er udvalgets vur-dering, at det vil være uhensigtsmæssigt med et delt ansvar.På den baggrund anbefaler udvalget, at sekretariatsfunktionerne organiseres på samme måde som komiteerne,dvs. med regionale sekretariater forankret i de fem regioner og et nationalt sekretariat knyttet op på den nationalekomité.Udvalget er dog samtidig meget optaget af at sikre større ensartethed og større koordinering på tværs. Frem forat sikre dette gennem en fælles sekretariatsfunktion anbefaler udvalget, at man i stedet gør brug af redskabersom styrker koordinering på tværs, fx via sekretariaternes deltagelse i det nye formandskontaktforum, bindendeforskrifter, vejledninger, testsager, audits m.v., jf. afsnit 7.3.5 og 7.5.2 for en nærmere drøftelse heraf.Anbefaling 14. Styrkelse af sekretariatsfunktionerne med sundhedsvidenskabelige kompetencerUdvalget anbefaler, at der sker en styrkelse af sekretariatsfunktionerne såvel regionalt som centralt, bl.a. medhenblik på at styrke komitésystemets faglige kompetencer og sikre en større og mere faglig kvalificeret sagsforbe-redelse på sekretariatsniveau.I forlængelse heraf anbefaler udvalget, at sekretariaterne suppleres med sundhedsvidenskabelige kompetencer.Det kunne fx være i form af en videnskabelig sekretær som i Sverige. Det vil næppe være nødvendigt med enfuldtidsstilling. Udvalget anerkender, at den konkrete tilrettelæggelse heraf er et regionalt ansvar.Anbefaling 15: Større faglig sagsforberedelse i sekretariaterneDet er samtidig udvalgets anbefaling, at der i højere grad bør ske en egentlig faglig sagsforberedelse af sagerne isekretariaterne, fx i form af udarbejdelse af et cover, som indeholder et kort resumé af sagen samt indstilling tilafgørelse. Denne sagsforberedelse skal ske i koordinering med formanden og skal ses i sammenhæng med an-befaling 12 om, at formanden skal være forskningsaktiv. Formålet vil bl.a. være at målrette komitémedlemmernesarbejdsopgaver samt at reducere deres arbejdsmængde.Anbefaling 16: Større inddragelse af sagkyndige/ekspertbistandFor at øge de faglige kompetencer i komitésystemet i forbindelse med den konkrete sagsbehandling anbefalerudvalget, at den eksisterende mulighed for at indhente ekspertbistand i højere grad anvendes. Det gælder ikkemindst i forhold til nye og komplekse forskningsområder.
7.3. Ny opgavefordeling og klar opgaveportefølje7.3.1. Klar afgrænsning af komitésystemets opgaveområde
Udvalget anbefaler:17. Definitionen af hvilke projekter, der skal anmeldes, ændres fra biomedicin til sundhedsvidenskab.18. Komiteerne skal vurdere, om et projekt tilvejebringer ny viden eller undersøger eksisterende viden,som kan berettige forsøgets gennemførelse.19. Anonymt, biologisk materiale undtages anmeldelsespligten.20. Den nuværende regulering i forhold til biobanker fastholdes.
98
Anbefaling 17: Definitionen af hvilke projekter, der skal anmeldes, ændres fra biomedicin til sundhedsvidenskabUdvalget har på baggrund af overvejelserne i kapitel 6 vurderet, at der er behov for en præcisering af definitionenaf hvilke forskningsprojekter, der skal anmeldes.I dag skal biomedicinske forskningsprojekter anmeldes. Et biomedicinsk forskningsprojekt er i komitéloven define-ret som et projekt, der indebærer forsøg på levendefødte menneskelige individer, menneskelige kønsceller, deragtes anvendt til befrugtning, menneskelige befrugtede æg, fosteranlæg og fostre, væv, celler og arvebestandde-le fra mennesker, fostre og lignende samt afdøde. Endvidere omfattes forsøg, der har til formål at afdække ellerefterprøve de kliniske, farmakologiske eller andre farmakodynamiske virkninger, at identificere bivirkninger eller atundersøge farmakokinetik (optagelse, fordeling, nedbrydning eller udskillelse) med det formål at få viden om læ-gemidlers sikkerhed eller virkning.Det er udvalgets opfattelse, at begrebet sundhedsvidenskab er et mere hensigtsmæssigt begreb end biomedicin.Sundhedsvidenskab omfatter såvel behandling, undersøgelse, forebyggelse som rehabilitering og vil derfor kunneindfange, at der indenfor alle typer af sundhedsvidenskabelig forskning udføres forsøg, som kan indeholde rele-vante videnskabsetiske aspekter.Udvalget anerkender, at anvendelsen af begrebet sundhedsvidenskab potentielt kan medføre en udvidelse afhvilke sager, der er anmeldelsespligtige til komitésystemet. Derfor foreslår udvalget, at anmeldelsespligtig forsk-ning afgrænses som sundhedsvidenskabelig interventionsforskning. Herved synliggøres det, at der i de anmel-delsespligtige forsøg skal indgå en forsøgsperson (eller materiale af en sådan), der udsættes for en intervention,som i langt de fleste tilfælde vil dreje sig om behandling, undersøgelse eller et forebyggende indgreb.Det bemærkes, at ovenstående afgrænsning således fortsat vil være i overensstemmelse med afgrænsningen iden nugældende komitélov, hvorefter et anmeldelsespligtig sundhedsvidenskabeligt forskningsprojekt skal inde-bære forsøg på levendefødte menneskelige individer, menneskelige kønsceller, der agtes anvendt til befrugtning,menneskelige befrugtede æg, fosteranlæg og fostre, væv, celler og arvebestanddele fra mennesker, fostre og lig-nende samt afdøde.Den konkrete vurdering af, hvorvidt et projekt er anmeldelsespligtigt varetages naturligvis af komiteerne. Komite-ernes praksis vil således også medvirke til klarlægge, hvilke projekter der er anmeldelsespligtige.Udvalget har i forbindelse med ovenstående betragtninger lagt vægt på beskyttelse af forsøgspersonens rettighe-der, sikkerhed og integritet. Det vil derfor ikke være hensigtsmæssig at lade selve den videnskabelige metodeindgå som et kriterium for, hvorvidt et projekt er anmeldelsespligtigt. Et sådant kriterium kan indebærer, at projek-ter vil blive afskåret fra behandling i komitésystemet af metodiske/videnskabelige grunde. Dette vil medføre, atforskere lovligt kan iværksætte forsøg uden en godkendelse fra komitésystemet.Anbefaling 18: Komiteerne skal vurdere, om et projekt tilvejebringer ny viden eller undersøger eksisterende viden,som kan berettige forsøgets gennemførelseUdgangspunktet for komiteernes virke i dag er, at biomedicinske forskningsprojekter skal gennemføres vi-denskabsetisk forsvarligt, og at forsøgspersoner, der deltager i sådanne projekter, beskyttes med hensyn til ret-tigheder, sikkerhed og velfærd, samtidig med at der skabes mulighed for udvikling af ny, værdifuld viden.Komiteerne skal således tage stilling til, om et projekt kan bidrage til udvikling af ny, værdifuld viden, jf. komitélo-vens § 12, stk. 1, nr. 3. Det er efter udvalgets opfattelse vanskeligt, og det kan give anledning til tvivl i vurderingenaf forskningsprojekter. Det bør derfor præciseres hvilke hensyn, komiteerne skal lægge til grund i forbindelse medafvejningen.
99
Det er udvalgets opfattelse, at komiteerne fremover bør påse, at et projekt tilvejebringer ny viden eller undersøgereksisterende viden, som kan berettige forsøgets gennemførelse. Dette skal fortolkes i overensstemmelse medprincipperne for god videnskabelig praksis.Formuleringen vil efter udvalgets opfattelse sikre, at forsøgspersonerne ikke udsættes for unødvendige eller uri-melige indgreb samtidig med, at det sikres, at projekterne har den ønskelige videnskabelige kvalitet, således atprojekterne efter deres formål og metodik opfylder de grundlæggende krav til god videnskabelig standard. Detbemærkes desuden, at formuleringen om, at et projekt tilvejebringer ny viden eller undersøger eksisterende vi-den, som kan berettige forsøgets gennemførelse, implicit inkluderer en vurdering af, om forskningsprojektets for-ventede resultater kan være værdifulde.Udvalget anbefaler desuden, at der i forsøgsprotokollerne fyldigt redegøres for den foreliggende, relevante littera-tur på forskningsfeltet med henblik på, at komiteen kan foretage en kvalificeret vurdering af projektet.Herudover har udvalget diskuteret, i hvilket omfang de videnskabsetiske komiteer bedømmer forskningskvaliteteni de anmeldte projekter, og hvilke faktorer der lægges vægt på i forbindelse med vurderingen (bl.a. designet afforsøget, eller om det er muligt at opnå værdigfulde forskningsresultater). Udvalget har i den forbindelse overve-jet, hvor stor vægt der eventuelt kan lægges på vurderinger fra andre myndigheder, fx vurderinger fra forsknings-rådene eller fra Lægemiddelstyrelsen, i de situationer, hvor det måtte være relevant. Det er udvalgets opfattelse,at det ikke synes hensigtsmæssigt at lade forskningsfaglige vurderinger foretaget i regi af forskningsrådssystemeteller Lægemiddelstyrelsen genbruge i det videnskabsetiske komitésystem.Udvalget vil gerne understrege, at det videnskabsetiske komitésystems opgave er at godkende forskningsprojek-ter, men det endelig ansvar for, at forsøget udføres videnskabsetisk forsvarligt, er forankret hos den forsøgsan-svarlige – uanset om projektet er anmeldelsespligtigt eller ej.Anbefaling 19: Anonymt, biologisk materiale undtages anmeldelsespligtenUdvalget har overvejet, om anonymt, biologisk materiale, eventuelt afgrænset til specifikke dele såsom celler, cel-lelinjer, cellebestanddele fx celleekstrakter, cellehomogenater, proteiner, DNA, RNA, vævssnit, blod, plasma, se-rum, spyt, spinalvæske, synovialvæske eller urin bør undtages fra anmeldelsespligten.Det har i den forbindelse været anført, at beskyttelsesinteressen af forsøgspersonerne i situationer, hvor der ertale om fuldstændig anonymiseret materiale, kan vurderes som værende mindre væsentlig, da der ikke direkte eren person at beskytte. Omvendt kan anføres, at uanset om materialet er personhenførbart, bør det videnskabse-tiske komitésystem varetage hensynene til, at forsøgene udføres videnskabsetisk forsvarligt. Udvalget har desu-den også taget forskningens vilkår i betragtning, da dette også må indgå i afvejningen af, hvor mange forsknings-projekter der skal anmeldes – særligt henset til at der ses en stigende tendens til handel på tværs af landegræn-ser med anonymt, biologisk materiale. Endvidere har hensynet til, at komitésystemet fortsat kan fungere effektivtmed mulighed for at prioritere ressourcer og fokusere på de udfordrende områder, også været inddraget i udval-gets overvejelser.På den baggrund anbefaler udvalget, at anonymt, biologisk materiale – der på ingen måde er personhenførbart(ingen identifikationskode til data) – ikke bør være anmeldelsespligtigt, såfremt materialet er indsamlet i overens-stemmelse med national ret. Da der er tale om fuldstændig anonymt materiale, er det ikke muligt for forskerne atkontakte donorerne med henblik på at indhente et informeret samtykke.
100
Udvalget finder dog, at forskningsprojekter, som reguleres i befrugtningslovens § 25, fortsat skal være anmeldel-sespligtigeuansetanonymitet.19Udvalget vil i forbindelse med ovenstående anbefaling gerne understrege, at forskerne har en forpligtelse til atsikre, at forsøget – uanset om der må foreligge en anmeldelsespligt – udføres videnskabsetiske forsvarligt, her-under at materialet er indsamlet på etisk forsvarlig vis. Udvalget vil desuden gerne opfordre til, at forskere og re-levante faglige organisationer fremadrettet fokuserer på ovennævnte problemstilling vedrørende selve indsamlin-gen af det biologiske materiale.Det er den forsøgsansvarliges pligt at sikre, at materiale er indsamlet i overensstemmelse med national ret. Dettekan fx ske ved, at den virksomhed, som den forsøgsansvarlige køber materialet af, oplyser, at materialet er ind-samlet i overensstemmelse med national ret. Dette kan også iagttage hensynet til personen, som har doneret ma-terialet anonymt. Udvalget har i forbindelse med ovenstående lagt vægt på, at komitésystemet således ikke vilblive belastet af en stor andel projekter, hvor forskerne reelt ikke har mulighed for at opnå et informeret samtykkefra donor. Udvalget anerkender i den forbindelse, at globaliseringen og den stigende tendens til handel med ano-nymt, biologisk materiale præger det danske forskningsmiljø, og at forskning i Danmark bør have forhold, som gørdansk forskning konkurrencedygtigt – uden at tilsidesætte de fundamentale hensyn til forsøgspersonernes integri-tet og velfærd.I forbindelse med anbefalingen om at undtage anonymt, biologisk materiale fra anmeldelsespligten ønsker udval-get at påpege, at det ikke er muligt at anonymisere og overdrage væv til forskning, hvis den person, som har afgi-vet vævet, er registreret i vævsanvendelsesregisteret. Det bemærkes i øvrigt, at den sundhedsperson, der er an-svarlig for opbevaring af biologisk materiale, i medfør af sundhedslovens § 29 er forpligtet til at søge oplysninger ivævsanvendelsesregisteret, hvis det opbevarede biologiske materiale ønskes anvendt til andet end behandling afpatienten og formål, der har en umiddelbar tilknytning hertil.For så vidt angår materiale, som ikke er anonymt, er det udvalgets opfattelse, at dette fortsat bør anmeldes tilkomitésystemet. Dog bør cellelinjer og lignende, der stammer fra et forsøg med indsamling af celler eller væv,fortsat ikke anmeldes, jf. komitélovens § 8, stk. 4. Udvalget henholder sig i den forbindelse til lovbemærkningernefra 2002, hvoraf det fremgår, at forsøg på cellelinjer ikke skal anmeldes til komitésystemet, idet en sådan anmel-delsespligt fører til en unødig belastning af komitésystemet med deraf følgende risiko for manglende fokus på ogressourcer til de reelle videnskabelige problemstillinger. Hensynet til forsøgspersonen er tilgodeset, idet det læg-ges til grund, at personen har afgivet informeret samtykke til det oprindelige forsøg om indsamling af væv og cel-ler og de deraf afledte forsøg. Det vil sige, at hvis en cellelinje oprindeligt er erhvervet gennem en blod- ellervævsprøve som led i et forsøg, der er godkendt af en videnskabsetisk komité, og hvor forsøgspersonen har afgi-vet informeret samtykke, skal der ikke foretage anmeldelse af hvert enkelt forsøg, der siden hen udføres meddenne cellelinje, da forsøgspersonen i sit oprindelige samtykke har accepteret, at cellelinjen må indgå i forsøg.Udvalget anbefaler samtidig, at den nationale komité følger forskningsudviklingen tæt og i samarbejde med DetEtiske Råd, således at den nationale komité, såfremt der måtte opstå uforudsete problemstillinger i forhold til an-
19
Det fremgår af lov om kunstig befrugtning, at biomedicinske på befrugtede menneskelige æg samt på kønsceller, der agtes anvendt til befrugt-
ning, må kun foretages i følgende tilfælde: 1) Hvis de har til formål at forbedre in vitro-befrugtning eller lignende teknikker med henblik på at frem-kalde en graviditet. 2) Hvis de har til formål at forbedre teknikker til genetisk undersøgelse af et befrugtet æg med henblik på at fastslå, om derforeligger en alvorlig arvelig sygdom eller en væsentlig kromosomabnormitet (præimplantationsdiagnostik). 3) Hvis forsøgene ved anvendelse afbefrugtede æg og stamceller herfra har til formål at opnå ny viden, som vil kunne forbedre mulighederne for behandling af sygdomme hos menne-sker. Udtagning og befrugtning af æg med henblik på at gennemføre andre forsøg end de ovenfornævnte er ikke tilladt.
101
vendelse af anonymt, biologisk materiale, kan gøre opmærksom på dette. Udvalget anbefaler desuden, at dennationale komité efter en årrække, fx 5 år, evaluerer konsekvenserne af denne ændring.Anbefaling 20: Den nuværende regulering i forhold til biobanker fastholdesUdvalget har overvejet, hvorvidt der er behov for ændringer i reguleringen på biobanksområdet. Et flertal af ud-valgets medlemmer er af den opfattelse, at der ikke er behov for dette, idet afgrænsningen mellem området fordet videnskabsetiske komitésystem og Datatilsynet er klarlagt.Udvalget konstaterer, at komitéloven regulerer biomedicinske forskningsprojekter, dvs. konkrete forskningsprojek-ter på mennesker eller menneskeligt biologisk materiale, hvorimod komitésystemet ikke har kompetence til at be-handle andre spørgsmål indenfor forskningsverdenen.Det betyder, at udtagelse og anvendelse af menneskeligt væv m.v. til brug for et aktuelt, konkret biomedicinskforskningsprojekt skal vurderes af komitésystemet efter reglerne i komitéloven. En forskningsbiobank i komitésy-stemet skal således forstås som en biobank, der er en integreret del af et konkret biomedicinsk forskningsprojekt,jf. Indenrigs- og Sundhedsministeriets cirkulære af 13. juni 2005.Det følger af komitéloven, at komiteen kun kan meddele tilladelse til et forskningsprojekt, hvis forsøgspersonenafgiver informeret samtykke, når personens væv i forbindelse med et konkret forskningsprojekt udtages med hen-blik på opbevaring i en forskningsbiobank.Biobanker etableret med henblik på eventuel fremtidig forskning – biobanker uden for et konkret forskningsprojekt– skal derimod ikke godkendes af komitésystemet, da det indsamlede biologiske materiale ikke umiddelbart gørestil genstand for forskning. Sådanne biobanker med fremtidig forskning for øje skal udelukkende anmeldes til Data-tilsynet, jf. ovenstående. Det bemærkes, at selve udtagelsen (mængde, procedure mv.) af det biologiske materia-le er underlagt de sædvanlige krav om udvisning af omhu og samvittighed (autorisationslovens § 17), ligesomvævslovens regler skal iagttages.Det bør desuden nævnes, at et biomedicinsk forskningsprojekt, hvori der indgår biologisk materiale fra en tidligereetableret biobank (registerforskning, jf. komitélovens § 8, stk. 3), skal anmeldes til og godkendes af komitésyste-met som alle andre biomedicinske forskningsprojekter. Det biologiske materiale bliver jo i så fald anvendt til kon-kret forskning og udgør en forskningsbiobank i komitélovens forstand.7.3.2. Ændret arbejdsdeling mellem den nationale komité og de regionale komiteer
Udvalget anbefaler:21. Den nationale komité skal behandle sager på særligt komplekse områder.22. Den nationale komité skal være mere proaktiv i forhold til at følge udviklingen på sundhedsområdetog det videnskabsetiske område.
Anbefaling 21: Den nationale komité skal behandle sager på særligt komplekse områderUdvalget er enigt om, at visse sagstyper er så komplekse, at der med fordel skal fastlægges en praksis nationalt.Det vil desuden sikre kvalitet og større ensartethed i sagsbehandlingen. Det er udvalgets opfattelse, at når enpraksis er fastlagt, kan sagerne herefter behandles regionalt. Udvalget anbefaler, at ministeren bemyndiges til atfastlægge, hvilke typer af sager der bør førstebehandles af den nationale komité, således at der kan tages højdefor de nye forskningsområder, som løbende opstår.
102
Det kan dreje sig om forskningsprojekter:•••Hvor den sundhedsfaglige og/eller etiske kompleksitet stiller særlige krav til ekspertisemæssig dybde ogbredde i komiteen, fx lægemidler til avanceret terapi.Forsøg, hvor hensynet til beskyttelse af forsøgspersoner stiller særlige krav til den juridiske ekspertise,og sundhedsfaglige/forskningsfaglige afvejning.Principielle nye forskningsområder.
I forbindelse med ovenstående har der været enighed om, at såfremt visse sager skal førstebehandles af den na-tionale komité, så bør systemet indrettes fleksibelt med henblik på, at sagstyperne over tid kan føres tilbage til deregionale komiteer. Det vil således være muligt at tilbageføre områderne, når de ikke længere er nye og/ellerkomplicerede. Udvalget har bl.a. drøftet, at ti sager eller behandling over en 5-årig periode må være tilstrækkeligttil at fastlægge praksis på området. Udvalget anbefaler også, at den nationale komité orienterer de regionale ko-miteer om afgørelserne ved at fremsende kopi af afgørelserne, så der sikres læring og videndeling i komitésyste-met.Udvalget har drøftet, hvorvidt der bør være mulighed for at indbringe afgørelser fra den nationale komité for enanden instans. Udvalget er enigt om, at selve det videnskabsetiske skøn og den faglige vurdering, som den nati-onale komité vil foretage i forbindelse med behandlingen af en konkret sag, alene skal varetages af den nationalekomité. For så vidt angår klager vedrørende selve sagsbehandlingen af ansøgningen og retlige forhold i forbin-delse hermed finder udvalget, at sådanne klager bør kunne påklages til Indenrigs- og Sundhedsministeriet.Anbefaling 22: Den nationale komité skal være mere proaktiv i forhold til at følge udviklingen på sundhedsområ-det og det videnskabsetiske områdeUdvalgets ovenstående anbefalinger bør også ses i tæt tilknytning til den eksisterende § 24, nr. 2, i komitéloven,hvorefter CVK skal følge forskningsudviklingen på sundhedsområdet. Udvalget er enigt om, at den nationale ko-mité fortsat skal forpligtes til løbende at følge udviklingen på området. Dette kan bl.a. danne grundlag for den na-tionale komités indstilling til ministeren vedrørende behandling af nye sagsområder i den nationale komité.CVK gør allerede i dag en væsentlig indsats for at følge udviklingen på området. Udvalget finder det vigtigt, at dennationale komité fortsat følger og styrker deres fokus på den internationale forskningsudvikling på sundhedsom-rådet og det videnskabsetiske område. Udvalget anbefaler, at den nationale komité øger indsatsen i forhold til atbidrage til den internationale erfaringsudveksling og udvikling. Dette kan efter udvalgets opfattelse styrke og ud-vikle det samlede komitésystem i Danmark. Udvalget ser således gerne, at den nationale komité følger den inter-nationale udvikling tæt og tager initiativ til at indarbejde internationale tendenser i det danske videnskabsetiskekomitésystem.7.3.3. Mulighed for fleksibel arbejdsdeling mellem de regionale komiteer
Udvalget anbefaler:23. Anmeldelse sker regionalt – med mulighed for at regionerne kan fordele sagerne imellem sig.
Anbefaling 23: Anmeldelse sker regionalt – med mulighed for at regionerne kan fordele sagerne imellem sigI forhold til arbejdsdelingen mellem de regionale komiteer er udvalget enigt om at fastholde den nuværende mo-del, således at den forsøgsansvarlige skal anmelde forskningsprojektet til den regionale komité for det område,hvor den forsøgsansvarlige har sit virke.
103
Udvalget vil dog foreslå, at lovgivningen indrettes så rummeligt, at regionerne kan fordele sagerne mellem sig,hvis en regions sagsmængde bliver for omfattende, og en anden region samtidig har kapacitet til et behandle fleresager. Spørgsmålet om økonomisk kompensation i forbindelse hermed må afklares mellem regionerne.Set i lyset af at de regionale komiteer i dag har en meget varierende sagsmængde anbefaler udvalget samtidig, atden nuværende mulighed i komitélovens § 2, om at en komité kan nedsættes af flere regionsråd, bringes i anven-delse. Dette ud fra såvel faglige som ressourcemæssige betragtninger.7.3.4. Aktivt samarbejde og koordinering med relevante myndigheder og aktører
Udvalget anbefaler:24. Komitésystemet skal aktivt samarbejde og koordinere med relevante myndigheder og aktører.
Anbefaling 24: Komitésystemet skal aktivt samarbejde og koordinere med relevante myndigheder og aktørerUdvalget anbefaler, at komitésystemet aktivt samarbejder og koordinerer med relevante myndigheder og aktører,herunder Lægemiddelstyrelsen, Datatilsynet, forskningsrådene og Det Etiske Råd.•Lægemiddelstyrelsen.Det er efter udvalgets opfattelse meget vigtigt, at der samarbejdes tæt mellemLægemiddelstyrelsen, de regionale komiteer og den nationale komité. For så vidt angår selve vurderin-gen af den forskningsmæssige kvalitet er det udvalgets opfattelse, at det ikke synes hensigtsmæssigt atlade forskningsfaglige vurderinger foretaget i Lægemiddelstyrelsen genbruge i regi af det videnskabse-tiske komitésystem. De to systemer sigter mod at iagttage forskellige hensyn. Lægemiddelstyrelsen vur-derer således, om en ansøgning overholder de lovgivningsmæssige krav på området for lægemidler ogmedicinsk udstyr, mens komitésystemet vurderer de videnskabsetiske aspekter af et forskningsprojekt.•Datatilsynet.Udvalget konstaterer, at Datatilsynet på en række områder fører tilsyn med biomedicinskforskning. Udvalget konstaterer desuden, at der ikke er behov for ændringer i forhold til snitfladerne mel-lem det videnskabsetiske komitésystem og Datatilsynet, jf. afsnit 7.3.1.•Forskningsrådene.Udvalget har på flere områder ladet sig inspirere af forskningsrådenes arbejde, ogdet er efter udvalgets opfattelse vigtigt at sikre sammenhæng mellem de videnskabelige og videnskab-setiske tendenser, som måtte komme til udtryk i begge systemer. Bl.a. derfor har udvalget anbefalet, atto medlemmer udpeges til den nationale komité efter samlet indstilling fra bestyrelserne for de to forsk-ningsråd (Det Strategiske Forskningsråd og Det Frie Forskningsråd).For så vidt angår selve vurderingen af den forskningsmæssige kvalitet er det udvalgets opfattelse, at detikke synes hensigtsmæssigt at lade forskningsfaglige vurderinger foretaget i regi af forskningsrådssy-stemet genbruge i regi af det videnskabsetiske komitésystem. De to systemer sigter mod at iagttage for-skellige hensyn. Forskningsrådssystemet fokuserer primært på forskningskvaliteten, mens komitésyste-met også iagttager den videnskabsetiske dimension. Hertil kommer, at organerne i forskningsrådssy-stemet som udgangspunkt ikke udarbejder skriftlig dokumentation for deres forskningsfaglige bedøm-melser.•Det Etiske Råd.Udvalget har overvejet, hvorvidt det udtrykkelige samarbejde, som fremgår af komitélo-vens § 5, stk. 2, med Det Etiske Råd er nødvendigt. Udvalget lægger vægt på, at den nationale komité
104
skal følge forskningsudviklingen på sundhedsområdet og virke for forståelse af de etiske problemstillin-ger, udviklingen kan medføre, i forhold til sundhedsvæsenet og de sundhedsvidenskabelige forsknings-miljøer. Dette kræver efter udvalgets opfattelse naturligt et samarbejde med Det Etiske Råd. Et sådansamarbejde bør have frie rammer til at planlægge møder og initiativer, som kan styrke kendskabet til deetiske udfordringer som både komitésystemet og Det Etiske Råd behandler. Udvalget bemærker, at ko-mitésystemet i dag samarbejder med bl.a. Lægemiddelstyrelsen uden, at dette er fastsat i loven. Det erderfor udvalgets opfattelse, at samarbejdsbestemmelsen i komitéloven er unødvendig, hvorfor bestem-melsen bør ophæves.7.3.5. Fokus på kvalitetsudvikling, opfølgning og kontrolSom det fremgår af afsnit 6.3.5, fører de regionale komiteer i dag kun i begrænset og meget varierende omfangtilsyn med, at de godkendte forskningsprojekter udføres i overensstemmelse med de meddelte tilladelser, uagtetat dette er en lovfæstet opgave for regionerne.Det er udvalgets opfattelse, at opfølgning og kontrol i forhold til godkendte forskningsprojekter er en vigtig del afkomitésystemets arbejde. Formålet er at bidrage til at sikre, at forsøgspersonerne kan føle sig trygge ved, at derikke sker overgreb på deres integritet. Det er ligeledes udvalgets vurdering, at kontrol og kvalitetsudvikling hæn-ger tæt sammen. Det handler ikke kun om at påpege eventuelle fejl og mangler, men i høj grad også om at ud-drage den fremadrettede læring og sikre den nødvendige videnspredning. I den forbindelse er det meget relevantat inddrage forsøgspersonerne og deres erfaringer og oplevelser. Det er udvalgets vurdering, at et bredere fokuspå kvalitetsudvikling kan bidrage til et mere positivt syn på arbejdet med opfølgning og kontrol.
Figur 7: Kvalitetsudvikling, læring og kontrol
Godkendelse→Opfølgning og kontrol→Konsekvens
Helt overordnet opfatter udvalget kontrolfunktionen som en logisk konsekvens af komitésystemets kompetence tilat godkende forskningsprojekter. Det er samtidig udvalgets overordnede vurdering, at den kontrol, som komitésy-stemet udfører, skal kunne have konsekvens og fremadrettet bidrage til læring og kvalitetsudvikling – dels i forsk-ningen, dels i komitésystemet, jf. ovenstående figur 7.Udvalget anbefaler:25. En målrettet og gradueret opfølgning og kontrol baseret på en samlet vurdering af forsøgsprojekter-ne.26. Komitésystemet skal have de nødvendige lovgivningsmæssige kompetencer til at løfte kontrolopga-ven.27. Fokus på kvalitetsudvikling og læring, herunder inddragelse af forsøgspersoner.
105
Anbefaling 25: En målrettet og gradueret opfølgning og kontrol baseret på en samlet vurdering af forsøgsprojek-terneUdvalget har overvejet forskellige måder, hvorpå komitésystemets arbejde med opfølgning og kontrol kan organi-seres, herunder hvilke kriterier der skal lægges til grund for valg af forsøgsprojekter, der skal udtages til kontrol.Det er udvalgets vurdering, at der skal være tale om en målrettet og effektiv opfølgning og kontrol, som matcherde udfordringer, såvel komitésystemet som forskningsverdenen står overfor. Ressourcerne skal målrettes forsøg,som ud fra en betragtning af forsøgspersonernes interesser kunne have særlig relevans. På den baggrund anbe-faler udvalget, at kontrollen målrettes og gradueres med udgangspunkt i en vurdering og kategorisering af for-søgsprojekterne. Denne vurdering kan baseres på flere kriterier, fx innovativt forsøgsdesign, kompleksitet, særli-ge krav til informationens omfang og dybde samt hvor stor risiko forsøgspersonerne udsættes for. De forsøg, somindebærer den største risiko, er mest kompliceret m.v., udsættes for den tætteste opfølgning og kontrol.I forhold til de forsøg, som set fra forsøgspersonens perspektiv, er mere harmløse eller mindre komplekse, anbe-faler udvalget, at kontrollen baseres på standardiseret skemaindberetning og/eller egenkontrol på forsøgsstedet,fx kombineret med at komitésystemet beder om en tilbagemelding fra den forsøgsansvarlige om, at forsøget erforegået i overensstemmelse med den givne tilladelse. En sådan tilbagemelding bør også omfatte en kort redegø-relse for, hvorvidt der er sket publicering som planlagt, og en tilkendegivelse af, om såvel negative som positiveforskningsresultater er offentliggjort så hurtigt, som det er muligt og fagligt forsvarligt.Det er udvalgets vurdering, at stillingtagen til kontrol hænger naturligt sammen med forsøgets godkendelse. Alle-rede i forbindelse med forsøgets godkendelse bør der således foretages en samlet vurdering af forsøget og påden baggrund tages stilling til kontrollens omfang.Det er ligeledes udvalgets anbefaling, at kontrolopgaven forankres i den komité, som har godkendt det pågæl-dende forsøg, dvs. i den relevante regionale komité for de forsøg, som behandles regionalt, og i den nationalekomité for de forsøg, som behandles centralt. For så vidt angår projekter, der godkendes af den nationale komitésom led i en klagebehandling, skal kontrollen som hidtil finde sted regionalt. Det er i den forbindelse vigtigt at un-derstrege, at komiteerne har mulighed for at inddrage andre i kontrolopgaven, fx kan tidligere komitémedlemmermed fordel inddrages i den konkrete tilsynsarbejde.Det er samtidig vigtigt for udvalget, at der bliver tale om en standardiseret opfølgning og kontrol. På den baggrundanbefaler udvalget, at den nationale komité udarbejder vejledninger på området, fx i forhold til den kategoriseringaf forsøgene, som skal ligge til grund for stillingtagen til kontrollens omfang og intensitet.Som tidligere fremhævet, har udvalget fokuseret på, at der sker den nødvendige koordinering de relevante myn-digheder imellem. Det gælder også i forhold til opfølgning og kontrol. Udvalget mener fortsat, at Lægemiddelsty-relsen skal varetage kontrollen i forhold til kliniske lægemiddelforsøg, men i de tilfælde hvor det vurderes relevant,fx hvis der er særlige etiske aspekter, bør repræsentanter fra komitésystemet deltage i Lægemiddelstyrelsenskontrol efter anmodning fra Lægemiddelstyrelsen. Samtidig skal de regionale komiteer i fremtiden aktivt benyttesig af muligheden for at gøre Lægemiddelstyrelsen bekendt med de lægemiddelforsøg, man ønsker inspiceret.Anbefaling 26: Komitésystemet skal have de nødvendige lovgivningsmæssige kompetencer til at løfte kontrolop-gavenDet er udvalgets vurdering, at en effektiv opfølgning og kontrol skal kunne have konsekvens, samt at komitésy-stemet skal have de nødvendige redskaber til smidigt og effektivt at løfte kontrolopgaven. Udvalget har derfordrøftet behovet for at give komitésystemet yderligere lovgivningsmæssige beføjelser og selvstændige sanktions-muligheder.
106
På den baggrund anbefaler udvalget, at:•••Der indføres en særskilt hjemmel i komitéloven til, at komitésystemet får adgang til relevante dele af pa-tientjournalen i forbindelse med gennemførelse af kontrol.Repræsentanter fra komitésystemet får ret til uden forudgående retskendelse at foretage kontrol på virk-somheder, sygehuse m.v. parallelt med Lægemiddelstyrelsen.Komitésystemet får hjemmel til at stoppe et forsøgsprojekt eller eventuelt udstede påbud parallelt medLægemiddelstyrelsen.Det er dog samtidig udvalgets vurdering, at komitésystemet kun i helt særlige og meget sjældne tilfælde vil havebehov for at gøre brug af de sidste to redskaber.Anbefaling 27: Fokus på kvalitetsudvikling og læring, herunder inddragelse af forsøgspersoner,Som nævnt ovenfor er formålet med komitésystemets opfølgning og kontrol først og fremmest at sikre, at patien-terne kan føle sig trygge ved at deltage i sundhedsvidenskabelige forsøg og ikke udsættes for overgreb på deresintegritet. På den baggrund er det også udvalgets anbefaling, at kontrollen skal fokusere på forsøgenes etiskeaspekter og ikke de videnskabelige aspekter.Det er samtidig udvalgets opfattelse, at der skal være et fremadrettet fokus på kvalitetssikring og kvalitetsudvik-ling i forlængelse af arbejdet med opfølgning og kontrol. Det er ikke tilstrækkeligt alene at påpege eventuelle fejlog mangler. Kontrollen skal føre til læring og dermed til kvalitetsudvikling - dels af hensyn til forsøgspersonerne,dels af hensyn til kvaliteten i forskningen.Arbejdet med at sikre læring og kvalitetsudvikling skal være en integreret del af komiteernes arbejde med opfølg-ning og kontrol, men er i høj grad også en opgave for en ny og stærkere national videnskabsetisk komité. Et vig-tigt element i den sammenhæng er en højere grad af inddragelse af forsøgspersonerne og deres oplevelser ogerfaringer med at deltage i forsøg. Det er udvalgets vurdering, at der her ligger et uudnyttet potentiale, som kanbidrage med relevant viden. Både i forhold til hvordan arbejdet med opfølgning og kontrol bedst målrettes, menogså i forhold til fremadrettet at øge kvaliteten i forskningen. På den baggrund anbefaler udvalget, at den nationa-le komité iværksætter en undersøgelse af forsøgspersonernes oplevelse af at deltage i forskningsprojekter.Udvalgets anbefalinger vedr. kvalitetsudvikling og kvalitetssikring i forhold til selve komitésystemet fremgår af an-befaling 31-33.
7.4. Forbedring af muligheder for at forske i akutte situationerUdvalget anbefaler:28. Der skal arbejdes for at øge mulighederne for forskning i akutte situationer – under iagttagelse af for-søgspersoners rettigheder, sikkerhed og velbefindende.
Anbefaling 28: Der skal arbejdes for at øge mulighederne for forskning i akutte situationer – under iagttagelse afforsøgspersoners rettigheder, sikkerhed og velbefindendeUdvalget har overvejet de særlige problemstillinger, der er på området for forskning i akutte situationer – også seti sammenhæng med lovens § 1, stk. 3, om at hensynet til forsøgspersonens rettigheder, sikkerhed og velbefin-dende går forud for videnskabelige og samfundsmæssige interesser.
107
Udvalget lægger vægt på, at frivillighed skal være det altovervejende udgangspunkt i forbindelse med forskning iDanmark. Udvalget anerkender samtidig, at der er væsentlige hindringer på området for forskning i akutte situati-oner i Danmark, hvilket udvalget finder er et problem i forhold til at sikre den nødvendige forskning på området tilgavn for behandling af patienter. Udvalget bemærker i den forbindelse, at der generelt i sundhedsvæsenet arbej-des for at styrke akutbetjeningen, hvilket understreger betydningen af, at der sikres evidens for behandlingen iakutte situationer.Udvalget opfordrer til, at reglerne om forskning i akutte situationer revideres af lovgiver, så mulighederne for atforske i akutte situationer øges under nøje iagttagelse af forsøgspersonernes rettigheder, sikkerhed og integritet.Det kunne bl.a. overvejes, om komiteerne skal forpligtes til at nedsætte underudvalg, ad hoc grupper eller inddra-ge særlig ekspertise, som kan sikre eksterne faglige vurderinger i forbindelse med behandling af disse typer afsager. Det kan også være relevant at overveje, om der i forbindelse med forskning i akutte situationer skal fast-sættes retningslinjer for løbende kontrol af forsøgets forløb, hvorved patientsikkerhed, eventuelle bivirkninger, fo-reløbige resultater etc. kan overvåges undervejs i projektet.Udvalget anbefaler derfor, at Danmark arbejder for en revision af det europæiske GCP-direktivs bestemmelserom forskning i akutte situationer med lægemidler med henblik på, at komitéloven senere kan ændres på dettepunkt, jf. afsnit 6.4.
7.5. Smidig sagsbehandling7.5.1. Effektive beslutningsprocedurer
Udvalget anbefaler:29. De regionale komiteer kan afgøre sager ved flertalsafgørelser.30. Der skal skabes mulighed for, at formandskabet i en komité kan træffe afgørelse i ukomplicerede ogrutineprægede sager.
Anbefaling 29: De regionale komiteer kan afgøre sager ved flertalsafgørelserDe regionale komiteer træffer i dag afgørelse ved enstemmighed. Det har været drøftet i udvalget, at dette ikkenødvendigvis er fremmende for diskussion og læring i komiteerne. Udvalget anbefaler derfor, at man fravigerprincippet om enstemmighed i de regionale komiteer, således at en sag fremadrettet kan godkendes ved kvalifi-ceret flertal, hvor:•••Der samlet set er flertal i komiteen.Der både er flertal blandt lægfolk og fagfolk.Både formanden og næstformanden er en del af flertallet.
Det er udvalgets opfattelse, at det vil bidrage til en mere effektiv beslutningsstruktur, samtidig med at der fortsater mulighed for en bred drøftelse af problemstillingerne.
108
Anbefaling 30: Der skal skabes mulighed for, at formandskabet i en komité kan træffe afgørelser i ukompliceredeog rutineprægede sagerDet er udvalgets opfattelse, at der bør være mulighed for, at formandskabet, dvs. formand og næstformand, selv-stændigt kan træffe afgørelse i ukomplicerede og rutineprægede sager, bl.a. i forbindelse af behandling af til-lægsprotokoller og ukomplicerede hovedprotokoller. Dette kan efter udvalgets opfattelse skabe et mere fleksibeltog effektivt komitésystem, hvor ressourcerne kan fokuseres på de mere udfordrende ansøgninger.Udvalget ønsker i den forbindelse at understrege, at den pågældende komité skal orienteres om afgørelser truffetaf formandskabet.7.5.2. Større ensartethed og gennemsigtighedSom det fremgår af analysen i kapitel 6, har udvalget fokuseret på mulighederne for at skabe større ensartethed ibehandlingen af forskningsprojekter i det videnskabsetiske komitésystem. En række af udvalgets anbefalingerunderstøtter dette. Det gælder fx anbefaling 22 om, at den nationale komité skal være førstebehandler på nyesagsområder.Herudover anbefaler udvalget nedenstående tiltag for at sikre ensartethed og gennemsigtighed i komitésystemet.
Udvalget anbefaler:31. Den nationale komité skal i større omfang udarbejde retningslinjer og indstille forslag til forskrifter tilindenrigs- og sundhedsministeren.32. Løbende kvalitetsudvikling og kvalitetssikring i forhold til komitésystemet - testsager, audits og styr-ket uddannelsesprogram.33. Samlet årsberetning for hele komitésystemet.
Anbefaling 31: Den nationale komité skal i større omfang udarbejde retningslinjer og indstille forslag til forskriftertil indenrigs- og sundhedsministeren.Enhver konkret afgørelse, som komiteerne træffer, indeholder skøn. Det skøn udøves indenfor de rammer, somlovgivningen udstikker.Udvalget anbefaler, at den nationale komité udarbejder retningslinjer for praksis på bestemte faglige områder forat understøtte komiteernes skøn. Dette vil kunne skabe større ensartethed i komiteernes vurdering af sager, sam-tidig med at komiteernes konkrete vurdering af et projekt opretholdes.Udvalget anbefaler også, at den nationale komité udarbejder vejledninger for sagsbehandlingen og arbejdsgangemv. i de regionale komiteer, jf. afsnit 7.3.2. Set fra et brugerperspektiv er det efter udvalgtes vurdering ikke hen-sigtsmæssigt, at sagsbehandlingsprocedurerne varierer. Det er udvalgtes opfattelse, at sagerne på tværs af deregionale komiteer er så ens, at det er relevant at have fælles sagsbehandlingsprocedurer. Udvalget understre-ger, at den nationale komités udarbejdelse af fælles sagsbehandlingsprocedurer bør ske i tæt dialog med de re-gionale komiteer.Udvalget anerkender, at det i visse situationer kan være behov for bindende administrative forskrifter. I sådannesituationer anbefaler udvalget, at den nationale komité udarbejder forslag og indstillinger til administrative forskrif-ter for komitésystemets virke til ministeriet, hvorefter indenrigs- og sundhedsministeren kan tage stilling hertil.Anbefaling 32: Løbende kvalitetsudvikling og kvalitetssikring i forhold til komitésystemet – testsager, audits ogstyrket uddannelsesprogram
109
Udvalget anbefaler, at der løbende arbejdes med kvalitetsudvikling, kvalitetssikring og læring i forhold komitésy-stemet, bl.a. med henblik på at sikre større ensartethed og gennemsigtighed i sagsbehandlingen til gavn for bådeforsøgspersoner og brugerne af systemet. Udvalget ser dette som en væsentlig opgave for en styrket nationalkomité, men vil gerne understrege, at arbejdet med kvalitetsudvikling og kvalitetssikring skal ske i et tæt samar-bejde mellem den nationale komité og de regionale komiteer. På den baggrund anbefaler udvalget:•Den nationale komité skal have mulighed for at gennemføre testsager.Udvalget anbefaler, at den natio-nale komité skal have mulighed for at gennemføre testsager, hvor alle regionale komiteer skal behandlesamme fiktive sag. Udvalget bemærker, at testsagerne skal anvendes i et læringsperspektiv og ikke medhenblik på kontrol. Det er endvidere vigtigt, at evaluering af testsagerne sker i fællesskab og i fuld åben-hed. Udvalget anerkender, at gennemførelse af testsager er ressourcekrævende. Derfor skal metodenkun anvendes i begrænset omfang, fx én gang årligt.•Den nationale komité skal have mulighed for at gennemføre audits.Udvalget anbefaler, at den nationalekomité får mulighed for at gennemføre audits på sager, der allerede er afgjort i de regionale komiteer.Som med testsagerne understreger udvalget, at forslaget skal anvendes i et læringsperspektiv og ikkemed henblik på kontrol. Derfor er det også vigtigt, at auditresultaterne gøres alment tilgængelige for allekomiteer, så der sikres videndeling.•Uddannelsesprogrammet for nye medlemmer skal styrkes.Udvalget anbefaler at udvide det eksisteren-de uddannelsesprogram for komitémedlemmerne. Udvidelsen skal sikre, at komitémedlemmernes kom-petencer inden for videnskabsetik, forvaltning og komitéloven styrkes. Det nye uddannelsesprogram børudarbejdes i samarbejde mellem de regionale komiteer og den nationale komité og under hensyntagentil forskellige uddannelsesbehov for lægmænd og fagfolk.Anbefaling 33: Samlet årsberetning for hele komitésystemetUdvalget anbefaler, at årsberetningerne, som i dag skal udarbejdes i regionerne og i CVK, erstattes af en fællesårsberetning for hele komitésystemet. Dette kan bl.a. være med til at skabe større sammenhæng og ensartethed ikomitésystemet, samtidig med at offentligheden holdes orienteret om komitésystemets arbejde. Den fælles årsbe-retning for hele komitésystemet skal både indeholde praksis på udvalgte områder og gennemgang af et antal sa-ger og desuden identificere udviklingstendenser, både nationalt og internationalt. Årsberetningen vil desudenskulle vedlægges en samlet liste med angivelse af anmeldte projekter opdelt i forhold til komiteerne.Årsberetningen skal offentliggøres på komiteernes hjemmesider og sendes til relevante aktører på det videnskab-setiske område, herunder regionsrådene, indenrigs- og sundhedsministeren, videnskabsministeren og Folketin-get.Udvalget vil i øvrigt gerne opfordre til, at komiteerne løbende offentliggør relevant materiale på deres hjemmesi-der.
110
7.5.3. Lettere anmeldelsesprocedurer og mindre bureaukratiUdvalget anbefaler:34. Kravet om dansksprogede protokoller skal fjernes.35. Sponsor og den forsøgsansvarlige skal sammen indsende ansøgning til den relevante komité.36. Alt ansøgningsmateriale skal kunne indsendes elektronisk, og der skal arbejdes for at harmonisereLægemiddelstyrelsens og komitésystemets ansøgningsskemaer.37. Ens krav til vurdering af, hvornår en ansøgning er behørigt udformet - hurtigere sagsbehandlingstid.38. Større mulighed for delegation fra den forsøgsansvarlige i forbindelse med underskrift på samtykke-erklæringer.39. Europæisk harmonisering vedr. indberetninger i forbindelse med lægemiddelforsøg – fortsat årligindsendelse af oversigt over alle alvorlige bivirkninger, men ophævelse af dansk krav om indberet-ning af hændelser.40. Informationsindsatsen over for forskerne skal styrkes ved tværgående initiativer.
Anbefaling 34: Kravet om dansksprogede protokoller skal fjernesUdvalget anbefaler, at kravet om dansksprogede protokoller fjernes under forudsætning af, at der indsendes enforsøgsprotokol på engelsk, samt at den forsøgsansvarlige udarbejder et retvisende og dækkende protokolresu-mé på dansk. Det vil således være den engelsksprogede protokol, som komiteen skal behandle.Udvalget erkender, at en forsøgsprotokol på engelsk kan være udfordrende at arbejde med for lægmedlemmerneaf komiteerne. Derfor er det vigtigt, at der udarbejdes et retvisende og dækkende protokolresume på dansk. Påden baggrund anbefaler udvalget, at der fastsættes formelle krav til protokolresuméets indhold.Udvalget forudsætter, at anbefalingen samlet set vil føre til en markant administrativ og ressourcemæssig lettelsefor ansøger – offentlige såvel som private i erhvervslivet.Anbefaling 35: Sponsor og den forsøgsansvarlige skal sammen indsende ansøgning til den relevante komitéUdvalget har overvejet, hvorvidt indsendelsen skal ske af andre eller flere end den forsøgsansvarlige. Det vil efterudvalgets opfattelse være hensigtsmæssigt, hvis både sponsor og den forsøgsansvarlige/investigator indsenderansøgningen i de tilfælde, hvor personerne ikke er sammenfaldende. I praksis betyder dette, at den forsøgsan-svarlige/investigator og sponsor i fællesskab indsender én ansøgning, der er underskrevet af begge parter.Anbefaling 36: Alt ansøgningsmateriale skal kunne indsendes elektronisk, og der skal arbejdes for at harmonisereLægemiddelstyrelsens og komitésystemets ansøgningsskemaerUdvalget anbefaler, at de forsøgsansvarlige skal kunne indsende ansøgningsmateriale elektronisk. Udvalget me-ner, at dette vil kunne lette arbejdsprocessen for de forsøgsansvarlige.Udvalget er ligeledes enigt om, at der fortsat må arbejdes videre med at harmonisere ansøgningsskemaerne forså vidt angår de sager, som både skal behandles i Lægemiddelstyrelsen og komitésystemet. Udvalget anerken-der, at der kan være en række tekniske forhindringer for dette arbejde, men udvalget understreger vigtigheden af,at forskernes veje til godkendelse af forskningsprojekter lettes så meget som muligt for administrative byrder.Anbefaling 37: Ens krav til vurdering af, hvornår en ansøgning er behørigt udformet - hurtigere sagsbehandlings-tidUdvalget anbefaler, at der fastsættes bindende forskrifter for, hvornår en ansøgning er behørigt udformet. Der kani den forbindelse opstilles en række krav til ansøgningen og hvilke bilag, som skal medfølge, fx forsøgsprotokol-
111
len, skriftlig deltagerinformation, beskrivelse af procedurer for afgivelse af mundtlig deltagerinformation, samtyk-keerklæring og annoncemateriale til hvervning af deltager.Udvalget vil gerne påpege, at vurderingen af, hvorvidt en ansøgning er behørigt udformet, ikke er afhængig af an-søgningens materielle indhold – fx vurdering af om deltagerinformationen er forståelig og fyldestgørende. Der-imod skal det af komiteens sekretariat påses, at der fx foreligger deltagerinformation, fuldmagter etc. Komiteenskal herefter (med eventuelt materiel sagsforberedelse fra det relevante sekretariat) – inden for de 60 dage – be-handle projekter og træffe afgørelse, eventuelt med betingelser hvor dette måtte være relevant.Udvalget finder, at fristen skal løbe fra den dag, hvor ansøgningen modtages i komiteerne. De dage, som de regi-onale sekretariater herefter anvender til at undersøge, om ansøgningen er behørigt udformet, skal indgå i de 60dage, såfremt ansøgningen ved modtagelsen er behørigt udformet. Såfremt ansøgningen ikke er behørigt udfor-met, kan komiteens sekretariat kontakte den forsøgsansvarlige med en anmodning om indsendelse af det nød-vendige materiale. Sagsbehandlingsfristen vil herefter løbe fra den dag, hvor det supplerende materiale er mod-taget, og hvor ansøgningen således er behørigt udformet.Udvalget finder ikke anledning til at ændre på, at sagsbehandlingstiden i de regionale komiteer ikke må overskri-de 60 dage – og for tillægsprotokoller 35 dage fra modtagelsen. Udvalget vil dog gerne anbefale, at komiteerneudarbejder ambitiøse servicemål om at behandle sagerne hurtigere end 60 dage. Det bemærkes hertil, at en hur-tig behandling af en ansøgning i komitésystemet kan være vigtig for især yngre forskere, som kan have megetsnævre tidsrammer at arbejde under. En hurtig sagsbehandling vil også være vigtigt i forhold til at fastholde firma-initierede lægemiddelforsøg i Danmark.Anbefaling 38: Større mulighed for delegation fra den forsøgsansvarlige i forbindelse med underskrift på samtyk-keerklæringer.Udvalget anbefaler, at der skabes større mulighed for, at den forsøgsansvarlige kan delegere underskriftskompe-tence til de personer, som afgiver informationen til forsøgspersonen. Udvalget finder, at delegationen bør skeskriftligt, og udvalget understreger, at det naturligvis er den forsøgsansvarliges ansvar, at der bliver en fyldestgø-rende information til forsøgspersonerne.Anbefaling 39: Europæisk harmonisering vedr. indberetninger i forbindelse med lægemiddelforsøg– fortsat årligindsendelse af oversigt over alle alvorlige bivirkninger, men ophævelse af dansk krav om indberetning af hændel-serUdvalget anbefaler, at bestemmelsen i § 22, stk. 4, om indsendelse af oversigt over alle alvorlige bivirkninger ogalvorlige utilsigtede hændelser ændres, således at der i tilfælde af forsøg med lægemidler kun indsendes en listeover alle formodede bivirkninger i overensstemmelse med GCP-direktivet. Udvalget anbefaler, at komitésystemeteventuelt bruger oversigten i forbindelse med deres vurdering af, hvilke forsøg man vil gøre Lægemiddelstyrelsenbekendt med, at man ønsker inspiceret eller eventuelt selv ønsker at deltage i inspektionen af. Udvalget er ikkebetænkelig ved denne ændring, idet Lægemiddelstyrelsen, som det fremgår af ovenstående, fører kontrol medlægemiddelforsøg, og styrelsen har i den forbindelse vidtrækkende kompetencer til at kontrollere iværksatte for-søg.Anbefaling 40: Informationsindsatsen over for forskerne skal styrkes ved tværgående initiativerUdvalget anbefaler, at den nationale komité, Lægemiddelstyrelsen, Datatilsynet, forskningsrådene og universite-terne går sammen om at udarbejde en vejledning til forskerne i form af en ”køreplan” for anmeldelse af videnska-belige forsøg til offentlige myndigheder. Dette vil tydeliggøre sammenhængen mellem de forskellige instansersarbejde.
112
7.6. Økonomiske konsekvenserDet fremgår af udvalgets kommissorium, at udvalgets forslag til en ny struktur for komitésystemet samlet set ikkemå medføre offentlige merudgifter.Udvalget har i kapitel 6 og 7 analyseret og udarbejdet anbefalinger til komitésystemets fremtidige struktur. Somdet ses anbefaler udvalget, at de regionale komiteer fortsat forankres i de fem regioner, samtidig med at den nati-onale komité tilføres en række opgaver og beføjelser. Det er udvalgets opfattelse, at der er væsentlige admini-strative fordele ved at lade det decentrale niveau af komitésystemet være forankret på regionalt niveau, såledesat de regionale komiteer følger den eksisterede regionale struktur. Derved opnås en række økonomiske og admi-nistrative fordele, fx i forhold til lokalefaciliteter og fleksibel brug af kvalificeret personale.Udvalget har ovenfor præsenteret 40 forslag, som kan styrke det videnskabsetiske komitésystem i Danmark. Ud-valget har ikke foretaget en detaljeret analyse af de økonomiske konsekvenser af udvalgets anbefalinger. Anbefa-lingerne indeholder bl.a. serviceforbedringer for brugerne af det videnskabsetiske komitésystem i form af øgetsundhedsfaglig sagsforberedelse, styrkelse af kvalitetsudvikling og kvalitetssikring, smidigere sagsbehandling oglettere anmeldelsesprocedurer. Udvalget anerkender, at enkelte af udvalgets anbefalinger, herunder anbefalingenom øget brug af sundhedsfaglig forberedelse i de regionale sekretariater, kan medføre merudgifter. For så vidtangår udvalgets anbefaling om, at den nationale komité skal behandle særlige, komplekse sager, er det udvalgetsopfattelse, at denne opgave kan løses inden for CVKs nuværende rammer.Udvalget bemærker, at der er behov for en rimelig honorering af komitémedlemmerne, særligt i forhold til for-mandskabet i komiteerne. Samtidig bemærker udvalget, at der er mulighed for at reducere omkostninger i denregionale opgavevaretagelse, bl.a. ved øget anvendelse af formandskabsafgørelser og ved, at et mindre antalsager fremover skal behandles i den nationale komité frem for i de regionale komiteer.Udvalget vil i den forbindelse fremhæve, at gebyrsatserne for behandling af et projekt senest er reguleret i 2003,og at gebyrsatsen ikke er revideret siden da. Det bemærkes ligeledes, at de danske gebyrer set i forhold til enrække europæiske lande er relativt lave, jf. bl.a. kapitel 5. Udvalget anbefaler på den baggrund, at satserne pågebyrernes størrelser justeres.Udvalget ønsker samtidig at fremhæve, at udvalgets anbefalinger udover en række serviceforbedringer også in-deholder mulighed for væsentlige besparelser for erhvervslivet, idet udvalget fx anbefaler, at kravet om dansk-sprogede protokoller fjernes. Et krav som i forhold til det stigende antal multicenterforsøg indebærer en protokol-oversættelse i dag.
113
16. marts 2009
Bilag 1. Kommissorium for udvalg om revision af det
videnskabsetiske komitésystem
BaggrundDet videnskabsetiske komitésystem har til formål at sikre, at biomedicinske forskningsprojekter gennemføres vi-denskabsetisk forsvarligt i en balance mellem forsøgspersoners rettigheder, sikkerhed og velbefindende og devidenskabelige og samfundsmæssige interesser, jf. loven om det videnskabsetiske komitésystem (lov nr. 402 af28. maj 2003 med senere ændringer).Det videnskabsetiske komitésystem består i dag af Den Centrale Videnskabsetiske Komité og ni regionale komi-teer.Siden den første lov på området fra 1992 er der løbende foretaget revisioner af lovgivningen, senest i 2006. Dissehar primært været gennemført som følge af anden lovgivning og international regulering.Det er i flere sammenhænge tilkendegivet, bl.a. i forbindelse med de løbende lovrevisioner, at der er behov for enmere gennemgribende analyse af området med henblik på at vurdere, om den nuværende struktur og styring afkomitésystemet er den mest hensigtsmæssige.Erfaringer fra de regionale komiteers arbejde viser også, at praksis er uensartet, samt at lovgivningen på flereområder er uklar, hvilket giver sig udslag i fortolkningstvivl.Derudover er spørgsmålet om den løbende kontrol af de godkendte forskningsprotokoller, som i henhold til komi-téloven skal udøves af de regionale komiteer, fortsat uafklaret.På denne baggrund nedsættes et udvalg, som har til opgave at udarbejde en betænkning om revision af det vi-denskabsetiske komitésystem med henblik på en revision af lovgivningen herom.Udvalgets opgaverUdvalget får følgende opgaver:•Beskrive og analysere den eksisterende struktur, opgaveportefølje og opgavevaretagelse for det vi-denskabsetiske komitésystem, herunder samspillet mellem de regionale komiteer og Den Centrale Vi-denskabsetiske Komité.•Opstille forslag til en fremtidig forenklet struktur, som sikrer:ooStyring:Ensartet og effektiv sagsbehandling, som sikrer at såvel forsøgspersoners som forsk-ningens interesser tilgodeses.Opgaveportefølje og opgavevaretagelse:Velafgrænset opgaveportefølje og ensartet opgaveva-retagelse under hensyntagen til dansk og international lovgivning, især GCP-direktivet og Euro-parådets biomedicinske forskningsprotokol.oOpfølgning og kontrol:Ensartet og effektiv opfølgning og kontrol med godkendte forskningspro-tokoller114
Arbejdet skal ske under hensyntagen til balancen mellem forsøgspersoners sikkerhed og forskningen, som om-handlet i § 1, stk. 3, i loven om det videnskabsetiske komitésystem.Der skal endvidere tages hensyn til de spørgsmål, som er blevet rejst i forbindelse med tidligere lovrevisioner.Udvalget skal kortlægge de økonomiske og administrative konsekvenser af forslag til en fremtidig struktur, herun-der de fordele, der følger af en mere enkelt struktur. Udvalget skal i den forbindelse vurdere mulighederne for atsammentænke en ny struktur fysisk og/eller administrativt med andre, eksisterende strukturer mv.. Udvalgets for-slag til ny struktur må samlet set ikke medføre offentlige merudgifter.Udvalget kan inddrage erfaringer fra Danmark og udlandet. Udvalget skal selv afgrænse relevante lande.Udvalgets sammensætningUdvalget sammensættes af:•En formand samt 4 medlemmer udpeget af ministeren for sundhed og forebyggelse. De 4 medlemmerskal afspejle ministerområdet bredt (dvs. Ministeriet for Sundhed og Forebyggelse, Sundhedsstyrelsen,Lægemiddelstyrelsen, Statens Serum Institut mv.).••••••••Et medlem udpeget af Ministeriet for Videnskab, Teknologi og UdviklingEt medlem udpeget af Forskningsrådet for Sundhed og Sygdom (FSS)Et medlem udpeget af LægeforeningenEt medlem udpeget af LægemiddelindustriforeningenEt medlem udpeget af Danske RegionerTre medlemmer udpeget af Den Centrale Videnskabsetiske Komité, heraf to der også har sæde i en re-gional komitéEt medlem udpeget af Danske PatienterEt medlem udpeget af Det Etiske Råd
Udvalget kan inddrage anden ekspertise i sit arbejde og efter behov nedsætte arbejdsgrupper m.v.Udvalget skal sekretariatsbetjenes af Ministeriet for Sundhed og Forebyggelse.ProcesUdvalgsarbejdet igangsættes i marts 2009.Udvalget afgiver en samlet betænkning ultimo 2009.
115
Bilag 2. Skriftlige bidrag til udvalgets arbejde
Udvalget er tilsendt en række bidrag og kilder, herunder retskilder, til brug for arbejdet. I forbindelse med udval-gets arbejde har udvalget bl.a. modtaget følgende dokumenter:•••••••••••••Notat fra Lægemiddelstyrelsen, 8. juni 2009, vedr. tilgrænsende emner, der kan belyse forholdet mellemdet videnskabsetiske komitésystem og Lægemiddelstyrelsen.Notat fra Komité A i Region Hovedstaden, juni 2009, vedr. bidrag til revisionsarbejdet.Notat fra LIF, 3. juni 2009, vedr. indledende bemærkninger fra LIF til arbejdet med revision af komitélo-ven.Notat fra Lægeforeningen, maj 2009, vedr. placebodiskussionen ifm. revision af Helsinki-deklarationen.Notat fra Mette Hartlev, 14. juni 2009, vedr. komitésystemets sammensætning og organisation.Notat fra Forsknings- og Innovationsstyrelsen, 13. august 2009, vedr. snitflader mellem det videnskabse-tiske komitésystem og forskningsrådssystemet mv.Notat fra Danske Regioner, 8. juni 2009, om videnskabsetisk kontrol.Notat fra CVK, 7. august 2009, om biologisk materiale fra udlandet.Notat fra LIF, 11. september 2009, vedr. anvendelsen af forsøg med anonymt, biologisk materiale samtcover fra sekretariatet.Notat fra CVK, 10. september 2009, om problemstillinger vedr. komitéloven.Notat fra Lægeforeningen, 22. september 2009, vedr. forskning i akutte situationer.Notat fra Danske Patienter, 29. september 2009, Vedrørende udpegning af lægmænd til komitésyste-met.Notat fra CVK, 11. november 2009, om temaer til evt. 1. instansbehandling i CVK.Herudover er der bl.a. udsendt følgende materiale til udvalgets medlemmer:••CVKs årsberetning, 2008.Relevante artikler fra Businessdk, maj og juni 2009, vedr. udviklingen på forskningsområde, bl.a. ”Østentruer dansk medicinal-forskning”, ”Minister: Vi kan ikke være tilfredse”, ”Dansk medicin testet uden forDanmark”, ”Industrien skærer kraftigt i medicinforsøg i Danmark” og ”Sundhedsministeren sidder mednøglen til løsningerne”, alle af Vibeke Lyngklip Svansø.•Materiale vedr. det norske komitésystem: ”Høring af rapport fra arbeidsgruppen som har vurdert forslagom endret organisatorisk tilknytning for sekretariaterne for de regionale komitéer for medisinsk og helse-faglig forskningsetikk, de nasjonale forskningsetiske komitéer og granskningsutvalget” samt powerpoin-toplæg.••Vejledninger i God Videnskabelig Praksis fra Udvalgene vedrørende Videnskabelig Uredelighed (UVVU).Kommissionens rapport ”Ethics for Researchers” (Facilitating Research Excellence in FP7).
116
Bilag 3. Mindretalsudtalelse fra Danske Regioners repræ-
sentant vedr. betænkningens anbefalinger
Danske Regioners repræsentant har den 26. januar 2010 anmodet om at nedenstående mindretalsudtalelse med-tages i betænkningen om det videnskabsetiske komitésystem i Danmark:”Danske Regioner finder, at et flertal af CVKs medlemmer bør indstilles af de regionale komitéer for at:••••Sikre at den brede befolknings syn på videnskabsetiske problemstillinger repræsenteres i CVK.Sikre tilstrækkelig erfaring med videnskabsetiske problemstillinger i CVK.Styrke rekrutteringen af især forskningsaktive medlemmer til komitésystemet.Opnå en tæt kontakt mellem de regionale komitéer og CVK, så CVKs virke bygger på et solidt kendskabtil det videnskabsetiske arbejde, og så CVKs overvejelser og praksis hurtigt implementeres i de regiona-le komitéers arbejde. Af samme grund bør regioner med flere komitéer udpege flere medlemmer af CVK,og hvert sekretariat for de regionale komitéer bør have adgang til at udpege en observatør uden talerettil CVKs møder.Af hensyn til retssikkerheden bør:••Alle sager behandles af en regional komité som førsteinstans for at sikre forskerne en appelmulighed.Særligt komplicerede sager skal så - iht. nærmere definition - til obligatorisk 2. behandling i CVK.Et medlem af CVK være en jurist på højt niveau (landsdommerniveau) i lighed med andre klageinstanserfor at sikre principielle afgørelsers juridiske holdbarhed.For at styrke rekrutteringen til de videnskabsetiske komitéer bør:•••Lægmænd og forskningsaktive ligestilles, så både lægmænd og forskningsaktive kan være formænd.Alle typer sager behandles af en regional komité som førsteinstans.De forelagte anmeldelser være af høj kvalitet, hvorfor det er vigtigt, at sekretariat og forsker får tid til atdrøfte og tilpasse anmeldelser forud for komité-behandlingen. Derfor bør de eksisterende krav til sags-behandlingstiden videreføres uændret, og det bør tydeliggøres, at anmeldelser skal opfylde de formellekrav til anmeldelser og ikke blot omfatte de krævede dokumenter.For at sikre en effektiv og fleksibel opgavevaretagelse i de regionale videnskabsetiske komitéer sekretariatsfunk-tion er det nødvendigt, at bemandingen af sekretariaterne og deres arbejdsrutiner ikke detailreguleres fra centralthold, som der lægges op til i anbefalingerne.Den foreslåede styrkelse af de regionale videnskabsetiske komiteformandskabers koordinerende rolle som fore-slået i betænkningen, vil indebære en væsentlig øget arbejdsbyrde for formandskaberne.På trods af kravet i kommissoriet om udgiftsneutralitet vil en implementering af anbefalingerne påføre regionernevæsentlige merudgifter.På dette grundlag kan Danske Regioner ikke tilslutte sig følgende anbefalinger: 5-7, 11, 14-16, 21, 29-31 og 36-37.”117
www.sum.dk
Indenrigs- og SundhedsministerietSlotsholmsgade 10-121216 København K.Tlf. 72 26 90 00118Fax 72 26 90 01