Europaudvalget 2008-09
EUU Alm.del Bilag 379
Offentligt
Ministeriet for Sundhed og ForebyggelseDato:13. maj 2009Sagsnr.:0904569Sagsbeh.: SUMPBR / LægemiddelkontoretDok nr:46732
Grundnotat til Folketingets Europaudvalg om Kommissionensforslag til kommissionsforordning om fastsættelse af en grænse-værdi for rester af de veterinære lægemiddelstoffer tiludronsyreog jernfumarat i levnedsmidler
ResuméEn vedtagelse af det foreliggende forslag vil indebære at stoffet tiludronsyre, sådansom det er opført på bilag II til forordning 2377/90 til heste, udvides til også atomfatte fjerkræ. Desuden indebærer forslaget, at jernfumarat indsættes i bilag II tilforordning 2377/90 for alle dyrearter.
1. IndledningKommissionen har den 8. maj 2009 til medlemsstaterne fremsendt forslag til kom-missionsforordning (ENTR/02/2009 - Tiludronic acid and Iron fumarate) om æn-dring af bilag II til Rådets forordning 2377/90 om en fælles fremgangsmåde forfastsættelse af maksimalgrænseværdier for restkoncentrationer af veterinære læge-midler i animalske levnedsmidler. En vedtagelse af forslaget indebærer, at anven-delsen af det veterinære lægemiddelstof tiludronsyre udvides fra heste til også atomfatte fjerkræ. En vedtagelse af forslaget indbærer således, at der ikke fastsættesen bindende grænseværdi for stoffet tiludronsyre til fjerkræ. Desuden indbærer envedtagelse af forslaget, at der ikke fastsættes en bindende grænseværdi for stoffetjernfumarat.Efter forordning 2377/90 skal Kommissionen vedtage bindende grænseværdier forsamtlige de lægemiddelstoffer, der indgår i veterinære lægemidler.Kommissionens forslag til grænseværdi for det enkelte stof udarbejdes på grundlagaf en udtalelse fra Lægemiddelagenturets ekspertudvalg for veterinære lægemidler(CVMP).Kommissionens forslag behandles i en skriftlig procedure, og Kommissionen haroplyst, at medlemsstaternes stillingtagen til forslag skal være formanden i hændesenest den 15. maj 2009. Retsgrundlaget for forslaget er artikel 3, 7 og 8 i for-ordning 2377/90.
2. Forslagets formål og indholdKommissionen foreslår som nævnt, at stoffet tiludronsyre, sådan som det er opførtpå bilag II til forordning 2377/90 til heste, udvides til også at omfatte fjerkræ. Des-
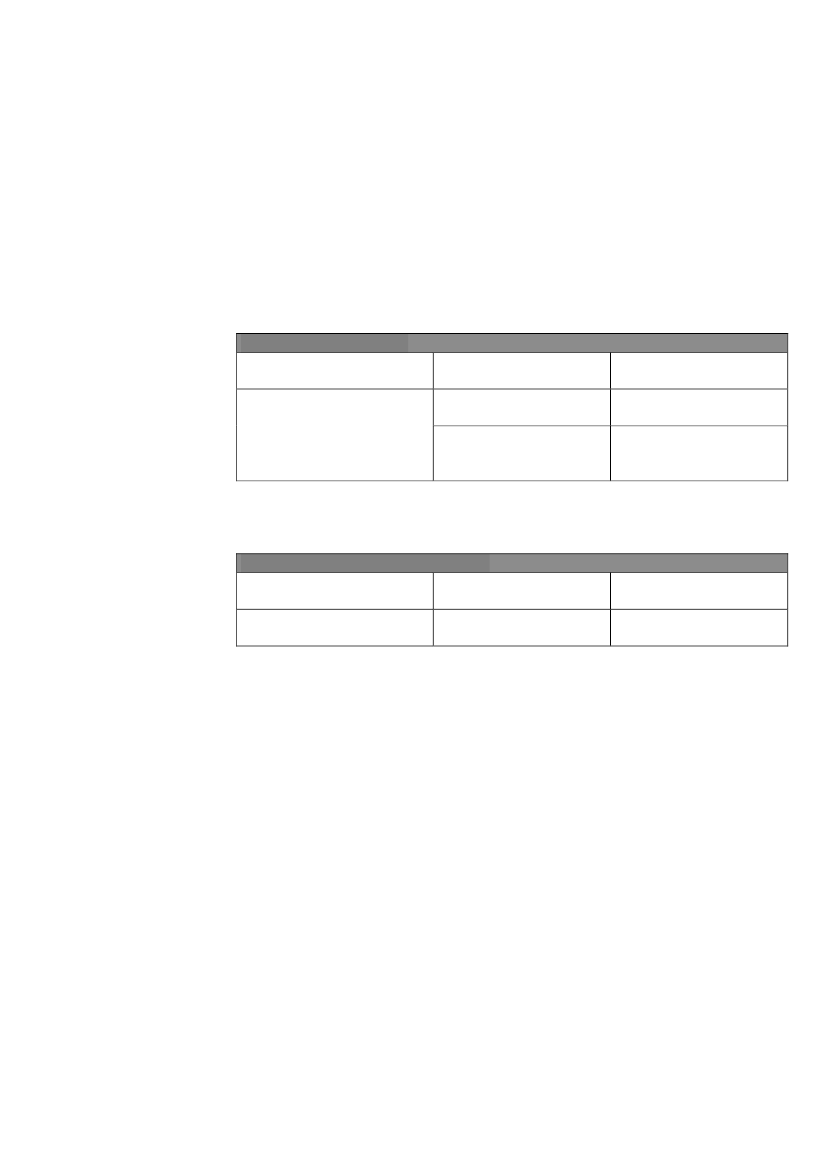
2uden foreslår Kommissionen, at jernfumarat indsættes i bilag II til forordning2377/90 for alle dyrearter.Dette indebærer, at stofferne kan indgå i veterinære lægemidler til behandling aflevnedsmiddelproducerende dyr, og at medlemsstaterne ikke kan forhindre salg afde pågældende levnedsmidler, såfremt disse overholder den for stoffet fastsattegrænseværdi (hvilket for de konkrete stoffer vil sige ingen grænseværdi).Bilag II,som omfatter stoffer, for hvilke der er ikke fastsat en bindende grænse-værdi, ændres således:a) Bestemmelsen om "Tiludronsyre, dinatriumsalt" i punkt 2 affattes således:2. Organiske forbindelserFarmakologisk virksommestoffer"Tiludronsyre (i form afdinatriumsalt)
DyreartHesteFjerkræ (kun til æglæg-gende fugle og til avls-fugle)
Andre bestemmelserKun til intravenøs anven-delseKun til parenteral indgift
b) Den nye bestemmelse om "Jernfumarat" indsættes i punkt 3 efter bestemmelsenom jerndextran:3. Stoffer, som generelt anses for sikreFarmakologisk virksommeDyreartstofferAlle arter bestemt til kon-"Jernfumaratsum”
Andre bestemmelser
Tiludronsyre i form af dinatriumsalt er et syntetisk derivat af pyrofosfat, som hørertil klassen af bifosfonater. Hidtil har lægemiddelstoffet været anvendt til behand-ling af forskellige lidelser i navle og led hos heste efter intravenøs indgift i en dosispå 0,1 mg/kg levende vægt. Lægemiddelstoffet anvendes også til mennesker medPagets sygdom i en dosis på 400 mg per dag i 3 måneder. Pagets sygdom er enknoglesygdom med øget udskiftning af celler i knoglevævet og højt calciumniveaui blodet.Nu foreligger der en udvidelse af indikationen for anvendelse af tiludronsyre tilfjerkræ (æglæggere og avlsfugle) med henblik på at øge æggeskallens kvalitet.Tiludronsyre har specifik påvirkning og effekt på ben/knoglevæv. Den anbefalededosis er en enkelt injektion på 10 mg/kg levende vægt under huden i hønsenes nak-keskind.Der er ikke lavet specifikke metabolisme studier for tiludronsyre på høns, men manhar meget detaljerede studier udført på laboratoriedyr (rotte, mus, kanin, hund, abe)og hest, som viser, at tiludronsyre næsten ikke (hvis overhovedet) undergår meta-bolisme efter indgift i kroppen eller optagelse via munden.Undersøgelser af restkoncentrationer fra væv efter indgift under huden viste, at denmaksimale koncentration kun ville udgøre 88 pct. af det skønnede acceptable dag-lige indtag inden for 12-24 timer efter indgiften. Restkoncentrationer i æg er lave
3og svarer til mindre end 2 pct. af det acceptable daglige indtag. Tiludronsyre injice-res i starten af æglægningsperioden længe før slagtningstidspunktet.Undersøgelserne blev udført efter indgift under huden i æglæggende fugle og avls-fugle, hvorfor ordlyden i bilag II til forordning (EØF) nr. 2377/90 om tiludronsyre iform af dinatriumsalt er fastlagt, således at stoffet kun kan gives parenteralt ifjerkræarter (æglæggende fugle og avlsfugle).Efter at have gennemgået de foreliggende data om undersøgelser af restkoncen-trationer i fjerkræ kunne Udvalget for Veterinærlægemidler konkludere, at der ikkevar behov for at fastsætte maksimalgrænseværdier for tiludronsyre i form af di-natriumsalt, der gives til fjerkræ.Stoffet jernfumarat er ikke opført i bilagene til forordning (EØF) nr. 2377/90. Ud-valget for Veterinærlægemidler blev anmodet om at overveje, om stoffet jern-fumarat burde være omfattet af de vurderinger, der er udført vedrørende andre jern-salte, der allerede er opført i bilag II. I betragtning af, at fumarsyre er et godkendtfødevaretilsætningsstof jf. direktiv 95/2/EF, konkluderede udvalget, at de vurderin-ger, der er udført vedrørende stoffer, som der allerede findes bestemmelser om ibilag II, også bør finde anvendelse på jernfumarat. Det var derfor unødvendigt atgennemføre en yderligere vurdering af jernfumarat, og det var ikke nødvendigt atfastsætte maksimalgrænseværdier for jernfumarat. Stoffet bør derfor indsættes ibilag II for alle dyrearter bestemt til levnedsmiddelproduktion.
3. NærhedsprincippetDer er tale om en gennemførelsesforanstaltning for en allerede vedtagen retsakt.Overvejelser om nærhedsprincippet er derfor ikke relevante.
4. UdtalelserEuropa-Parlamentet skal ikke udtale sig i sagen.
5. Forslagets konsekvenser for DanmarkEfter Fødevarestyrelsens og Lægemiddelstyrelsens opfattelse sikrer forslaget, atindtagelse af kød fra dyr behandlet med tiludronsyre og jernfumarat ikke vil skademenneskers sundhed.Arbejdet med at fastlægge maksimalgrænseværdier for alle veterinære lægemidlervil som helhed betyde en forøgelse af beskyttelsesniveauet for menneskers sund-hed.Før en grænseværdi kan fastlægges, skal der foreligge en grundig gennemgang afblandt andet stoffets toksikologi og nedbrydningsforhold. En maksimalgrænse-værdi fastlægges altså ud fra en grundig sundhedsmæssig vurdering, hvilket daogså for enkelte stoffers vedkommende har betydet, at de har måttet fjernes framarkedet. I modsætning hertil vil et princip om, at rester af veterinære lægemidlerikke kan accepteres, i praksis betyde, at grænseværdien bliver afhængig af analyse-kemikerens valg af metode.
4
Fastlæggelse af maksimalgrænseværdier vil også på en anden måde betyde en for-bedring af sundhedsbeskyttelsen, idet det fra den 1. januar 2000 kun undta-gelsesvist er tilladt at anvende andre stoffer som veterinære lægemidler end dem,der er optaget i bilaget til Rådets forordning 2377/90.For enkeltstoffer vil fastlæggelse af maksimalgrænseværdier i nogle tilfælde bety-de, at man kommer til at acceptere højere indhold end tidligere, hvis grænse-værdien er højere end detektionsgrænsen for kontrolmetoden. I sådanne tilfælde vilder således være tale om en forringelse af sundhedsbeskyttelsen, idet rester af læ-gemidler i levnedsmidler så vidt muligt bør undgås. For andre stoffer vil forholdetkunne være omvendt og altså betyde en forbedring af sundhedsbeskyttelsen, hvisgrænseværdien ligger lavere, end den hidtil anvendte metode har kunnet påvise.En vedtagelse af forslaget vil ikke kræve dansk lovgivning, ligesom der ikke vilvære forbundet økonomiske konsekvenser for staten eller regionerne med for-slagets gennemførelse. En gennemførelse af forslaget skønnes ikke at have af-gørende økonomiske konsekvenser for erhvervene.
6. HøringSager om fastsættelse af grænseværdier for rester af lægemiddelstoffer i levneds-midler forelægges af Lægemiddelstyrelsen for Fødevarestyrelsen på det tidspunkt,sagerne forberedes i Lægemiddelagenturet. Andre myndigheder og organisationerinddrages ikke i disse sager, da disse med ledsagende dokumentationsmaterialeindeholder oplysninger om forretningshemmeligheder af sensitiv karakter.
7. Regeringens foreløbige generelle holdningRegeringen kan støtte forslaget.
8. Generelle forventninger til andre landes holdningerForslaget har været behandlet i ekspertudvalget CVMP, som med enstemmighedhar kunnet anbefale optagelsen på bilag II af lægemiddelstofferne tiludronsyre ogjernfumarat.Forslaget har ikke været drøftet i EU-regi efter behandlingen i CVMP, hvorforforhandlingssituationen er uafklaret.Det forventes, at hovedparten af medlemsstaterne kan støtte forslaget.
9. Tidligere forelæggelse for Folketingets EuropaudvalgForslaget har ikke tidligere været forelagt for Folketingets Europaudvalg.